八珍汤中芍药苷的质量浓度测定
张大雷,张吉林,才志成
(黑龙江省公安厅刑事技术总队,哈尔滨150008)
八珍汤源自古方《正体类要》,是四君子汤和四物汤的合方,由人参、熟地、川芎、白芍、当归、茯苓、白术、甘草8味中药组成,经古今广泛临床实践证明可同时具备补气补血双重功效的经典方剂[1-3].其中芍药苷是八珍汤的重要活性成分之一,具有有降低血液黏度、抗血小板聚集、改善微循环、扩张血管、神经保护、降血糖、抗氧化、抗惊厥等作用[4-6].因此,本文选择芍药苷作为目标成分对八珍汤复方进行质量浓度测定.
1 材料与方法
1.1 仪器与试剂
Waters高效液相色谱仪(W2695Separations Module、W2996Photodiode Array Detector、自动进样器,Empower化学工作站);751型紫外可见分光光度计(上海光谱仪器有限公司);R-201旋转蒸发仪(上海申生科技有限公司);恒温水浴锅;真空干燥箱(上海一恒仪器有限公司);电子天平(美国奥好斯科技有限公司);DPS统计软件(北京中农博思科技发展有限公司).
芍药苷(中国药品生物制品检定所,批号为:110736-200320);乙腈为色谱纯,其余试剂均为分析纯;水为二次蒸馏水.所有药材人参(Panax ginseng C.A.Mey.)、熟地黄(Radix Rehmanniae praeparata)、白芍(Paeonia lactiflora Pall.)、当归(Angelica sinensis(Oliv.)Diels)、白术 (Atractylodes macrocephala Koidz.)、茯 苓 (Poriacocos(Schw.)Wolf)、川芎(Ligusticum chuanxiong Hort.)、甘草(Glycyrrhiza uralensis Fisch.)均经鉴定符合中国药典2005版规定的质量标准要求.
1.2 色谱条件
色谱柱:Symmetry C18(4.6 mm ×250 mm,5 μm);流动相:乙腈 -0.05%磷酸水溶液(15∶85);检测波长:230 nm;流速:1.0 mL/min;柱温:30 ℃;进样量:20 μL.

图1 (A) 芍药苷空白样品色谱图(B)样品中芍药苷色谱图(C)芍药苷标准品色谱图
1.3 系统适应性试验
取供试品溶液10 μL,注入高效液相色谱仪测试,芍药苷的保留时间为tR=8.273 min,理论塔板数以芍药苷计不低于5 000,芍药苷色谱峰与相邻未知色谱峰的分离度大于1.5.
1.4 空白实验
按处方比例,制成不含芍药的阴性样品溶液,按上述色谱条件进样,结果在芍药苷保留时间8.273 min处没有峰,说明其他成分对芍药苷的测定无干扰.见图1(A)、(B)、(C).
1.5 标准曲线的制备
精密称取芍药苷标准品,甲醇定容,配成质量浓度分别为0.014、0.028、0.056、0.112、0.224 mg/mL的对照品溶液,分别取20 μL注入高效液相色谱仪中,在上述色谱条件下进样分析,以芍药苷质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,并计算线性回归方程.测得芍药苷的线性回归方程为 Y=40798281 X+2855,r=0.9998(n=5),结果表明:芍药苷在0.014~0.224 mg/mL范围内呈良好线性关系.结果见表1.

表1 高效液相测定芍药苷标准溶液峰面积值结果(n=5)
1.6 精密度实验
分别精密吸取芍药苷(0.028 mg/mL)对照品溶液,连续5次进样,测定芍药苷的峰面积,测得芍药苷峰面积的RSD值分别为0.37%(n=5),表明该方法精密度良好.结果见表2.
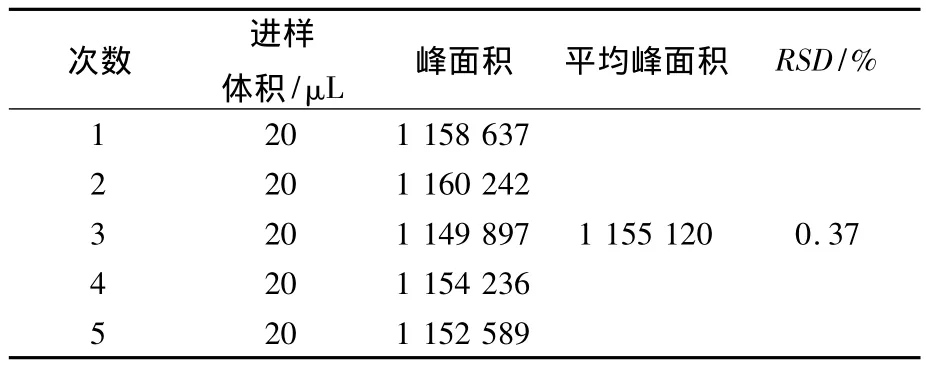
表2 芍药苷精密度实验结果(n=5)
1.7 稳定性实验
分别精密吸取样品溶液,在 0、3、6、12、24 h 分别进样分析测定,测定芍药苷的峰面积,并计算RSD值,考察所测成分芍药苷在0~24 h内的稳定性.测定芍药苷峰面积的RSD值分别为0.34%(n=5),结果显示其在0~24 h内稳定.结果见表3.
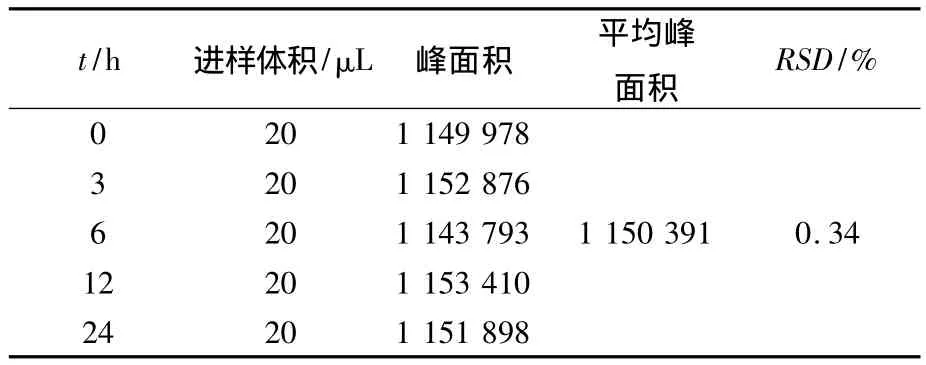
表3 样品中芍药苷稳定性实验结果(n=5)
1.8 重复性实验
分别平行制备5份样品溶液进样,测定样品中芍药苷的质量浓度,并计算RSD值,考察方法的重复性.测得样品中芍药苷的质量浓度分别为2.2260 mg/g,RSD 值为1.65%(n=5),结果表明本方法的重复性较好.结果见表4.

表4 样品中芍药苷重复性实验结果(n=5)
1.9 回收率实验
取已测得芍药苷质量浓度的样品溶液各9份,分别加入相当于样品80%、100%、120%的芍药苷对照品溶液,测定芍药苷的质量浓度,计算加样回收率,并计算RSD值.测得芍药苷的回收率为98.85%,RSD 为0.08%(n=3).结果见表5.

表5 芍药苷加样回收率(n=3)
2 样品测定
精密称取八珍汤浓缩浸膏适量,用甲醇溶解,定容于5 mL的容量瓶中,摇匀,并用微孔滤膜(0.45 μm)过滤后进样,测定峰面积,计算样品中芍药苷的质量浓度.结果见表6,色谱图见图1.

表6 样品中芍药苷质量比测定结果(n=3)
3 结语
本实验建立了八珍汤复方中芍药苷的HPLC测定方法,线性范围宽、稳定性好、重现性好、专属性强、操作简便、无干扰,对八珍汤的质量控制具有重要的意义.本方法同样适用于八珍汤苷类部位中芍药苷的质量比测定,对苷类部位纯化工艺研究和进一步开发提供了理论依据.
[1]郭晓娜,封银曼.八珍汤临床及实验研究进展[J].光明中医,2007,22(4):62-63.
[2]张 超,南莉莉,孙 志,等.八珍汤物质基础及其药理学研究进展[J].上海医药,2008,29(6):273-276.
[3]潘洪平.八珍汤的药理研究和临床应用[J].中成药,2003,25(11):附2-附4.
[4]高小荣,田庚元.白芍化学成分研究进展[J].中国新药杂志,2006,15(6):416-418.
[5]郑世存,李晓宇,欧阳兵,等.芍药苷药理作用研究新进展[J].中国药物警戒,2012,9(2):100-103.
[6]孙丽荣,曹 雄,侯凤青,等.芍药苷研究进展[J].中国中药杂志,2008,33(18):2028-2032.

