载药蒙脱石/丙烯酸树脂微球的制备与体外释放性能的研究
桂茹艺,侯冬枝*,潘育方,刘 莉,赖意华,张兰春,胡 晟,林永芳,平其能(.广东药学院药科学院,广州 50006;.中国药科大学药学院,南京 0009)
盐酸倍他洛尔(betaxolol hydrochloride)是一种优异的心脏选择性受体阻滞剂,临床主要用于中度高血压和心绞痛,其滴眼剂用于治疗眼内压增高和开角型青光眼。关于眼部疾病的治疗仍然存在很大的挑战,在眼部治疗中主要存在的问题是很难在治疗部位达到有效的药物浓度并维持一定的治疗时间以达到治疗效果[1]。活性化合物的局部滴注是眼部疾病治疗的首选途径,然而由于眼睛固有的特殊的保护机制使其对外来物质有排斥作用,因此,所给药物生物利用度很低[2]。由此可见,开发能够克服眼部屏障的缓释眼用制剂具有广阔的前景。蒙脱石(montmorillonite,MMT)是一种层状结构的硅酸盐粘土矿,比表面积巨大,其层间具有阳离子可交换性, 单位晶胞中剩余的负电荷为0.66,因此,其层间域是一个良好的化学反应场所,不但可以吸附水分子,而且可以吸附有机物质,如药物分子[3-5]。此外,蒙脱石毒性极低,无法测出LD50,小鼠每日最大耐受量可达36 g·kg-1。因此,蒙脱石可以作为一种新型药物载体应用于离子交换给药系统中。以丙烯酸树脂为膜材制备的包裹载有药物的蒙脱石缓控释微球,能够使盐酸倍他洛尔在眼部疾病治疗中达到缓控释作用。至今,国内外相关方面的文献报道较少,蒙脱石在缓控释制剂领域的药用价值还需大力开发,其前景十分广阔。本实验采用油包油溶剂挥发法制备丙烯酸树脂包裹的蒙脱石载药的缓控释微球[6],通过正交实验设计优化最佳处方。
1 仪器与试药
1.1仪器 UV754N紫外分光光度计(上海精密科学仪器厂);数显恒温水浴锅(江苏金坛市宏华仪器厂);E103G光学显微镜( Classica);微型旋涡混合仪(XW-80A,上海泸西分析仪器有限公司);BL-220H电子天平(日本岛津公司 );KQ5200超声波清洗器(东莞市科桥超声波设备有限公司);QUANTA400F扫描电镜(FEI,USA)。
1.2试药 盐酸倍他洛尔(质量分数99.5%,批号20110615,济南浩化实业有限公司);渗透型丙烯酸树脂(eudragit RS,eudragit RL,德国Degussa公司);医用蒙脱石(MMT,浙江三鼎科技有限公司);其他试剂均为分析纯。
2 方法与结果
2.1载药蒙脱石微球的制备
2.1.1载药蒙脱石微球的制备方法 采用O/O溶剂挥发法制备微球,精密称取适量载药蒙脱石、盐酸倍他洛尔 、丙烯酸树脂、柠檬酸三乙酯、甘油、吐温80,加入到乙腈与二氯甲烷混合溶液中,此混合溶液为内油相。外油相为含司盘80的轻质液体石蜡。将内油相逐滴加入到外油相,在4 ℃下超声乳化10 min,搅拌速度为800 r·min-1,乳化10 min,将转速调至300 r·min-1,在25~30 ℃挥发有机溶剂,待溶液呈澄清状态,离心,用正己烷清洗,备用。
2.1.2正交实验的设计 通过单因素考察,选择柠檬酸三乙酯及甘油用量、膜材用量及膜材比例、乳化剂用量及比例、内外相体积比等7个因素进行正交设计。蒙脱石载药微球制备工艺L18(73)正交实验的因素水平见表1。实验中以载药量、包封率和释放度为考察指标。对载药量、包封率和释放度做综合评分,三者的加权系数分别为0.3,0.3和0.4,即:

式中载药量最高值、包封率最高值、释放总评分最小值分别指正交实验中最高的载药量、最高的包封率和最小的释放总评分,载药量、包封率、释放评分是指18次实验中每次实验所测到的相应数据(如表2所示)。F评分越高者,表明工艺越好。实验设计及结果见表2,方差分析结果见表3。

表1 正交实验因素水平
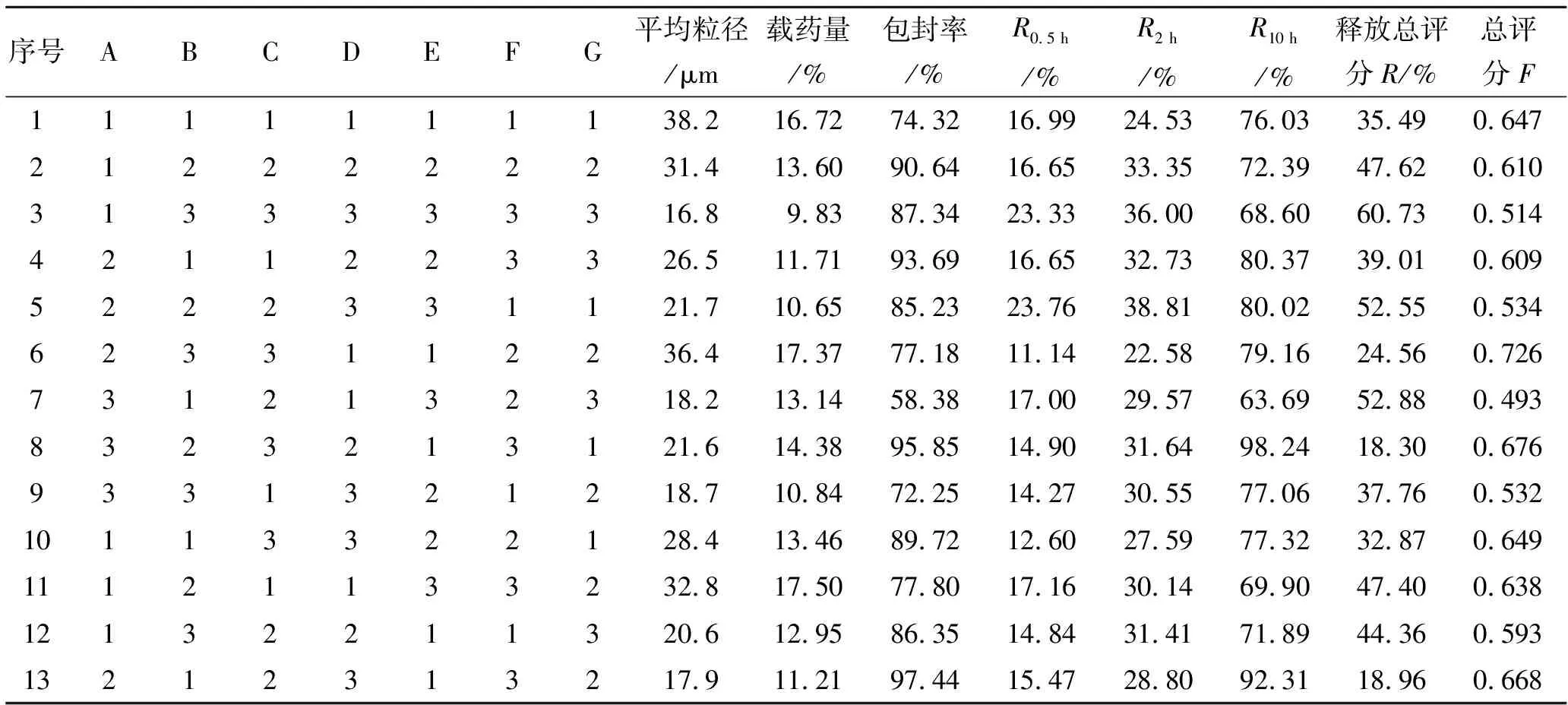
表2 正交实验优化微球制备工艺与结果
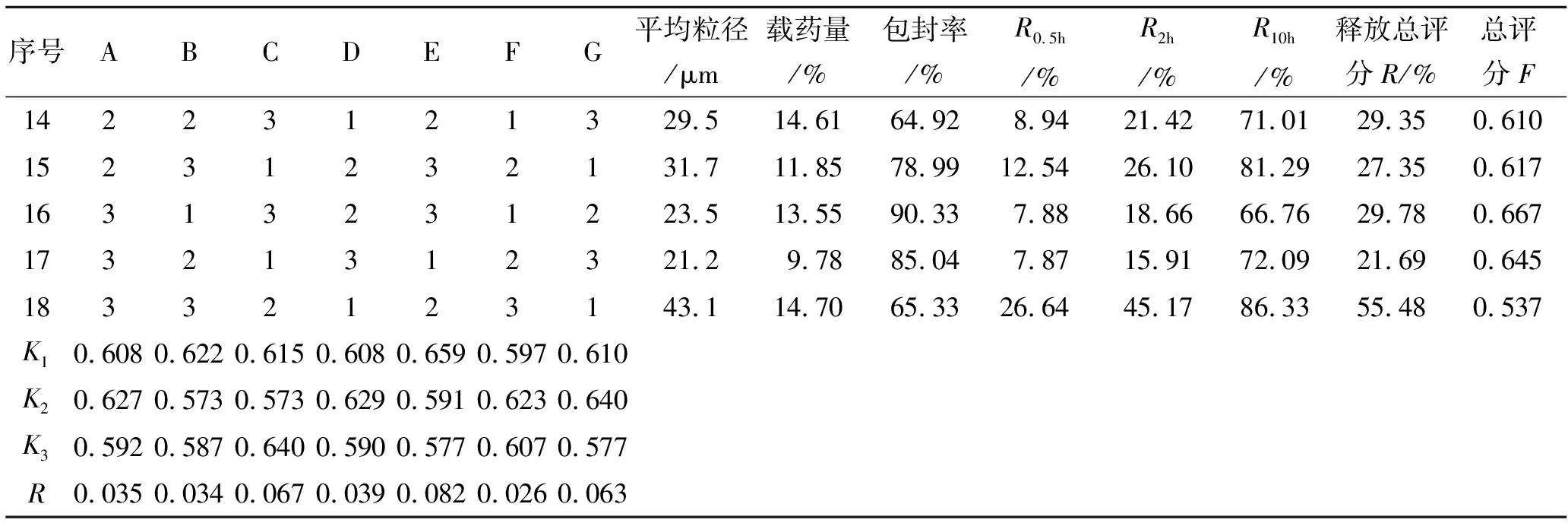
表2(续) 正交实验优化微球制备工艺与结果
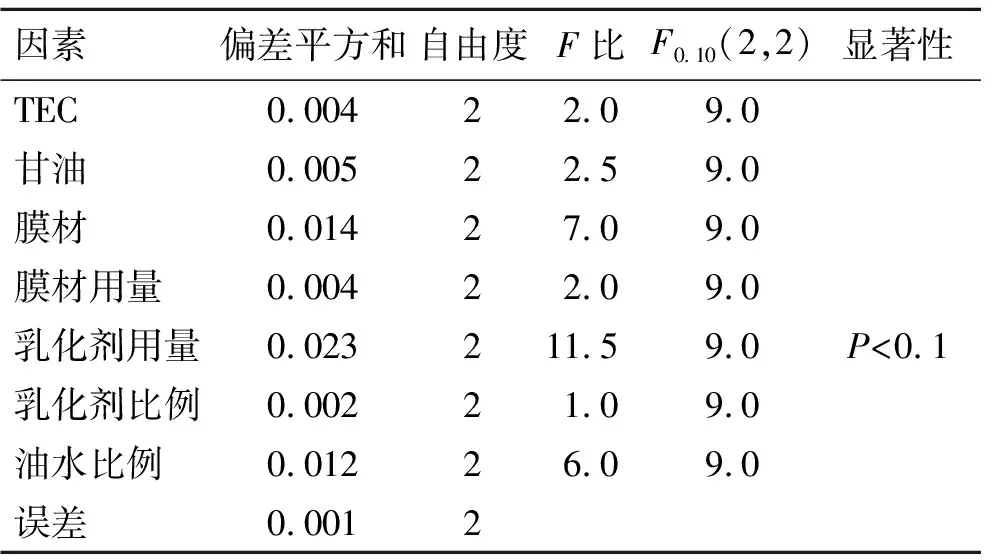
表3 正交优化实验组微球释放方差分析
根据表2的均值K的分析,得到正交优化的最佳工艺为A2B1C3D2E1F2G2,即为TEC用量20%,甘油用量10%,膜材RS∶RL为1∶3,膜材用量为300 mg,乳化剂吐温80∶司盘80(1∶2)共1.5%(质量比),内外相体积比为1∶6。表3方差分析显示,7个因素中乳化剂用量有较显著性差异(P<0.1),因素影响程度由大到小为E>C>G>D>A>B>F,即乳化剂用量>膜材比例>内外相体积比>药物膜材比>TEC>甘油>乳化剂用量。
2.2微球粒径分布与形态学的测定 按照《中国药典》(2010年版附录ⅨE)粒度和粒度分布测定法,取少量盐酸倍他洛尔微球粉末,平铺于载玻片上,采用光学显微镜法对粒径分布与形态进行观察。另取少量微球,经喷金后,扫描电镜观察其表面特征。以频率(每一粒径范围的粒径个数除以粒子总数所得的百分率)为纵坐标、粒径为横坐标,得粒径分布直方图[7],如图1所示,测得的包裹载药蒙脱石的微球粒径分布较均匀,平均粒径为20.7 μm,微球粒径分布的跨距为0.636,符合制备混悬滴眼液的要求。肉眼观察,蒙脱石载药微球为白色粉末,细腻均匀,光学显微镜下观察,微球外形圆整,粒径分布均匀,无粘连情况。扫描电镜下观察可见MMT-BH微球表面略有粗糙感并未见到孔洞,如图2所示。

图1 蒙脱石载药微球的粒径分布

图2 最优处方MMT-BH微球扫描电镜图片
2.3包封率与载药量的测定 精密称取盐酸倍他洛尔微球30 mg,用1 mL二氯甲烷超声震荡1 h使微球完全溶解,再向其中精密移取30 mL的蒸馏水涡旋2 min,震荡2 h使二氯甲烷中药物被水充分萃取,以3 000 r·min-1离心10 min,取上清液过滤,稀释适当倍数,在274.5 nm波长处测定吸光度,计算其药物含量,并按公式(1)和(2)计算载药量与包封率:

(1)

(2)
按照上述载药量测定条件对5批最优处方微球的载药量进行测定,得微球的平均载药量为14.31%±0.47%,平均包封率为94.35%±1.01%。
2.4体外释放性能考察 精密称取适量微球,置于含有5 mL的人工泪液透析袋中,扎紧透析袋两端,将透析袋置于35 mL的人工泪液中,水浴温度为34 ℃,在规定的时间取5 mL样品并补充5 mL新鲜介质,274.5 nm处紫外分光光度法测定其吸光度。以释放时间对药物释放率绘制释放曲线并对微球释放性能进行动力学拟合。结果微球的突释量Q0.5 h为9.24%±2.5%,累积释放量可达到96.88%±1.5%,可持续释放时间为11 h。《中国药典》2010年版附录ⅪⅩ D“缓释、控释和迟释制剂指导原则”对缓释制剂的取样点有明确规定,除另有规定外,从释药曲线图中至少选出3个取样点,一般情况下,第一点为开始0.5~2 h的取样时间点(累积释放率<30%),用于考察药物是否有突释;第二点为中间取样时间点(累积释放率约50%),用于确定释药特性;最后的取样时间点(累积释放率>80%),用于考察释药量是否完全。结果表明该微球的释放度符合规定。
对微球的释放动力学进行研究,按照目前研究拟合的主要动力学方程模型进行拟合,拟合结果见表4。由表4可见,这5种模型做拟合后的线性相关性依次为一级动力学>Ritger-Pappas方程>Weibull方程>Higuchi方程>零级动力学。一级动力学方程的线性相关性最好,达到0.991 5,说明微球中的药物的释放方式主要是以扩散为主。

表4 MMT-BH微球的拟合方程
3 讨论
由于眼器官具有特殊的保护机制,使其对外来物质产生排斥作用,通常所给药剂量的大部分不能有效进入眼组织,从而导致滴眼液眼部生物利用度很低,对需要长期治疗的眼部疾病(如青光眼),即使反复使用也很难达到持效[8]。因此,设计能够改善药物生物利用度的新型眼部给药系统是非常必要的。为了改善MMT-载药的缓释性能并增加其累积释放率,本实验以丙烯酸树脂为膜材,对MMT-BH做进一步包裹,制备了包裹载药蒙脱石的缓控释微球。在单因素考察的基础上,选择了柠檬酸三乙酯及甘油用量、膜材比例及用量、乳化剂比例及用量、内外相体积比等7个因素,分别取其3水平设计正交实验来优化微球制备工艺。以载药量、包封率及释放参数为指标,综合加权评分法评价制备工艺,正交实验优化的最佳工艺为A2B1C3D2E1F2G2,即为TEC用量20%,甘油用量10%,膜材RS∶RL为1∶3,膜材用量为300 mg,乳化剂为吐温80∶司盘80(1∶2)共1.5%,内外相体积比为1∶6。所得微球外观圆整,粒径分布较均匀,平均载药量为14.31%±0.47%,平均包封率为94.35%±1.01%,微球持续释放11 h,释放符合一级动力学方程,体外释放研究表明,微球具有一定的缓释作用。
参考文献:
[1] Bucolo C, Maltese A, Drago F. When nanotechnology meets the ocular surface[J]. Expert Rev Ophthalmol,2008, 26(3): 325-332.
[2] Fuente M, Ravia M, Paolicelli P, et al. Chitosan-based nanostructures: A delivery platform for ocular therapeutics[J]. Adv Drug Deli Rev, 2010, 18(62): 100-117.
[3] Lin F H, Lee Y H, Jian C H. A study of purified montmorillonite intercalated with 5-fluorouracil as drug carrier[J]. Biomaterials,2002,23(6): 1981-1987.
[4] Jin K P,Young B C,Jae M O. Controlled release of donepezil intercalated in smectite clays[J]. Int J Pharm,2008,359(5): 198-204.
[5] Zhen J P, Luan L, Wang H Y. Study on ibuprofen/montmorillonite intercalation composites as drug release system[J]. Appl Clay Sci,2007,36(8): 297-301.
[6] 侯永恒,侯冬枝,李津南,等.镶嵌蒙脱石载体的离子交换微球给药系统的研制[J].西北药学杂志,2012,35(6): 326-329.
[7] 刘子荣,王典,鲁传华,等.胶束増溶硝苯地平缓释微球的制备及体内药动学研究[J]. 中国药学杂志, 2013,48(3): 191-196.
[8] Choy Y B, Park J H, Prausnitz M R. Mucoadhesive microparticles engineered for ophthalmic drug delivery[J]. J Physic Chem Solid,2008,69(10): 1533-1536.

