钻孔引流术与小骨窗开颅术治疗高血压大脑皮层下出血的疗效比较
王育胜 黄正华 蔡少明 邱平华
揭阳市人民医院神经外科,广东揭阳 522000
高血压脑出血是临床上较为常见的出血性卒中,其病情凶险,致残率、致死率较高,严重威胁人类生命安全,且极易遗留后遗症影响患者日常生活。随着人类生活方式的改变,目前高血压病的发生率日趋增长,高血压大脑皮层下出血在老年患者发病率也逐渐升高,目前临床上对高血压大脑皮层下出血的治疗,若为较少量出血(一般出血量<30 mL),可通过药物保守治疗;若大脑皮层下出血量>30 mL,则需行手术治疗,抢救生命[1-2]。传统的开颅术,其创伤较大,并发症多,目前临床越来越多应用钻孔引流术与小骨窗开颅术来清理血肿,治疗高血压大脑皮层下出血,其明显减少了并发症的发生率,同时提高了患者生活自理能力[3]。现分析2009年1月—2012年12月间该院收治的50例高血压大脑皮层下出血住院患者的临床资料,进一步探讨钻孔引流术在高血压大脑皮层下出血临床治疗的可行性,报道如下。
1 资料与方法
1.1 一般资料
选取该院住院高血压脑出血患者50例。所有入组患者年龄为50~70岁,既往均有高血压病史,入院时患者收缩压多高于180 mmHg,经头颅CT 确诊为大脑皮层下出血,出血量为30~60 mL,排除外伤性出血。钻孔引流术治疗组和小骨窗开颅治疗组各25例,两组患者的年龄、性别、出血量、出血部位、术前神经功能缺损程度及术前生活自理能力评分比较,差异无统计学意义(P>0.05),见表1、表2。
表1 两组患者基本资料比较(±s)
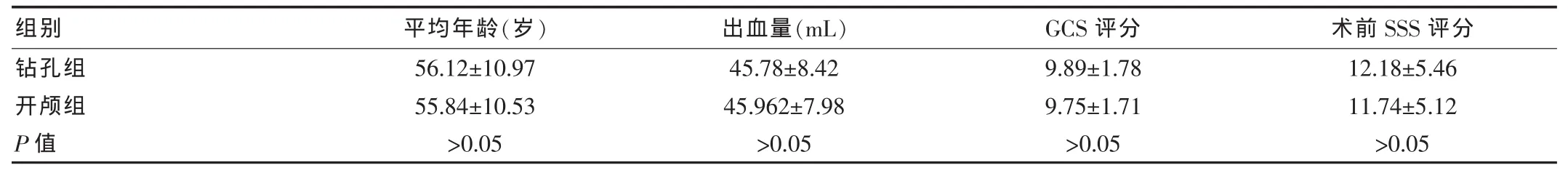
表1 两组患者基本资料比较(±s)
组别钻孔组开颅组P 值平均年龄(岁)56.12±10.97 55.84±10.53>0.05出血量(mL)45.78±8.42 45.962±7.98>0.05 GCS 评分 术前SSS 评分12.18±5.46 11.74±5.12>0.05 9.89±1.78 9.75±1.71>0.05
1.2 治疗方法
两组患者均签署知情同意书,尽早实施手术治疗,对于病情稳定的患者,可推迟手术至发病6h实施,患者术后均转至监护病房。具体手术方法:钻孔引流术:术前以CT 定位,将血肿最厚处作穿刺点。患者头皮取直切口,长度大约4 cm。以电钻于颅骨钻孔,之后“十”形将硬脑膜切开。电凝硬脑膜和皮质血管,将12号脑室外引流管放置在血肿腔中心处,将引流管的远端连接上10 mL 规格注射器。慢慢抽吸颅内血肿,通常首次抽吸不能大于血肿总量2/3,防止血肿腔内形成骤降压力导致再次出血。术后隔天复查CT,定位残余血肿量和引流管部位,酌情实施调整。若残余血肿量多,在引流管中灌注药物尿激酶,剂量在20 ×103~40 ×103U,1~2次/d。每次在闭管2h之后开放, 连接引流袋自行引流。待CT 显示血肿残量<10 mL 则可拔管。通常置管3~5 d。小骨窗开颅术:术前以CT 定位,对头皮做一小面积弧型切口,做面积约3 cm×3 cm的骨窗,十字形剪开硬脑膜,对脑内血肿进行脑针穿刺探查,皮层缺口<2 cm,避开功能区,清除血肿的60%以上,手术过程使用显微镜,留置引流管,缝合硬脑膜。
1.3 评价指标
①使用SSS(中风量表)[4]测定术前及治疗14 天时两组患者的神经功能改善情况;②采用Rankin量表(MRS)[5]测定治疗14 天及治疗3个月时两组患者的日常生活能力恢复情况;③治疗3个月时的日常生活能力恢复情况评价,分别采用Barthel 指数表和MRS 评分[6];④记录患者死亡及并发症情况。
1.4 统计方法
采用SPSS17.0 数据软件对所得数据进行统计学分析,计数资料采用 χ2检验,计量资料采用均数±标准差(±s)表示,进行t检验。
2 结果
2.1 两组患者的并发症及死亡情况
钻孔引流术在呼吸道感染、消化道出血、电解质紊乱、再出血并发症方面明显低于小骨窗开颅组,差异有统计学意义(P<0.05);小骨窗开颅组并发症发生率明显高于钻孔引流术,差异有统计学意义(P<0.05);住院期间,钻孔引流术有1例死亡,小骨窗开颅组有1例死亡,两组比较差异无统计学意义(P>0.05)。见表2。
2.2 两组患者治疗
14d及治疗3个月时的SSS评分、MRS评分和Barthe1指数比较治疗14 d时,两组患者SSS量表及MRS量表均差异无统计学意义(P>0.05);术后3个月时,钻孔组患者MRS量表及Barthe1指数优于开颅组,差异有统计学意义(P<0.05)。见表3。
3 讨论
高血压脑出血的发病率、病死率及致残率均较高,在存活者中也有许多患者遗留有后遗症[7]。脑出血后血肿对脑组织损伤机制可能是:①由于血肿直接挤压脑组织,导致局部微血管缺血性改变,血肿周围脑组织出现水肿、坏死,出现相应功能障碍;②颅内压升高,影响脑血流,致脑组织供血不足;③血凝块释放的血管活性物质,如激肽、组胺及5-羟色胺等引起局部脑组织的缺血缺氧[8]。对于高血压大脑皮层下出血,如出血量大于30 mL的中重度出血,临床多需给予手术治疗,如何选择合适的手术方式,降低病死率及致残率,无疑是该类患者预后及康复的重要因素。
该研究通过对50例高血压大脑皮层下出血患者采取微创钻孔引流术与小骨窗开颅术的疗效比较,结果显示,治疗后14 d,日常生活能力及神经功能缺损程度两组比较,差异无统计学意义(P>0.05),并发症发生率开颅组明显高于钻孔组(P<0.05);治疗后3个月,患者自理能力评分Barthel 指数及MRS量表测评,钻孔组明显优于开颅组(P<0.05)。钻孔组与开颅组在死亡率方面无明显差异。钻孔组在呼吸道感染、消化道出血、电解质紊乱及再出血方面的发生率明显低于开颅组(P<0.05);颅内感染、肾功能衰竭、心衰及尿道感染的发生率差异无统计学意义(P>0.05)。由于大脑皮层下出血量<60 mL的患者,其血肿一般较局限、较集中,改类患者颅内压尚在代偿范围内,无论行开颅手术或行钻孔引流术均有可能清除大部分血肿,一旦得到部分减压后其脑受压即及时得到解除[9],所以微创组与开颅组在死亡率方面无明显差异。而术后并发症及术后3个月自理能力钻孔组与开颅组有明显差异,这可能是由于小骨窗开颅术在清除血肿时,常需在气内全麻下进行,该术式持续时间长,脑组织暴露面积大,且术中出血多,不利于术后病情恢复,该治疗组患者术后较易出现呼吸道感染、消化道出血、电解质紊乱等并发症;而钻孔引流术多在复合麻下,甚至有一部分患者在局麻下进行手术,手术往往能在数分钟内一步到位将引流管置入血肿腔,相对而言,该类手术操作简便,耗时短,脑组织暴露面积小,术中出血少,有利于病情恢复及降低术后并发症。另外,由于小骨窗开颅术在清除血肿时,手术由于牵拉刺激患者脑组织,出现脑组织损伤水肿坏死,相应功能障碍。而钻孔引流术在定位操作过程中尽可能远离脑皮层血管以及功能区域,置管完成后即可引流患者颅内血肿,减小颅内压,防止大脑进一步发生毒性反应[10],手术结束之后以尿激酶溶解血肿,将血肿排出体外,最终降低损害,有利于患者长期病情恢复及降低再出血风险。
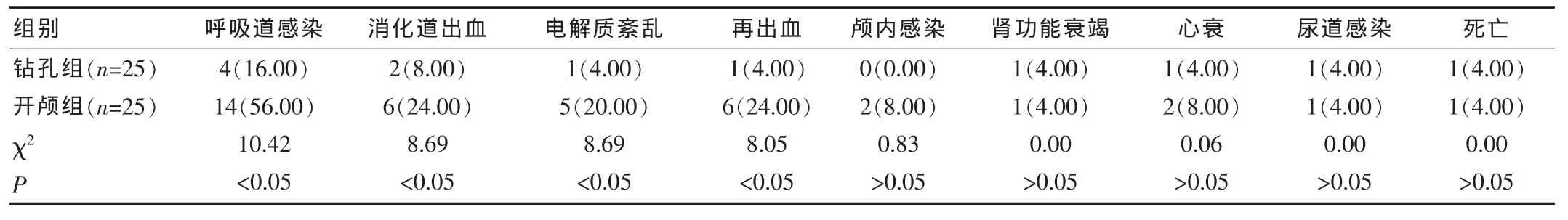
表2 两组患者的并发症情况比较[n(%)]
表3 两组患者不同时点的各项评分比较(±s)
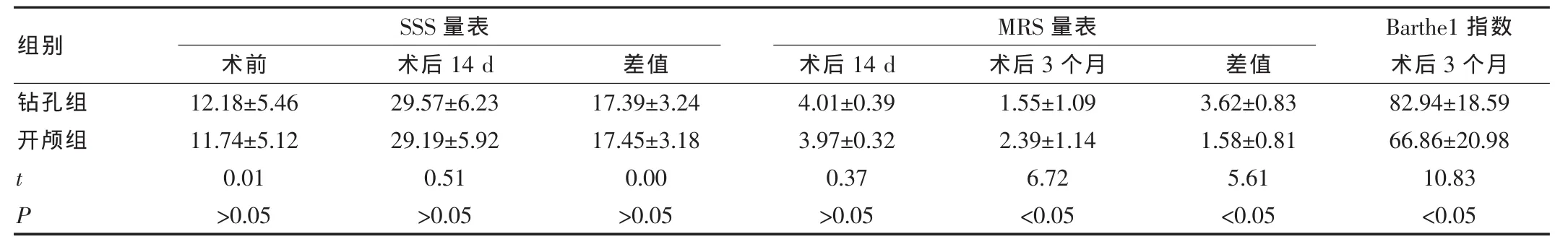
表3 两组患者不同时点的各项评分比较(±s)
组别钻孔组开颅组tP术前12.18±5.46 11.74±5.12 0.01>0.05 SSS量表术后14 d 29.57±6.23 29.19±5.92 0.51>0.05差值17.39±3.24 17.45±3.18 0.00>0.05术后14 d 4.01±0.39 3.97±0.32 0.37>0.05 MRS量表术后3个月1.55±1.09 2.39±1.14 6.72<0.05差值3.62±0.83 1.58±0.81 5.61<0.05 Barthe1 指数术后3个月82.94±18.59 66.86±20.98 10.83<0.05
综上所述,钻孔引流血肿术较小骨窗开颅血肿清除术的并发症少,后遗症少,生活能力恢复好,创伤小,更易被接受。但影响并发症及生活自理能力恢复的因素,除了客观的手术方式不同外,与术者手术操作熟练程度、无菌观念及手术时机等也有密切联系。
[1]马立鑫,陈海滨.术前GCS 在高血压基底节区脑出血术式选择中的意义[J].中国临床神经外科杂志,2010,15(2):110-112.
[2]姜勇,张爱军,高军,等.高血压脑出血手术适应证多因素分析和数学模型的建立[J].中国临床神经外科杂志,2011,8(1):27-31.
[3]王京宽.80例高血压脑出血患者手术治疗分析[J].中西医结合心脑血管病杂志,2012,10(8):1004-1005.
[4]陈祎招,林波淼,徐如祥,等.神经内镜高血压脑出血微创手术的三维重建手术定位[J].中华神经医学杂志,2011,10(3):280-283.
[5]石奕,黄媛.临床观察48例高血压性脑出血微创治疗[J].海南医学,2008,19(8):108-109.
[6]马力,崔洁,贺崇欣,等.小骨窗开颅血肿清除率对高血压脑出血的预后影响[J].立体定向和功能性神经外科杂志,2008,21(5):290-292.
[7]刘少录.微创显微手术治疗高血压脑出血200例分析[J].中国当代医学,2006,5(13):75.
[8]赵继宗,周定标,周良辅,等.2464例高血压脑出血外科治疗多中心单盲研究[J].中华医学杂志,2005,85(32):238-242.
[9]王祖炯,郑秀珏.小骨窗微创手术治疗42例高血压基底节区脑出血[J].现代医学,2002,30(4):243-244.
[10]张光亮,徐忠烨,马颖,等.不同方法治疗高血压脑出血的效果分析[J].中国临床神经外科杂志,2012,17(3):129-132.

