离子液体与水混合溶剂应用于微晶纤维素溶剂液化研究
王青跃,陈启宇
(日本国立埼玉大学 理工学研究科,日本 埼玉市 3380825)
纤维素作为可再生资源的开发和利用对解决人类面临的资源危机问题和新功能材料的开发具有重要意义。在早期的研究中,Rogers 等[1]发现了纤维素能够部分溶解于离子液体中,这一发现开创了纤维素资源利用的全新领域,并在随后的研究中得到拓展和总结[2-3]。现有的离子液体研究领域主要分为两大类。第一类是利用离子液体自身的机能,应用于各个不同领域; 另一类是将离子液体和其他液体混合,达到应用目的,比如将一种离子液体与其他离子液体、有机溶剂或者水混合后用于预处理的研究。由于混合溶剂有助于控制溶剂的特性[4],所以在糖化学[5-6]、酶降解[7-9]等领域已经得到应用。
溶剂液化是一种有效的化学处理方法,使生物质原材料通过分解、再合成、固化等方法制备具有更高附加值的聚合物材料[10-11]。然而,由于液化过程中反应效率低下[12],原料和溶剂的添加比例变化所引起的缩合反应造成的生物质材料性能不佳等问题尚未克服[13-15],通过液化制备的生物质材料的方法并没有得到广泛应用。Kobayashi等[16]通过使用臭氧处理方式对木材进行预处理,发现臭氧处理能在一定程度上对纤维素结构进行有效分解,使纤维素更易于液化,但由于臭氧处理方式会带来新的污染问题,因此有必要研究全新的方法来提高液化反应的效率。
离子液体的魅力并不在于其是否是绿色,或者有无毒性,而是在于了解其不同的功能和潜力使其在不同领域开拓新的应用平台[17]。因此本文作者考虑把离子液体应用于溶剂液化研究中。同样为了规模化的使用,通过在离子液体中添加水制备的混合溶剂体系来对纤维素进行预处理,并且使用固体酸催化剂来提高处理效果。从机理来看,离子液体中的阴离子(例如Cl-)作为纤维素的氢键接受体,与纤维素的羟基形成交互作用[18],并且打破氢键结构,从而使其溶解[19],使用含水溶剂体系也能够破坏纤维素结晶结构[20],并且保留葡萄糖单元的功能,使其在随后的液化反应中同样有效的生成多种类化合物[21]。基于混合溶剂体系的这一特点,本文作者通过选用咪唑型离子液体[BMIM]Cl 和水的混合溶剂对微晶纤维素预处理后的结晶结构等物理化学性质进行分析,并考察了预处理后的微晶纤维素在溶剂液化过程中对液化效果和对生成物的影响。
1 实 验
1.1 材 料
微晶纤维素粉末购于Sigma-Aldrich公司。微晶纤维素使用前,在105 ℃干燥器中干燥24 h。固体酸催化剂 Nafion®NR50(NR50)购于Sigma-Aldrich Japan K.K. Co. Ltd., Japan。离子液体氯化1-丁基-3-甲基咪唑,([BMIM]Cl)购于BASF公司,纯度 ≥95%。其他试剂购于 Wako Pure Chemical Industries, Co. Ltd., Japan。
1.2 实验设计
1.2.1 微晶纤维素在混合溶剂中的预处理 微晶纤维素、固体酸催化剂、水和离子液体的质量比例为1 ∶1 ∶10 ∶(1~10),微晶纤维素、水和离子液体的质量比例为1 ∶10 ∶(1~10),微晶纤维素和离子液体质量分数为1 ∶10,将这3种反应物加入烧瓶中,在100 ℃油浴加热条件下磁力搅拌处理一定时间,预处理结束后用去离子水和甲醇分别多次冲洗微晶纤维素以去除残留的离子液体,并在干燥处理后进行表征分析和溶剂液化实验。
1.2.2 纤维素的溶剂液化 把处理后的微晶纤维素加入接有冷凝管的烧瓶中,在150 ℃油浴加热条件下磁力搅拌进行苯酚溶剂液化反应,为了避免缩合反应的发生,微晶纤维素与苯酚的质量添加比例为 1 ∶4[15]。95%的硫酸作为催化剂,使用量为苯酚质量的20%。反应结束后烧瓶投入冰水中冷却以迅速终止反应。将烧瓶内的反应物用甲醇稀释过滤并干燥,进行表征分析。
1.3 表征分析
1.3.1 聚合度(DP)的测定 将微晶纤维素溶解于铜氨溶液中,用乌氏黏度计(model No.1,Sansyo Co. Ltd., Japan) 对微晶纤维素及预处理后的样品的聚合度进行测定并计算。
1.3.2 凝胶渗透色谱(GPC) 对分子质量分布的测定 将微晶纤维素制作成硝酸纤维素以便能溶解于四氢呋喃溶液中,溶解比率为1 ∶1 000(g ∶mL),凝胶渗透色谱装置配备有KD-806L色谱柱(Shodex, Showa Denko K.K. Co. Ltd., Japan),用不同相对分子质量的聚苯乙烯(Mw=1 260 000、 710 000、 355 000、 43 900、 9 500、 2 800、 945、 550) 做出标准曲线,用于测量硝酸纤维素的平均相对分子质量。用配备有连接KD-806L和KD-802色谱柱(Shodex, Showa Denko K.K. Co. Ltd., Japan),并用不同相对分子质量的聚苯乙烯(Mw=21 800、 13 000、 10 400、 6 940、 4 910、 2 940、 2 170、 1 280、 770、 580) 做出标准曲线,用于测量液化物的平均相对分子量。
1.3.3 傅里叶变换红外光谱仪(FT-IR) 对官能团的测定 经过混合溶剂处理后的微晶纤维素,使用Model IR- 6100型红外光谱仪(Jasco Co. Ltd., Japan) 分析,采用压片法,样品和氯化钾的比率为1 ∶100,红外光谱测定范围为4 000~400 cm-1。
1.3.4 差热-热重分析(TG-DTA) 热分析使用Model DTG- 60热分析仪(Shimadzu Co. Ltd., Japan)进行分析,在Ar保护氛围中,大约20 mg预处理后的样品在10 ℃/min的升温条件进行加热,直到温度达到600 ℃。
1.3.5 X射线衍射测定(XRD) 结晶结构 微晶纤维素结晶结构分析采用Ultima III X-ray diffractometer测定仪(Rigaku Co. Ltd., Japan)测定。电压40 kV,电流40 mA,以2°/min的速度在10~40°(2θ) 的角度之间进行测定。结晶度的计算通过高度法即主峰和非结晶区的高度计算而得。
1.3.6 电子显微镜(SEM)对表面结构的观察 预处理后的纤维素表面结构采用Model S-2400电子显微镜(Hitachi Co. Ltd., Japan) 进行观测,加速电压为15 kV。
2 结果与分析
2.1 预处理后微晶纤维素特征
2.1.1 固体酸催化剂的影响 在100 ℃反应1 h条件下,微晶纤维素、水和离子液体的质量比例为1 ∶10 ∶(1~10)条件下预处理得到的样品的聚合度结果用△[B]Cl表示; 微晶纤维素、固体酸催化剂、水和离子液体的质量比例为1 ∶1 ∶10 ∶(1~10)条件下预处理得到的样品的聚合度结果用○[B]Cl+NR50表示。样品代码[B]Cl(10)表示预处理过程中微晶纤维素与离子液体的质量比例为1 ∶10,样品代码[B]Cl(4)表示预处理过程中微晶纤维素与离子液体的质量比例为1 ∶4,以此类推,样品代码[B]Cl(10)+NR50表示预处理过程中微晶纤维素、固体酸催化剂和离子液体的质量比例为1 ∶1 ∶10。在两组系列样品中根据离子液体的不同的添加量,得到微晶纤维素的聚合度变化的结果见图1。微晶纤维素的聚合度随着离子液体的添加量增多而降低,当添加固体酸催化剂的时候(见图1中的○[B]Cl+NR50)能更有效的降低聚合度。然而在所有样品中,溶解于离子液体和水混合溶剂中,最大的溶解质量分数在3%以内。由此可见,在混合溶剂中,即使溶解质量分数没有增加,预处理后微晶纤维素的聚合度也同样在降低。在不添加水的实验条件下,离子液体能够在温度较高时利用阴离子与纤维素分子链之间的羟基中氢离子形成电子供予体和电子受予体的结构,从而打破纤维素分子链之间的氢键,促使其溶解[22]。然而水的添加能使得一个水分子与两个离子液体的阴离子形成新的氢键从而阻碍了溶解效果[23]。在有无添加固体酸的条件下,增加离子液体在体系中的浓度都能够促进阴离子效果,达到降低聚合度的目的。

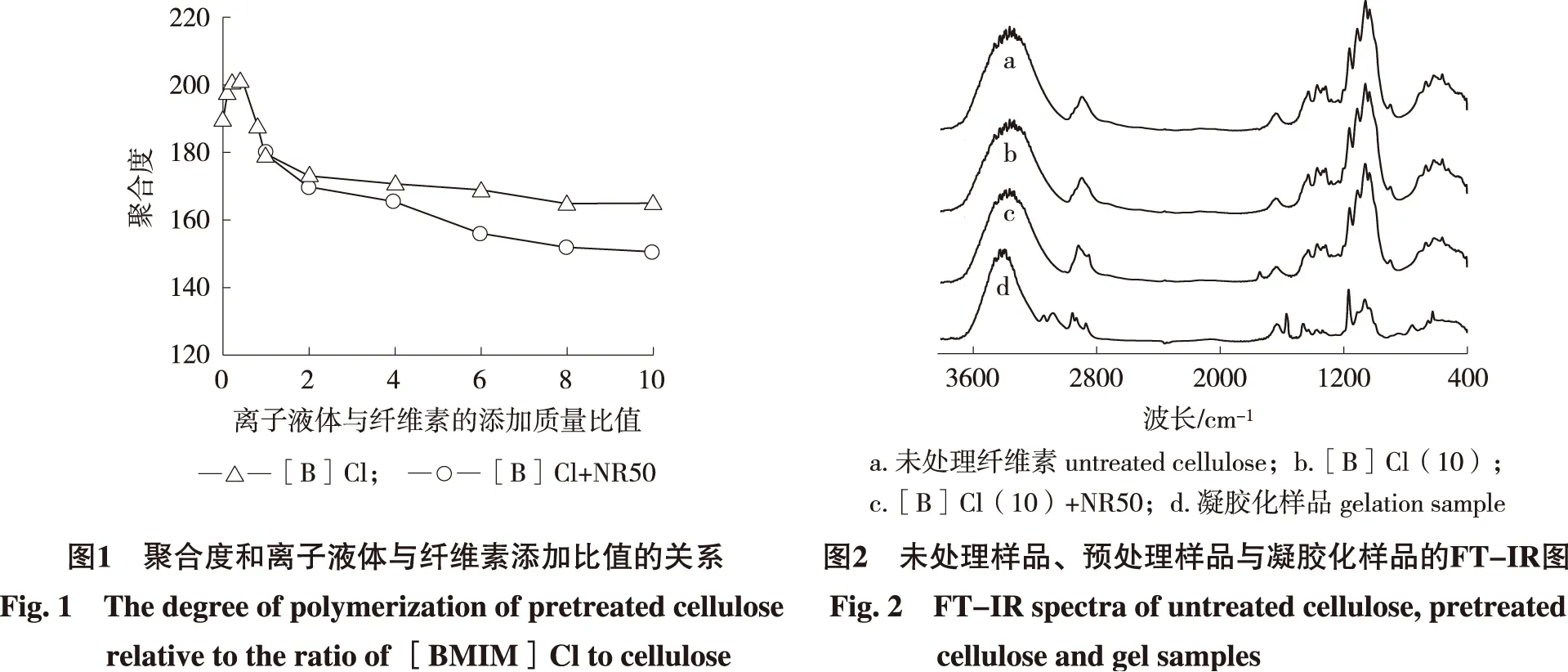
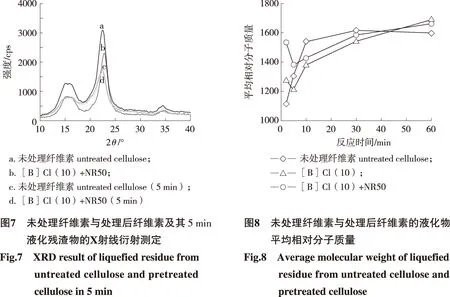
2.1.2 结晶结构变化分析 微晶纤维素结晶结构中氢键的破坏不一定影响聚合度的降低,但是聚合度的降低会导致氢键的破坏和微晶纤维素的结晶结构被打乱。通过XRD的分析,在图3中微晶纤维素主峰002随着离子液体浓度的增加而降低,可以认为是微晶纤维素部分结晶结构在溶剂体系中被破坏。在添加固体酸催化剂处理后,主峰002角度(2θ)从未处理纤维素的22.50°(d002=0.403 nm) 转变到22.66°(d002=0.400 nm),可以认为是结晶结构发生了歪曲并形成了低有序性的结构[28],从而推断溶剂对微晶纤维素分子链之间的氢键造成破坏,使分子链之间作用力发生变化,导致结晶结构有歪曲现象的发生。
2.1.3 差热-热重分析 对预处理后的微晶纤维素进行热重分析发现,预处理后的纤维素热分解温度都升高,见图4,说明处理后的纤维素的热稳定性升高。同样这个结果可以认为是未处理的纤维素具有相对低的伸缩性以及相对较好的结晶结构[29]。此外,在热分解反应后,经过预处理的纤维素比未处理的纤维素具有更多的焦炭,可以认为是处理后的纤维素具有相对更大的晶粒[29],而较小的晶粒或无定形纤维素的部分可能已经被溶解或破坏。另一方面,添加固体酸催化剂的纤维素与未添加的纤维素的热重分析结果显示,两者的差别主要在于结晶性部分的完整性和有序性,而不是晶粒的大小。图3的衍射图也可以得到这一点结果,即添加固体酸后主峰的强度下降,显示了高结晶度部分的结晶构造被破坏。
2.1.4 表面结构变化分析 微晶纤维素经过混合溶剂并且添加固体酸处理后的表面结构变化见图5。由于水的添加,纤维素并没有完全溶解。然而表面结构出现一些明显的裂缝(图5(b),黑色箭头),这样的表面结构会使结晶度降低并且有利于随后的应用[30]。其他样品并没有明显的证据显示出这种变化。此外,根据以上结果可见,混合溶剂体系对纤维素的影响主要在整体聚合度的降低,以及分子链之间氢键结构的破坏。固体酸催化剂的作用在于促进聚合度的降低,在分子链之间都有明显的破坏结果,使分子链之间作用力变小,导致结晶结构的有序性在一定程度上歪曲。结合这些结果, 3种不同预处理条件下处理后的样品在随后的溶剂液化实验中使用,表1列出了一些参数作为对液化结果可能产生的一些因素做参考。结晶度的计算由于高度法的局限性,并无法准确反应结晶结构的变化,但可以获知非结晶物质以及低结晶物质的变化[31],即样品[B]Cl(10)+NR50的非结晶物质的减少要明显大于其他样品,同时通过对硝酸纤维素的观察发现,平均分子质量也在降低,可以认为,高分子质量部分的物质可能有一定分解,但未溶解于离子液体与水的混合溶剂中,聚合度的结果同样反映了这一点。


图5 未处理纤维素(a)与处理后纤维素(b)的表面结构

表1 用于溶剂液化实验的样品与其溶剂处理时的条件
1) 相对分子质量为硝酸纤维素的分子质量Mwis the molecular weight of nitrocellulose
2.2 溶剂液化效果
2.2.1 液化残渣物分析 常用的液化条件在一些研究中已经被讨论[13-16,32-34],作者参考并用于处理后的纤维素在液化实验中。图6(a)中显示混合溶剂处理后的纤维素除了[B]Cl(4)样品外,都有显著的加速液化效果,样品[B]Cl(10)+NR50在液化2 min时的残渣率为19%左右,在同样条件和时间点未处理纤维素的残渣率为29%左右。从结果来看,即同样反应时间点上样品[B]Cl(10)+NR5溶剂液化后的残渣率更少,在相同的残渣量时样品[B]Cl(10)+NR50溶剂液化所用的反应时间更短,同样发现在反应最初阶段,这一现象更为明显。在图6(b)中,残渣物的聚合度结果显示,在反应的最初阶段,聚合度急剧下降也是反映残渣率下降的重要表征。通过混合离子液体[BMIM]Cl和水并且添加固体酸催化剂形成新的混合溶剂体系对微晶纤维素进行预处理,结果发现溶剂在保留纤维素主要葡萄糖单元的同时能够有效地降低聚合度。聚合度从未处理时的190降到样品[B]Cl(10)的165和样品[B]Cl(10)+NR50的151。从结果还可以看出,聚合度的变化同样在最初阶段最为明显,而在之后的反应中变化不大。根据液化反应机理来看纤维素是由于脱水反应的作用,苯酚在葡萄糖单元的糖苷键处发生亲和取代反应结合,然后中间体葡萄糖单元在C-1-O-C-5处发生开环反应,并且在开环反应后在此碳素分子链的C-2或C-4、C-5处易出现断裂,从而生成双酚A及对羟基苯甲酸等化合物[21,35]。预处理主要对纤维素分子链的氢键结构起到破坏作用,所以之后的液化反应机理并没有受到预处理的影响。换而言之,预处理的结果直接影响的是液化的反应速率而不是产物。

a.残渣率liquefied residues content;b.残渣聚合度degree of polymerization of residue
从图7的X衍射线的结果可知,预处理后的微晶纤维素在结晶结构上有较大的变化,然而通过分析预处理前后两样品液化反应5 min的残渣的结果可见,二者的结晶结构区别不大,可见这部分具有结晶结构且相对难分解的部分并没有受到预处理的溶剂或溶胀效果的影响。所以预处理的效果可能在降低聚合度(包括降低平均相对分子质量)、破坏部分纤维素颗粒的(样品粒径<20 μm)外层结晶结构部分或者表面结构的变化,这些因素影响了反应速率的快慢。
2.2.2 液化物相对分子质量分析 根据液化反应机理推测,预处理在对最终产物结构上的影响,并没有对反应在最初阶段的变化大。图8是未处理纤维素和处理后纤维素的苯酚液化生成物的平均相对分子量。此外根据反应条件不同,液化产物会含有20种以上不同化合物[21],所以相对分子质量分布适合用来描述液化物的情况。通过比较结果,在反应最初阶段生成物的重均相对分子质量的值差别较大,反应最初阶段纤维素被液化的部分不同是导致这个结果的原因。从图8中还可以看出,反应往后阶段生成物的重均相对分子质量的变化不大, 显示预处理对最终液化生成物的性质影响不大。
3 结 论
3.1 通过混合离子液体[BMIM]Cl和水并且添加固体酸催化剂形成新的混合溶剂体系对微晶纤维素进行预处理,结果发现溶剂在保留纤维素主要葡萄糖单元的同时能够有效地降低聚合度。聚合度从未处理时的190降到样品[B]Cl(10)的165和样品[B]Cl(10)+NR50的151。
3.2 混合溶剂对纤维素分子链的氢键具有一定的破坏作用,处理后的纤维素的结晶结构发生了歪曲并形成相对低有序性的结构。
3.3 混合溶剂处理后纤维素表面结构变化显示在样品中出现一些明显的裂缝,且整体平均分子质量也有降低,可以认为,高分子部分的纤维素有一定降解,但未溶解于混合溶剂体系。处理后的纤维素具有相对更大的晶粒,所以在热解反应后有更多的焦炭产生。
3.4 在随后的液化过程中,处理后的纤维素液化效率有所提高,在反应2 min时,固体酸加混合溶剂处理的微晶纤维素液化残渣率为19%,而未处理的液化残渣率29%,可以归因于微晶纤维素的平均分子质量的降低,结晶结构破坏等影响。液化速率的加快有利于反应效率的提高以及资源的拓展利用。以上结果为离子液体混合溶剂的应用和生物质溶剂液化起到了新的桥梁作用。
致谢:感谢关口和彦助教授对本研究提出宝贵的意见和帮助。
参考文献:
[1]SWATLOSKI R P,SPEAR S K,HOLBERY J D,et al.Dissolution of cellulose with ionic liquids[J].Journal of the American Chemical Society,2002(124):4974-4975.
[2]MALGORZATA E Z,EWA B L,RAFAL B L.Solubility of carbohydrates in ionic liquids[J].Energy & Fuels,2010(24):737-745.
[3]张金明,张军.基于纤维素的先进功能材料[J].高分子学报,2010(12):1376-1398.
[4]KOHNO Y,OHNO H.Ionic liquid/water mixtures:From hostility to conciliation[J].Chemical Communications,2012,48(57):7119-7130.
[5]DADI A P,VARANASI S,SCHALL C A.Enhancement of cellulose saccharification kinetics using an ionic liquid pretreatment step[J].Biotechnology and Bioengineering,2006,95(5):904-910.
[6]LI Q,JIANG X,HE Y,et al.Evaluation of the biocompatibile ionic liquid 1-methyl-3-methylimidazolium dimethylphosphite pretreatment of corn cob for improved saccharification[J].Applied Microbiology and Biotechnology,2010,87(1):117-126.
[7]LEE S H,VOHERTY T V,LINHARDT R J,et al.Ionic liquid-mediated selective extraction of lignin from wood leading to enhanced enzymatic cellulose hydrolysis[J].Biotechnology and Bioengineering,2009,102(5):1368-1376.
[8]HA S H,MAI N L,AN G,et al.Microwave-assisted pretreatment of cellulose in ionic liquid for accelerated enzymatic hydrolysis[J].Bioresource Technology,2011,102(2):1214-1219.
[9]SHILL K,PADAMANABHAN S,XIN Q,et al.Ionic liquid pretreatment of cellulosic biomass:Enzymatic hydrolysis and ionic liquid recycle[J].Biotechnology and Bioengineering,2011,108(3):511-520.
[10]KURIMOTO Y,TAKEDA M,DOI S,et al.Network structures and thermal properties of polyurethane films prepared from liquefied wood[J].Bioresource Technology,2001,77(1):33-40.
[11]LEE W J,CHEN Y C.Novolak PF resins prepared from phenol liquefied cryptomeria japonica and used in manufacturing moldings[J].Bioresource Technology,2008,99(15):7247-7254.
[12]YIP J,CHEN M,SZETO Y S,et al.Comparative study of liquefaction process and liquefied products from bamboo using different organic solvents[J].Bioresource Technology,2009,100(12):6674-6678.
[13]NIU M,ZHAO G J,ALMA M H.Polycondensation reaction and its mechanism during lignocellulosic liquefaction by an acid catalyst[J].Forestry Studies in China,2011,13(1):71-79.
[14]PAN H.Synthesis of polymers from organic solvent liquefied biomass:A review[J].Renewable & Sustainable Energy Reviews,2011(15):3454-3463.
[15]ZHANG Y C,IKEDA A,HORI N,et al.Characterization of liquefied product from cellulose with phenol in the presence of sulfuric acid[J].Bioresource Technology,2006,97(2):313-321.
[16]KOBAYASHI M,ASANO T,KAJIYAMA M,et al.Effect of ozone treatment of wood on its liquefaction[J].Journal of Wood Science,2005(51):348-356.
[17]ROGERS R D.Materials science:Reflections on ionic liquids[J].Nature,2007(447):917-918.
[18]ZHANG J,ZHANG H,WU J,et al.NMR spectroscopic studies of cellobiose solvation in EmimAc aimed to understand the dissolution mechanism of cellulose in ionic liquids[J].Physical Chemistry Chemical Physics,2010(28):1941-1947.
[19]BOCHEK A M.Effect of hydrogen bonding on cellulose solubility in aqueous and no naqueous solvents[J].Russian Journal of Applied Chemistry,2003,76(11):1711-1719.
[20]OLIVIER-BOURBIGOU H,MAGNA L,MORVAN D.Ionic liquids and catalysis:Recent progress from knowledge to applications[J].Applied Catalysis(A):General,2010,373(1/2):1-56.
[21]LIN L Z,YAO Y G,YOSHIDKA M,SHIRAISHI N.Liquefaction mechanism of cellulose in the presence of phenol under acid catalysis[J].Carbohydrate Polymers,2004,57(2):123-129.
[22]ZHANG H,WU J,ZHANG J,et al.1-Allyl-3-methylimidazolium chloride room temperature ionic liquid:A new and powerful nonderivatizing solvent for cellulose[J].Macromolecules,2005,38:8272-8277.
[24]IVANOVA N V,KOROLENKO E A,KOROLIK EV,et al.Spectrum of cellulose[J].Journal of Applied Spectroscopy,1989,51(2):847-851.
[25]JANDURA P,KOKTA B V,RIEDL B.Fibrous long-chain organic acid cellulose esters and their characterization by diffuse reflectance FTIR spectroscopy,solid-state CP/MAS13C-NMR,and X-Ray diffraction[J].Journal of Applied Polymer Science,2000,78(7):1354-1365.
[26]DWIATMOKO A A,CHOI J W,SUH D J,et al.Understanding the role of halogen-containing ionic liquids in the hydrolysis of cellobiose catalyzed by acid resins[J].Applied Catalysis(A):General,2010,387(1/2):209-214.
[27]ZHANG Y T,DU H B,QIAN X H,et al.Ionic liquid-water mitures:Enhanced Kw for efficient cellulosic biomass conversion[J].Energy & Fuels,2010,24(4):2410-2417.
[28]CHENG G,VARANASI P,ARORA R,et al.Imaging and measuring single-molecule interaction between a carbohydrate-binding module and natural plant cell wall cellulose[J].Journal of Physical Chemistry(B),2012,116(33):10049-10054.
[29]DAS K,RAY D,BANDYOPADHYAY N R,et al.Study of the properties of microcrystalline cellulose particles from different renewable resources by XRD,FTIR,nanoindentation,TGA and SEM[J].Journal of Polymers and the Environment,2010,18(3):355-363.
[30]TAN H T,LEE K T,MOHAMED A R.Pretreatment of lignocellulosic palm biomass using a solvent-ionic liquid[BMIM]Cl for glucose recovery:An optimisation study using response surface methodology[J].Carbohydrate Polymers,2010,83(4):1862-1868.
[31]PARK S,BAKER J O,HIMMEL M E,et al.Cellulose crystallinity index:Measurement techniques and their impact on interpreting cellulase performance[J].Biotechnology for Biofuels,2010(3):10.
[32]赵广杰,张求慧.木质生物质的液化及其产物的高效利用研究进展[J].生物质化学工程,2008,42(6):29-36.
[33]张求慧,赵广杰.我国生物质废料液化及产物利用的研究进展[J].林产化学与工业,2009,29(1):120-126.
[34]叶结旺,于红卫,槐敏,等.油茶饼粕的苯酚液化及产物的结构表征[J].林产化学与工业,2012,32(2):37-42.
[35]MUN S P,JANG J P,Liquefaction of cellulose in the presence of phenol usingp-toluene sulfonic acid as a catalyst[J].Journal of Industrial and Engineering Chemistry,2009,15(5):743-747.

