花生粕的枯草芽孢杆菌BS H001发酵及产物性质*
刘冬梅 陈浩 胡小慧 吴晖 李理
(华南理工大学 轻工与食品学院,广东 广州 510640)
花生粕(PNM)是花生仁经压榨提炼油料后所得的副产品,其粗蛋白质含量为38.0%~47.0%,粗纤维含量为4.0%~7.0%,粗脂肪含量为0.5%~2.0%,钙含量为0.2%~0.3%,磷(以植酸磷形式存在)含量为0.4%~0.7%[1].我国花生粕的年产量约为1000 万吨,居世界第一位,约占世界总产量的38%[2].但以下3 个主要缺陷限制了花生粕在饲料和食品行业的应用:(1)花生粕中的氨基酸不平衡,特别是缺乏一些必需氨基酸(如赖氨酸、蛋氨酸、苏氨酸);(2)花生粕易感染黄曲霉从而产生黄曲霉毒素,将其作为牲畜饲料时易使牲畜肝脏受到损害;(3)花生蛋白质中存在过敏原.花生粕中氨基酸的缺陷可通过添加氨基酸或其他蛋白质来弥补,黄曲霉毒素的危害可通过将花生粕用量控制在10%以下或利用碱或微生物发酵降解的方法来减轻[3],花生蛋白质中的过敏原可采用枯草芽孢杆菌来降解.枯草芽孢杆菌被用于许多大豆发酵食品的发酵,如泰国的Thua-Nao、日本的纳豆和中国的豆豉等[4-6],这些发酵食品都利用枯草芽孢杆菌分泌的蛋白酶使大分子蛋白质水解成小分子蛋白质,因此其蛋白质有较好的生物效价[7];同时,枯草芽孢杆菌的发酵作用使食品中蛋白质类过敏原的结构发生变化,在降低过敏反应的同时,增加了食品中游离氨基酸和多肽的含量[8-10].目前,在利用枯草芽孢杆菌发酵豆粕生产易消化的蛋白质饲料方面已有较多研究[11-13],但利用其进行花生粕发酵的研究则很少,尚未实现发酵花生粕(FPNM)的规模化生产,更没有涉及到PNM 发酵前后的氨基酸种类及含量变化.
笔者前期研究发现,枯草芽孢杆菌BS H001(Bacillus subtilis BS H001)能对PNM 进行发酵,还能降解其中的黄曲霉毒素[14].为改善PNM 中的氨基酸平衡,减少花生蛋白质中的过敏原,文中对BS H001 发酵PNM 的条件、FPNM 中蛋白质的部分性质和发酵前后的氨基酸变化进行了研究.
1 材料及方法
1.1 实验材料
枯草芽孢杆菌BS H001 由华南理工大学轻工与食品学院分离并保存;斜面培养基组成如下:牛肉膏3 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂2 g/L,pH=7.0;种子培养基除不加琼脂外,其余组成与斜面培养基相同.
盐酸、硫酸铜、乙醇均为分析纯,广州化学试剂厂生产;氢氧化钠、硫酸钾、乙醚、硼酸均为分析纯,天津市福晨化学试剂厂生产;碳酸钠、浓硫酸、甲醇、冰醋酸均为分析纯,天津市科密化学试剂有限公司生产;丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、三羟甲基氨基甲烷、四甲基乙二胺、β-巯基乙醇、甘氨酸、考马斯亮蓝R-250、标准蛋白(分子质量为24~97 ku)均为分析纯,北京鼎国生物技术有限责任公司生产.
1.2 主要仪器
KDC-40 型低速离心机,科大创新股份有限公司中佳分公司生产;5804R 型台式高速冷冻离心机,Eppendorf AG 22331,德国艾本得中国有限公司生产;DYY-6C 型电泳仪及电泳槽,北京市六一仪器厂生产;J-2 型菌落计数器,宁波科学仪器厂生产;ALPHA1-2型真空冷冻干燥机,德国Christ 有限公司生产;PQX 型多段可控人工气候箱,宁波东南仪器有限公司生产;自动凯氏定氮仪,瑞士Büchi 公司生产;医学低温冰箱,青岛海尔集团生产.
1.3 实验方法
1.3.1 BS H001 菌种的活化及种子液的制备
(1)BS H001 菌种的活化
根据配方配制种子培养基,于121 ℃、0.1 MPa下灭菌20 min 后冷却,接入BS H001,于30 ℃下培养24 h 后,为母种子液.
(2)BS H001 种子液的制备
根据配方配制种子培养基,于121 ℃、0.1 MPa下灭菌20 min 后冷却,接入母种子液,在30 ℃、200 r/min下培养24 h 后,BS H001 细胞浓度达1.0 ×109~3.0 ×109CFU/mL,为种子液.
1.3.2 PNM 的发酵
在50 g PNM 中加入适量的水和硫酸铵,搅拌均匀后,装入150 mL 的锥形瓶中,封口,在0.1 MPa 下灭菌一定时间后冷却至30 ℃,按2%~10%的质量分数接种BS H001 种子液,搅拌均匀后,于30 ℃下发酵一定时间,在发酵期间定期搅拌,发酵结束后的PNM 进行真空冷冻干燥.
1.3.3 蛋白质含量分析
利用凯氏定氮法来测定PNM 的蛋白质含量.取烘干至恒重的PNM 或FPNM 5 g 与硫酸、硫酸铜、硫酸钾加热消化,使蛋白质分解,分解后的氨与硫酸结合生成硫酸铵,然后碱化蒸馏使氨游离,再用硼酸吸收,以盐酸标准溶液滴定,将酸消耗量乘以换算系数,即得蛋白质含量.做3 个平行实验,取平均值,即得蛋白质含量(质量分数,下同).
1.3.4 硫酸铵氮含量测定
取烘至恒重的PNM 或FPNM 5 g 溶于双蒸水并定容至100mL,溶液在8000r/min 下离心20min 后,取上清液10 mL,加碱蒸馏使氨游离,再用硼酸吸收,以盐酸标准溶液滴定,将酸消耗量乘以换算系数,即得剩余的硫酸铵氮含量.做3 个平行实验,取平均值.将所得的蛋白质含量减去剩余的硫酸铵氮含量,即得剔除硫酸铵中氮的蛋白质含量.
1.3.5 BS H001 发酵PNM 的单因素实验
(1)含水量的影响实验
PNM 分别在33%、50%、60%、67%、71%的含水量下进行实验.其他发酵条件如下:发酵时间48 h、搅拌间隔8 h、灭菌时间20 min、硫酸铵含量2.0%.
(2)发酵时间的影响实验
分别在24、36、48、60、72 h 的发酵时间下进行实验.其他发酵条件如下:含水量50%、搅拌间隔8 h、灭菌时间20 min、硫酸铵含量2.0%.
(3)搅拌间隔的影响实验
分别在0(不搅拌)、4、8、12、16 h 的搅拌间隔下进行实验.其他发酵条件如下:含水量50%、发酵时间48 h、灭菌时间20 min、硫酸铵含量2.0%.
(4)灭菌时间的影响实验
分别在0、10、20、30、40 min 的灭菌时间下进行实验.其他发酵条件如下:含水量50%、发酵时间48 h、搅拌间隔8 h、硫酸铵含量2.0%.
(5)硫酸铵含量的影响实验
分别在0.0%、1.0%、2.0%、3.0%、4.0%(质量分数,余同)的硫酸铵含量下进行实验.其他发酵条件如下:含水量50%、发酵时间48 h、搅拌间隔8 h、灭菌时间20 min.
1.3.6 BS H001 发酵PNM 的多因素实验
即使采用最优的单因素条件,各因素之间的交互作用也会影响BS H001 的发酵,因此需考虑多因素的交互作用对PNM 发酵的影响.文中进行了5 因素4 水平正交试验,5 因素分别为PNM 的含水量(因素A,分别取44%、47%、50%、52%)、PNM 发酵时间(因素B,分别取40、44、48、52 h)、搅拌间隔(因素C,分别取4、6、8、10 h),灭菌时间(因素D,分别取30、35、40、45 min)、硫酸铵含量(因素E,分别取3.0%、4.0%、5.0%、6.0%).根据正交实验设计软件,设计了共16 组实验,分别按照1.3.3 和1.3.4节的方法测定每组的蛋白质含量和硫酸铵氮含量,每组做3 个平行实验,取平均值.
1.3.7 蛋白质分子质量分布的SDS-PAGE 分析
(1)蛋白质的提取[15]
分别将发酵前后的PNM 粉碎,用乙醚(花生粉与乙醚质量比为1∶6)脱脂3 次,除去脱出的脂肪并在通风橱内风干乙醚,脱脂PNM 粉用10 倍体积的蒸馏水分散搅拌完全,再用NaOH 调至pH 9.5,室温下搅拌2 h 后离心30 min.离心所得上清液用HCl调至pH 4.6,于4℃下放置2h 后,离心.所得沉淀用蒸馏水洗3 次后重新分散于蒸馏水中,调至中性,该分散液经透析后冷冻干燥,即得花生分离蛋白.
(2)样品处理
在不连续缓冲系统上处理蛋白质标准品.分离胶和浓缩胶质量分数分别为7.2%和2.4%.蛋白质样品与1.00mL 样品缓冲液于离心管中混匀,在100℃水浴中加热5 min,取出冷却后于每个样品槽中注入16.00 μL 样品液.
(3)电泳条件
电泳实验采取恒流方式.电流先取10 mA,待进入分离胶后改为25 mA;电泳2.5 h 后,进行剥胶、染色、脱色、拍照保存.
1.3.8 蛋白质中氨基酸种类及含量的HPLC 分析
按1.3.7 节所述方法提取PNM 和FPNM 中的蛋白质溶于6mol/L HCl 溶液,于110℃水解24h,再用高效液相色谱(HPLC)进行分析检测.分析柱为PICO.TAG 氨基酸;检测条件为:温度38 ℃、波长254 nm、流速1.00 mL/min、进样量10 μL.
2 实验结果及分析
2.1 PNM 发酵条件的优化
2.1.1 PNM 含水量的影响
PNM 含水量分别为33%、50%、60%、67%、71%时的发酵结果如图1 所示.随着含水量的增加,FPNM 中的蛋白质含量逐渐增大;含水量为33%时,蛋白质含量达47.56%;含水量为50%时,蛋白质含量达最大值,为53.68%;然后逐渐下降,含水量为71% 时蛋白质含量降至51.30%.与未发酵PNM 的蛋白质含量(45.51%)相比,含水量为50%时发酵PNM 的蛋白质含量呈显著性增大(P ≤0.001),这可能是因为合适的含水量令PNM 充分溶胀,使BS H001 能利用充分溶胀的蛋白质进行发酵并产生菌体,从而增加了总蛋白质的含量.但是,PNM 含水量过高或过低都不利于菌体的生长繁殖,含量水过高会使PNM 结块成团,通气状况差,不利于菌体的生长繁殖;含水量过低则菌体无法利用未充分溶胀的蛋白质.文中采用凯氏定氮法测定PNM发酵前后的蛋白质含量,此法测定的是总氮含量,经过发酵后的PNM 蛋白质含量都比未发酵的高,充分说明发酵后PNM 中蛋白质的增加是由于菌体大量积累而致.因此,在利用枯草芽孢杆菌BS H001发酵PNM 时,控制含水量非常重要.
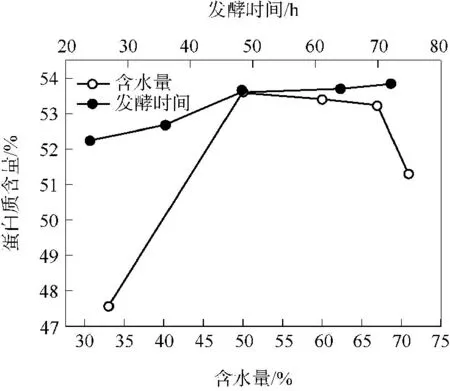
图1 含水量和发酵时间对FPNM 中蛋白质含量的影响Fig.1 Effects of water content and fermentation time on the protein content of FPNM
2.1.2 发酵时间的影响
发酵时间分别为24、36、48、60、72 h 时的发酵结果如图1 所示.随着发酵时间的延长,FPNM 中的蛋白质含量增大,到48~72 h 时趋于稳定;发酵时间为24、48 h 时,蛋白质含量分别达到52.25%、53.61%,与未发酵PNM 的蛋白质含量(45.51%)相比,发酵时间为48 h 时FPNM 的蛋白质含量呈显著性增大(P≤0.001).发酵48 h 后,蛋白质含量增加不明显,这可能与菌株生长期有关.从效果和经济的角度考虑,发酵时间选择48 h 为宜.将枯草芽孢杆菌接种于豆粕中优化产蛋白酶的酶活,当发酵72 h 时蛋白酶的活力最高[16],这是因为蛋白酶分泌要迟于细胞数量的增殖.
2.1.3 搅拌间隔的影响
搅拌间隔分别为0、4、8、12、16 h 时的发酵结果见图2.随搅拌间隔的延长,FPNM 中的蛋白质含量先增大,随后逐渐降低;发酵过程中不搅拌时,蛋白质含量仅为50.12%;搅拌间隔为8 h 时,蛋白质含量增至53.00%;搅拌间隔为16 h 时,蛋白质含量下降至50.24%.与不搅拌时的FPNM 蛋白质含量(50.12%相)比,搅拌间隔为8 h 时FPNM 中的蛋白质含量呈显著性增大(P≤0.001).每4 h 搅拌一次时,虽然可增加含氧量,但因搅拌过于频繁,过度的剪切力可能会影响菌体生长,因此蛋白质含量比每8、12 h 搅拌一次时低,比不搅拌、每16 h 搅拌一次时高.BS H001 是需氧菌,PNM 中的氧气含量对其生长繁殖至关重要,搅拌既可以给菌体通氧,也可以降低菌体的发酵温度,在半固体发酵过程中,菌体生长繁殖会产热[17],因此,保持菌体在合适的生长范围非常重要.
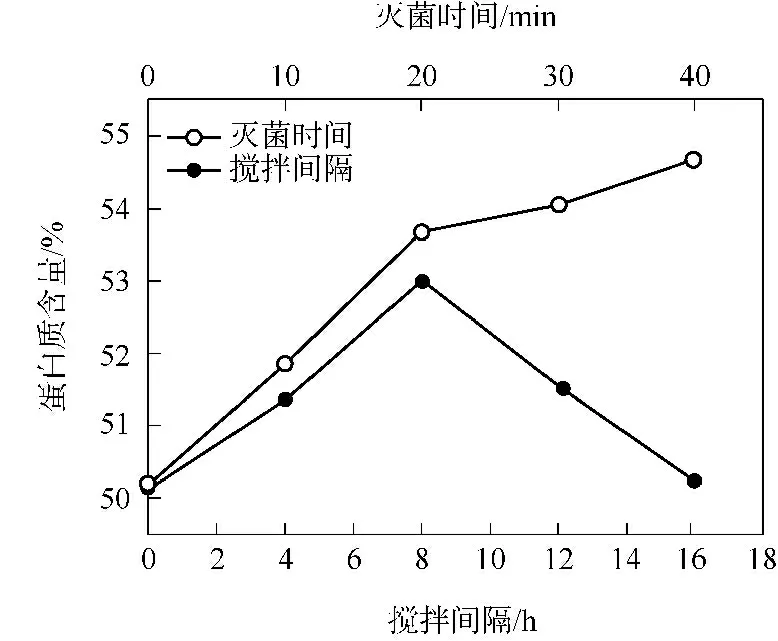
图2 搅拌间隔和灭菌时间对FPNM 中蛋白质含量的影响Fig.2 Effects of stirring interval and sterilization time on the protein content of FPNM
2.1.4 灭菌时间的影响
灭菌时间分别为0、10、20、30、40 min 时的发酵结果见图2.随灭菌时间的延长,FPNM 中的蛋白质含量逐渐增大;不灭菌时FPNM 的蛋白质含量仅为50.18%;灭菌20 min 时,FPNM 的蛋白质含量增加至53.67%;灭菌时间为40 min 时,蛋白质含量相应地增加至54.66%.与不灭菌时相比,灭菌40 min 时的蛋白质含量呈显著性增大(P≤0.001),但灭菌时间为20、30 min 时蛋白质含量增大的显著性不如40 min时(P≤0.005),因此灭菌时间选择40 min 为宜.这可能是因为,灭菌时间越长PNM 蛋白质结构越疏松,其中的蛋白质被菌株BS H001 利用得越充分,细胞增殖越多,表现为FPNM 中蛋白质含量的增加.上述结果也表明,不灭菌或者灭菌不足的PNM 中会存在杂菌且蛋白质舒展不够,使得蛋白质无法得到充分利用,影响BS H001 的细胞增殖,从而影响蛋白质含量的提高.
2.1.5 硫酸铵含量的影响
硫酸铵含量分别为0.0%、1.0%、2.0%、3.0%、4.0%时FPNM 的蛋白质含量如图3 所示.随硫酸铵含量增加,FPNM 中的蛋白质含量逐渐增大;硫酸铵含量为4.0% 时,FPNM 的蛋白质含量为54.75%(未剔除硫酸铵中氮的蛋白质含量为55.48%),与硫酸铵含量为0.0% 时相比呈显著性增大(P ≤0.001).硫酸铵是一种无机氮源,含量太高可能会导致细胞渗透压不适[18],对细胞生长不利,因此其用量非常关键.当硫酸铵含量较低时,菌体可较好利用,根据以往经验,硫酸铵含量最大为4.0%.尽管如此,发酵后的PNM 中还可能存在未被利用的硫酸铵,为减少其对实验的影响,考虑剔除硫酸铵中的氮含量,结果见图3.可以看出,剔除硫酸铵中的氮含量后蛋白质含量的变化趋势相同,表明1.0%~4.0%的硫酸铵含量能促进BS H001 的生长繁殖.
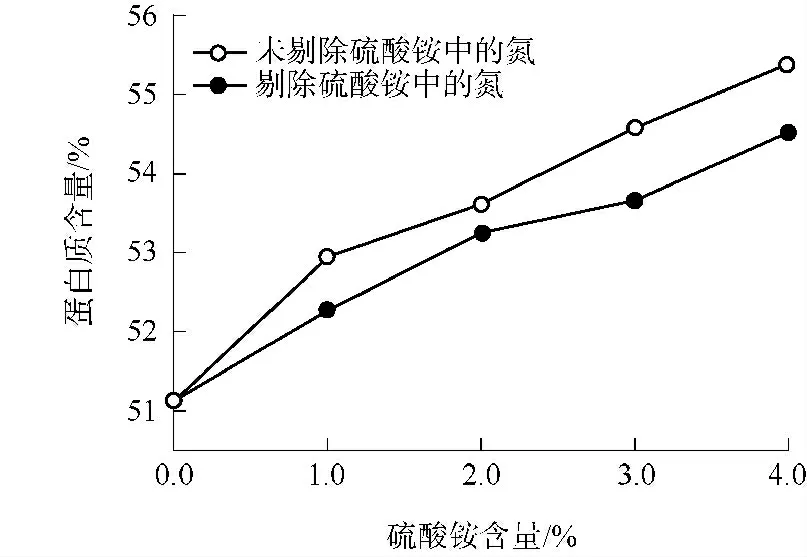
图3 硫酸铵含量对FPNM 中蛋白质含量的影响Fig.3 Effects of ammonium sulfate content on the protein content of FPNM
2.2 多因素交互作用对BS H001 发酵PNM的影响
为了获得更高的蛋白质含量,根据单因素实验结果,设计了5 因素4 水平的正交试验,共16 组试验,结果见表1.从表中可看出,BS H001 发酵PNM的最适合发酵条件为A3-B1-C3-D4-E2(实验组别为9),即含水量50%、发酵40 h、每隔8 h 搅拌1 次、灭菌45 min、硫酸铵含量4.0%,此条件下FPNM 的蛋白质含量高达55.93%(未剔除硫酸铵中氮含量的为56.78%),比PNM 的蛋白质含量(45.51%)提高了10.42 个百分点.其中,5 个因素影响的先后次序依次为含水量(级差RA=1.63)>灭菌时间(级差RD=0.99)>搅拌间隔(级差RC=0.92)>硫酸铵含量(级差RE=0.69)>发酵时间(级差RB=0.65).根据正交试验还得出,含水量52%、发酵44 h、搅拌间隔8 h、灭菌时间45 min、硫酸铵含量4.0% 时,FPNM 的蛋白质含量为56.20%,比PNM 的蛋白质含量提高了23.49%.

表1 发酵PNM 的正交直观分析Table 1 Intuitive analysis of the orthogonal experiment results of fermented peanut meal
2.3 发酵对蛋白质分子质量分布的影响
选取表1 中发酵后蛋白质含量较高的实验组4、6、9、10、11、13、14、15、16 中的FPNM 和PNM 蛋白质进行SDS-PAGE 电泳分析,结果如图4 所示.PNM蛋白质中从上至下分别有3 种蛋白质,分子质量分别约为63、48、41 ku,经过枯草芽孢菌BS H001 发酵后,PNM 中的蛋白质得到了不同程度的降解,其中分子质量约为63、48 ku 的蛋白质被完全降解,实验组4、6、10、11、14 中分子质量为41 ku 的蛋白质未被降解,而实验组9、13、15、16 中蛋白质的降解最彻底,3 种分子质量的蛋白都被完全降解.从花生蛋白质中已经分离到11 种花生过敏原,分别以Ara h1-Ara h11 命名,它们属于2 个主要的花生球蛋白和花生伴球蛋白家族,其中Ara h1 占花生蛋白总量的12%~16%,分子质量约为63.5 ku,是花生中致敏性最强的组分之一,在自然状态下以三聚体形式存在,三聚 体 的 分 子 质 量 约 为150~200 ku[19].BS H001 的发酵作用一方面可以提高发酵后PNM 中的蛋白质含量,另一方面可以降解PNM 中高分子质量的蛋白质,可能有助于PNM 中蛋白质过敏原的去除或减少,从而提高PNM 蛋白质的生物效价,为PNM的深入利用提供可能.在豆粕中接种枯草芽孢杆菌,该菌可以利用其中的蛋白质进行生长繁殖,并产生大量蛋白酶,将豆粕中高分子质量的蛋白质降解成肽、氨基酸等小分子物质[20],其中的抗原蛋白得到降解,蛋白质含量得到提高,氨基酸组成和含量和发生了改变[21].因此,BS H001 用于发酵PNM 有非常好的潜在价值.

图4 PNM 发酵前后蛋白质的SDS-PAGE 电泳图Fig.4 SDS-PAGE photo of PNM before and after fermentation
2.4 发酵对PNM 中氨基酸含量的影响
PNM 发酵前后氨基酸和蛋白质的变化见表2.PNM 中蛋白质占干物质的45.51%,与文献[18]报道的38.00%~47.00%相符合;经过枯草芽孢杆菌BS H001 发酵后,FPNM 中蛋白质含量升至56.20%,总氨基酸含量由36.38% 升高到42.38%,可见,FPNM 中总蛋白质含量和总氨基酸含量分别提高了23.49%和16.49%.在最优条件下,PNM 被BS H001发酵后,非必需氨基酸和必需氨基酸都有一定的增加,其中非必需氨基酸总含量相对增加了4.92%,丙氨酸、脯氨酸增幅最大,分别为34.72%、26.09%;总必需氨基酸含量相对增加了43.97%,其中以缬氨酸、蛋氨酸、异亮氨酸、赖氨酸、苏氨酸5 种氨基酸的增幅最大,分别为50.00%、544.44%、45.90%、182.22%、69.03%.理想蛋白质饮食模式中强调了必需氨基酸——赖氨酸含量的重要性,还规定了赖氨酸的标准用量[22];与用豆粕饲喂相比,用在PNM中加入蛋氨酸的饲料饲喂的鸡的生长状况更好.未发酵的PNM 中蛋氨酸和赖氨酸都较缺乏,并且只在足够蛋氨酸的条件下,赖氨酸才会有较好的吸收效果[23].经过发酵后,虽然可以增加PNM 中部分氨基酸的含量,但还是无法解决其中蛋氨酸和赖氨酸严重缺乏的问题,因此在发酵PNM 中外加蛋氨酸和赖氨酸是一个很好的解决办法.
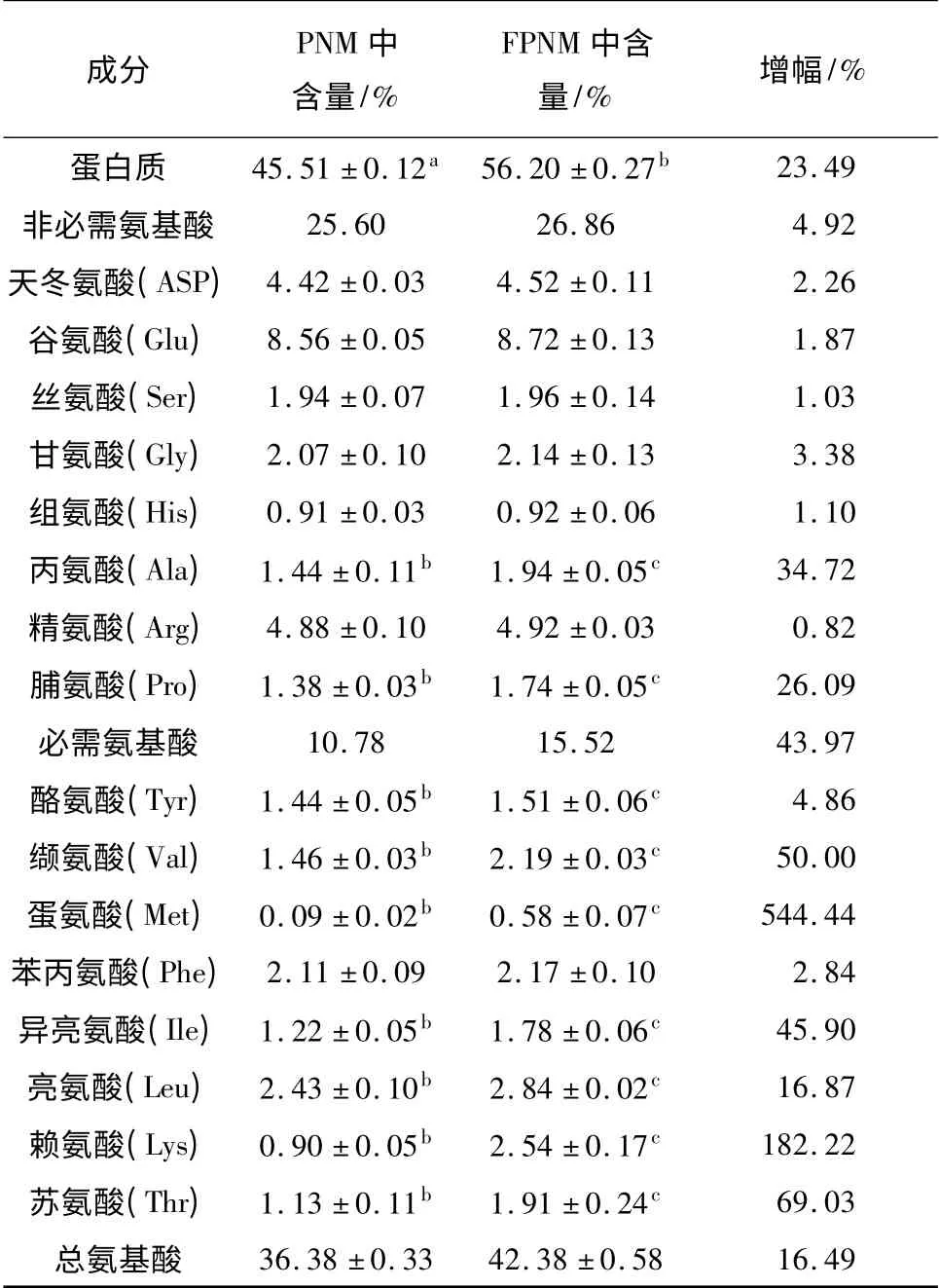
表2 发酵前后PNM 中的氨基酸组成1)Table 2 Composition of amino acids of peanut meal before and after fermentation
3 结语
枯草芽孢杆菌BS H001 发酵PNM 的最优条件为含水量52%、发酵时间44 h、搅拌间隔8 h、灭菌时间45 min、硫酸铵含量4.0%,在此条件下FPNM 中的蛋白质含量为56.20%,比PNM 的提高了23.49%.通过SDS-PAGE 电泳分析可知,经优化后第9、13、15、16 组的PNM 中所含的分子质量为63、48、41 ku的蛋白质大分子被全部降解,FPNM 中非必需氨基酸、必需氨基酸和总氨基酸的含量分别提高了4.92%、43.97%和16.49%.BS H001 还能降解PNM中的黄曲霉毒素(限于篇幅,数据未在文中列出).综上所述,枯草芽孢杆菌BS H001 可用于PNM 的发酵,发酵后PNM 的总蛋白质、总氨基酸、非必需氨基酸和必需氨基酸的含量均得到了提高,能在一定程度上降低PNM 中蛋白质过敏原的含量,为PNM 的动物和人类食用可能性提供了依据.在后续研究中,还将就FPNM 喂饲动物时的消化吸收生物效价、过敏反应等展开探讨,并对枯草芽孢杆菌BS H001 降解PNM 中黄曲霉毒素的降解限量、途径、关键酶和影响因素等进行了解.
[1]Zhao X,Chen J,Du F.Potential use of peanut by-products in food processing:a review[J].Journal of Food Science and Technology,2012,49(5):521-530.
[2]赵晓燕,孙秀平,陈锋亮,等.花生蛋白的研究进展与开发利用现状[J].中国粮油学报,2011,26(12):118-122.Zhao Xiao-yan,Sun Xiu-ping,Chen Feng-liang,et al.Research progress and application of peanut protein [J].Journal of the Chinese Cereals and Oils Association,2011,26(12):118-122.
[3]Strzelecki E,Cader-Strzelecka B.A survey of aflatoxin levels in peanut meal imported into Poland for animal feeding stuffs[J].Food Additives and Contaminants,1988,5(4):597-599.
[4]Hong K,Lee C,Kim S.Aspergillus oryzae GB-107 fermentation improves nutritional quality of food soybean and feed soybean meals[J].Journal of Medical Food,2004,7(4):430-435.
[5]Inatsu Y,Nakamura N,Yuriko Y,et al.Characterization of Bacillus subtilis strains in Thua nao,a traditional fermented soybean food in northern Thailand [J].Letters in Applied Microbiology,2006,4(3):237-242.
[6]Deepak V,Kalishwaralal K,Ramkumarpandian S,et al.Optimization of media composition for Nattokinase production by Bacillus subtilis using response surface methodology[J].Bioresource Technology,2008,9(17):8170-8174.
[7]Dakwa S,Sakyi-Dawson E,Diako C,et al.Effect of boiling and roasting on the fermentation of soybeans into dawadawa(soy-dawadawa)[J].International Journal of Food Microbiology,2005,104(1):69-82.
[8]Song Y S,Frias J,Martinez-Villaluenga C,et al.Immunoreactivity reduction of soybean meal by fermentation,effect on amino acid composition and antigenicity of commercial soy products[J].Food Chemistry,2008,108(2):571-581.
[9]Sarkar P K,Tamang J P.Changes in the microbial profile and proximate composition during natural and controlled fermentations of soybeans to produce kinema [J].Food Microbiology,1995,12(2):317-325.
[10]吴胜华,李吕木,张邦辉,等.多菌种固态发酵豆粕生产小肽饲料[J].食品与发酵工业,2008,34(10):113-115.Wu Sheng-hua,Li Lü-mu,Zhang Bang-hui,et al.Studies on oligopetides feedstuff by solid-stated fermented with manifold strains[J].Food and Fermentation Industries,2008,34(10):113-115.
[11]Feng J,Liu X,Xu Z R,et al.Effect of fermented soybean meal on intestinal morphology and digestive enzyme activities in weaned piglets [J].Digestive Diseases and Sciences,2007,52(8):1845-1850.
[12]Sarkar P,Jones L,Somerset G,et al.Amino acid profiles of kinema,a soybean-fermented food[J].Food Chemistry,1997,59(1):69-75.
[13]王嘉泥,熊焰,胡敏,等.高效降解蛋白枯草芽孢杆菌的筛选及促建鲤生长的研究[J].微生物学通报,2014,41(10):2043-2051.Wang Jia-ni,Xiong Yan,Hu min,et al.Screening of high effective protein-degrading Bacillus subtilis and study on promotion to Jian carp growth[J].Microbiology China,2014,41(10):2043-2051.
[14]刘冬梅,汤石生,胡小惠,等.一种提高花生粕中氨基酸和蛋白质含量的发酵方法:中国,200910193171.X[P].2011-12-28.
[15]Dutt K,Gupta P,Saran S,et al.Production of milk-clotting protease from Bacillus subtilis [J].Applied Biochemistry and Biotechnology,2009,158(3):761-772.
[16]杨晓泉,熊健,陈中,等.低频超声对豆粕蛋白浸出率及SPI 功能特性的影响[J].华南理工大学:自然科学版,2003,31(11):30-32,36.Yang Xiao-quan,Xiong Jian,Chen Zhong,et al.Effects of ultrasonification on protein extraction of defatted soy flakes and functionality of SPI[J].Journal of South China University of Technology:Natural Science Edition,2003,31(11):30-32,36.
[17]Terlabie N N,Sakyi-Dawson E,Amoa-Awua W K.The comparative ability of four isolates of Bacillus subtilis to ferment soybeans into dawadawa[J].International Journal of Food Microbiology,2006,106(2):145-152.
[18]Magdi A M Y,Francis F H,Moustafa A N E,et al.Optimization of cultivation medium and growth conditions for Bacillus subtilis KO strain isolated from sugar cane molasses [J].American-Eurasian Journal of Agriculture and Environment Science,2010,7(1):31-37.
[19]Mueller G A,Maleki S J,Pedersen L C.The molecular basis of peanut allergy[J].Current Allergy and Asthma Reports,2014,14(5):429-434.
[20]Morishita N,Matsumoto T,Morimatsu F,et al.Detection of soybean proteins in fermented soybean products by using heating extraction[J].Journal of Food Science,2014,79(5):1049-1054.
[21]Lio J,Wang T.Solid-state fermentation of soybean and corn processing coproducts for potential feed improvement[J].Journal of Agricultural and Food Chemistry,2012,60(31):7702-7709.
[22]D’Mello J F E.Amino acid supplementation of cerealbased diets for non-ruminants[J].Animal Feed Science and Technology,1993,45(1):1-18.
[23]Kiers J L,Van Laeken A E A,Rombouts F M,et al.In vitro digestibility of Bacillus fermented soya bean[J].International Journal of Food Microbiology,2000,60:163-169.

