新型造影剂在小鼠肝脏肿瘤Micro-CT活体成像中的应用
秦波音,张小楠 ,杨华, 周文江,2,周晓辉
(上海市公共卫生临床中心,上海 201508;2.复旦大学药学院动物中心,上海 201203)
肝癌(HCC)是全世界死亡率最高的恶性肿瘤之一,近20年来其病死率呈日益上升趋势。我国是肝癌高发国家,据统计每年约有11万人死于肝癌,约占全世界肝癌死亡人数的45%,发病率居我国恶性肿瘤发病率的第2位。肝癌发病隐匿,早期常无临床症状,发现时多为晚期[1-2]。肝癌是由病毒和化学致癌物等多病因作用而引起的肝细胞生长失控导致癌变,经启动、促进和演变等多阶段的发病过程,并与基因调控和表达密切相关[3],但目前肝癌的致病机理尚未研究清楚。建立接近人类肝癌临床特征的动物模型,对于深入阐明肝癌的致病机理和临床药物筛选具有非常重要的意义。小鼠肝癌模型是比较经济和实用的动物模型,而以往的研究通常是在多个固定时间点对肝癌小鼠的肝脏进行解剖和病理学观察,这对于研究肝癌的疾病进程和药物筛选具有很大的局限性[4]。
本研究利用小动物活体成像仪——Micro-CT,结合一种特殊的纳米颗粒造影剂可以对小鼠的肝脏进行造影,实现对肝脏区域的连续无创性监测,为利用小鼠开展肝癌致病机理相关研究以及肿瘤药物的筛选提供有力的技术保障。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂
美国通用公司(GE General Electric Company)小动物活体Micro-CT系统,型号为eXplore Locus,最高分辨率为27 μm,后处理软件为系统自带的MicroView 2.0(GE Health Care Co.)。
纳米颗粒造影剂为 Miltenyl Biotech公司生产的 Exitron nano 12000,是一种基于碱土金属的纳米级造影颗粒,其平均直径为110 nm。
1.1.2 实验动物及分组
6~8周龄SPF级雄性C57BL/6J小鼠6只和16月龄的HBV转基因肝癌模型小鼠3只,来源于上海市公共卫生临床中心实验动物部【SCXK(沪)2010-0024】。实验在上海市公共卫生临床中心实验动物部进行【SYXK(沪)2010-0098】。实验小鼠随机共分为3组:低剂量造影组(A组)3只、高剂量造影组(B组)3只和肝癌模型造影组(C组)3只。
1.2 实验方法
1.2.1 造影剂注射及扫描时间
将3组实验小鼠分别固定,酒精擦拭尾静脉,A组注射50 μL纳米颗粒造影剂,B组注射100 μL造影剂。在注射造影剂前(0 min),注射后3 min、24 h、7 d、14 d、28 d和56 d对所有小鼠进行Micro-CT扫描。C组根据A组与B组的结果比较,选择合适剂量进行造影和扫描。
1.2.2 Micro-CT扫描及重建
将实验小鼠麻醉后(腹腔注射1%的戊巴比妥钠,50 mg/kg),仰卧平放于CT扫描床上,小鼠胸部用绷带压迫进行固定。选择仪器自带的“Scan”应用软件,以Fluro方式选择胸腹部区域进行扫描,自定义扫描方案(Protocol),具体扫描参数如下:扫描分辨率为93 μm,管电压50 kV,管电流450 μA,扫描模式360°旋转,扫描时间为16 min,平均帧数2帧,角度增益0.7°,曝光时间300 ms,探测器组件模式4×4。扫描同时将标准体模放于样品床下方,用于CT值的校正,扫描完成后将生成的原始图像经标准体模校正后重建至精度为93 μm的高分辨率图像。
1.2.3 增强前后灰度值对比曲线测定
对A组和B组每个扫描时间点小鼠的肝脏进行分析,在小鼠肝脏左叶、肝右叶的中心区域和边缘区域(避开大血管)分别通过高级ROI方式(advanced ROI)各选取2个圆柱体为感兴趣区 (region of interest,ROI)进行灰度值(gray scale value)均值测定,单个ROI的圆底直径为2.5 mm,高为5个断层扫描层面的间距,ROI体积为2.25 mm3,计算整个肝脏的平均灰度值。将未注射纳米颗粒造影剂前肝脏的灰度值和注射造影剂后各时间点的灰度值比较并绘制成曲线,用于评价该造影剂的增强作用。
1.2.4 肝癌模型小鼠Micro-CT动态观察
对C组小鼠分别在注射造影剂前(0 min),注射后3 min、24 h、7 d、14 d、28 d和56 d对所有小鼠进行Micro-CT扫描,监测C组小鼠肝脏肿瘤的影像学变化。
1.2.5 肝癌模型小鼠组织病理学检查
对C组小鼠于第56天全部安乐死,取肝组织,中性缓冲福尔马林固定后,做常规石蜡切片,HE染色,光镜下观察。
1.3 统计学处理
所有实验数据以平均值±标准差(Mean±SD)表示,实验结果应用GraphPad Prism v 5.0软件进行数据管理和分析,采用独立样本t检验进行组间比较,P<0.05为有统计学意义。
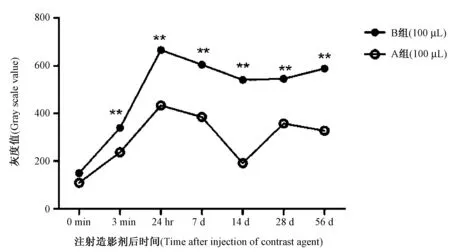
注:B组与A组相比差异有显著性(**P<0.01)。
2 结果
2.1 两种浓度造影剂在不同时间点的增强效果
A组和B组小鼠在注射造影剂前和注射后各时间点进行Micro-CT活体扫描,选取小鼠肝脏的CT灰度值制作“肝脏增强效果曲线”(图1)。结果显示:正常小鼠在注射两种不同浓度的造影剂后,肝脏感兴趣区的平均灰度值均比注射前明显升高,在注射后24 h达到峰值,A组和B组注射后24 h小鼠肝脏感兴趣区的平均灰度值分别是造影前的3.95倍和4.44倍;7 d时分别为3.51和4.03倍;56d时分别为2.98和3.92倍。两种浓度造影剂在注射后56d内,小鼠肝脏感兴趣区的平均灰度值与注射前相比均维持在较高的水平,B组小鼠在造影剂注射后各扫描时间点肝脏感兴趣区的平均灰度值显著高于A组小鼠(P< 0.05)。
A组和B组小鼠在三维重建后,选取各时间点的冠状位图片进行比较(图2和图3)。结果显示:A组和B组小鼠在注射造影剂后各时间点肝脏的对比度明显高于注射前,两组小鼠在注射造影剂后24 h的图像对比度在各个时间点中为最高,肝脏实质和边缘轮廓均非常清楚。两组小鼠在造影剂注射后56 d内肝脏仍然保持很高的增强,B组小鼠在造影剂注射后各扫描时间点肝脏增强均高于A组小鼠。

图2 A组小鼠静脉注射ExiTron nano 12000造影剂前后冠状位图像

图3 B组小鼠静脉注射ExiTron nano 12000造影剂前后冠状位图像
2.2 肝癌模型小鼠Micro-CT活体动态监测
C组小鼠在注射造影剂前和注射后各时间点进行Micro-CT活体扫描,三维重建后选取小鼠各时间点的图片进行比较(图4,彩插13)。冠状位图像可以看到在注射造影剂后3min~56d期间肝脏的对比度明显高于注射前,而24h、7d、14d、28d和56d均能非常清楚的看到肝脏癌性结节的存在(图中红色箭头)。肝癌模型小鼠肝脏组织学观察。
HE染色:C组小鼠进行病理学观察,发现肝脏出现非典型性增生,肿瘤细胞核大,染色质加深(图5A、图5C),肝脏大片状出血,炎细胞浸润,肝细胞坏死(图5B、图5D)等典型特征。显示C组小鼠肝脏存在肝癌相关病理学表现(图5见彩插13)。
3 讨论
肿瘤疾病的研究一直受到医学研究者的关注, 在目前的研究中动物肿瘤模型的应用越来越广泛。肝癌的形成历经启动、促进、进展和癌变的过程,是一个涉及多因素、多步骤和多阶段的复杂过程。肝癌模型包括自发性肿瘤模型、移植性肿瘤模型、诱发性肿瘤模型和人体肿瘤的异种移植性肿瘤模型共4种[5-6]。
大量证据表明,慢性乙型肝炎患者罹患肝细胞癌的几率大大升高。Chisari等[7]发现,表达HBV大S抗原的转基因小鼠在12月龄以后会自发形成肝脏肿瘤,且雄性患肿瘤的几率高于雌性。本研究所用的HBV转基因小鼠即为Chisari等报道的50-4品系。此品系易发肝肿瘤的表型在本研究中得到了验证。小动物X射线计算机扫描系统(Micro-CT)是专门为小动物设计和开发的,由于它具有临床CT所不具备的高分辨率和容积成像技术,并能够以非侵入的方式结合造影剂后,可实时监测肿瘤的转移、发生和发展等指标,从而能够动态追踪肿瘤药物的治疗及预后[8-20],使其逐渐成为临床前研究的一个有力选择。
本实验所使用的新型造影剂为一种基于碱土金属的纳米级造影颗粒,该种颗粒的直径平均为110 nm,静脉注射后此种造影剂可以进入网状内皮系统,在肝脏可被巨噬细胞和枯否氏细胞吞噬。由于正常肝脏富含网状内皮细胞,而肿瘤内无或少含该类细胞,因此造影剂能够增加肿瘤和肝实质之间的对比度[21]。
从结果可以发现:两组正常小鼠在注射不同浓度的纳米颗粒造影剂后,小鼠肝脏均具有很好的显影效果,24h增强效果到达峰值,同时该新型纳米颗粒造影剂能使小鼠肝脏的增强程度在56d内仍然保持在一个很高的水平。B组效果显著好于A组,提示注射100 μL剂量的ExiTron nano 12000更有利于长期观察。临床上广泛使用的非离子型造影剂是通过静脉注射进行显影,但其代谢速度较快,不利于肿瘤的长期监测。
在HBV转基因肝癌模型小鼠的连续影像学监测中可清楚地观察到肝脏癌性结节存在,取模型小鼠肝脏进行组织切片染色,发现肝脏出现非典型性增生,肿瘤细胞核增大,染色质加深,肝脏大片状出血,炎性细胞浸润和肝细胞坏死等肝癌相关的病理学改变,表明该纳米颗粒造影剂可以在肝癌模型小鼠活体内较好地显示肝脏肿瘤的存在情况。
总之,本研究通过静脉注射新型纳米颗粒造影剂,成功建立了肝脏肿瘤Micro-CT活体造影成像方法,可以为肝肿瘤小鼠提供快速、清晰和较长时间的连续无创性监测,从而为研究肝癌发病原因、致病机理和肿瘤药物的筛选提供有力的技术保障。
(本文图4,5见彩插13)。
[1] Le M, Nelson R, Lee W, et al.An appraisal of radiofrequency ablation and surgical resection for hepatocellular carcinoma: results from the surveillance, epidemiology, and end results registry [J].Am Surg, 2012, 78(10): 1091-1095.
[2] 李晓娟, 白云峰, 崔智, 等.常用实验动物肝癌模型研究进展 [J].中国比较医学杂志, 2012, 22(4): 73-77.
[3] Thorgeirsson SS, Grisham JW.Molecular pathogenesis of human hepatocellular carcinoma [J].Nat Genel, 2002, 31(4): 339-346.
[4] Schambach SJ, Bag S, Schilling L, et al.Application of micro-CT in small animal imaging [J].Methods, 2010, 50: 2-13.
[5] Arvold ND, Taghian AG, Niemierko A, et al.Age, breast cancer subtype approximation, and local recurrence after breast-conserving therapy [J].J Clin Oncol, 2011, 29(29): 3885-3891.
[6] Arriagada R, Le MG, Guinebretiere JM, et al.Late local recurrences in a randomized trial comparing conservative treatment with total mastectomy in early breast cancer patients [J].Ann Oncol, 2003, 14(11): 1617-1622.
[7] Chisari FV, Klopchin K, Moriyama T, et al.Molecular pathogenesis of hepatocellar carcinoma in hepatitis B virus transgenetic mice [J].Cell, 1989, 59: 1145-1156.
[8] Willekens I, Lahoutte T, Buls N, et al.Time-course of contrast enhancement in spleen and liver with Exia 160, Fenestra LC, and VC [J].Mol Imaging Biol, 2009, 11: 128-135.
[9] Suckow CE, Stout DB.Micro-CT liver contrast agent enhancement over time, dose, and mouse strain [J].Mol Imaging Biol, 2008, 10: 114-120.
[10] Graham KC, Detombe SA, MacKenzie LT, et al.Contrast-enhanced microcomputed tomography using intraperitoneal contrast injection for the assessment of tumor-burden in liver metastasis models [J].Invest Radiol, 2008, 43: 488-495.
[11] Montet X, Pastor CM, Vallee JP, et al.Improved visualization of vessels and hepatic tumors by micro-computed tomography (CT) using iodinated liposomes [J].Invest Radiol, 2007, 42: 652-658.
[12] Almajdub M, Nejjari M, Poncet G, et al.In-vivo high-resolution X-ray microtomography for liver and spleen tumor assessment in mice [J].Contrast Media Mol Imaging, 2007, 2: 88-93.
[13] Ohta S, Lai EW, Morris JC, et al.MicroCT for high-resolution imaging of ectopic pheochromocytoma tumors in the liver of nude mice [J].Int J Cancer, 2006, 119: 2236-2241.
[14] Weber SM, Peterson KA, Durkee B, et al.Imaging of murine liver tumor using microCT with a hepatocyte-selective contrast agent: accuracy is dependent on adequate contrast enhancement [J].J Surg Res, 2004, 119: 41-45.
[15] Bakan DA, Doerr-Stevens JK, Weichert JP, et al.Imaging efficacy of a hepatocyte-selective polyiodinated triglyceride for contrast-enhanced computed tomography [J].Am J Ther, 2001, 8: 359-365.
[16] Bakan DA, Weichert JP, Longino MA, et al.Polyiodinated triglyceride lipid emulsions for use as hepatoselective contrast agents in CT: effects of physicochemical properties on biodistribution and imaging profiles [J].Invest Radiol, 2000, 35: 158-169.
[17] Bakan DA, Longino MA, Weichert JP, et al.Physicochemical characterization of a synthetic lipid emulsion for hepatocyte-selective delivery of lipophilic compounds: application to polyiodinated triglycerides as contrast agents for computed tomography [J].J Pharm Sci, 1996, 85: 908-914.
[18] Weichert JP, Longino MA, Bakan DA, et al.Polyiodinated triglyceride analogs as potential computed tomography imaging agents for the liver [J].J Med Chem, 1995, 38: 636-646.
[19] Martiniova L, Kotys MS, Thomasson D, et al.Noninvasive monitoring of a murine model of metastatic pheochromocytoma: a comparison of contrast-enhanced microCT and nonenhanced MRI [J].J Magn Reson Imaging, 2009, 29: 685-691.
[20] Martiniova L, Schimel D, Lai EW, et al.In vivo micro-CT imaging of liver lesions in small animal models [J].Methods, 2010, 50: 20-25.
[21] Boll H, Nittka S, Doyon F, et al.Micro-CT based experimental liver imaging using a nanoparticulate contrast agent: a longitudinal study in mice [J].PLoS ONE, 2011, 6(9): e25692.

