233例感染铜绿假单胞菌的老年患者耐药性分析
张毅斐,武元赫,张 毅,牛慧彦,何 平*
0 引言
铜绿假单胞菌是临床上最常见的引起严重院内获得性感染的条件致病菌之一。随着广谱抗菌药物、激素、化疗药物及免疫抑制剂的广泛应用,各种创伤性操作的增加,近年来铜绿假单胞菌已逐渐成为老年患者医院感染的主要致病菌。本文收集本院年龄大于65岁的感染铜绿假单胞菌的患者,回顾性分析铜绿假单胞菌感染的用药治疗情况,进行耐药性分析,为临床预防及合理选用抗菌药物提供理论依据。
1 材料与方法
1.1 病例选择 2013年 1月至 2014年 7月我院各科住院患者送检的标本中分离到铜绿假单胞菌233株。如同一患者多次检出该菌株,则结果以第一次为准。
1.2 病原菌的鉴定及药敏试验 按照卫生部《全国临床检验操作规程》的要求对标本进行分离培养,应用法国生物梅里埃公司的全自动细菌鉴定与药敏分析仪VITEK 2 COMPACT,采用 Kirby-Bauer 纸片扩散法,参照 2013年美国国家临床实验室标准化委员会(CLSI)的药敏判定折点进行耐药性的判读。
1.3 统计学处理 采用SPSS 19.0统计软件对数据进行分析,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般数据 233例感染铜绿假单胞菌患者,男149例,女84例。患者年龄65~91岁,平均年龄73.77岁。
2.1.1 科室来源 233例感染铜绿假单胞菌患者,在临床中主要分布于呼吸内科 25.75%,ICU 20.60%,全部外科 22.31%。见表1。
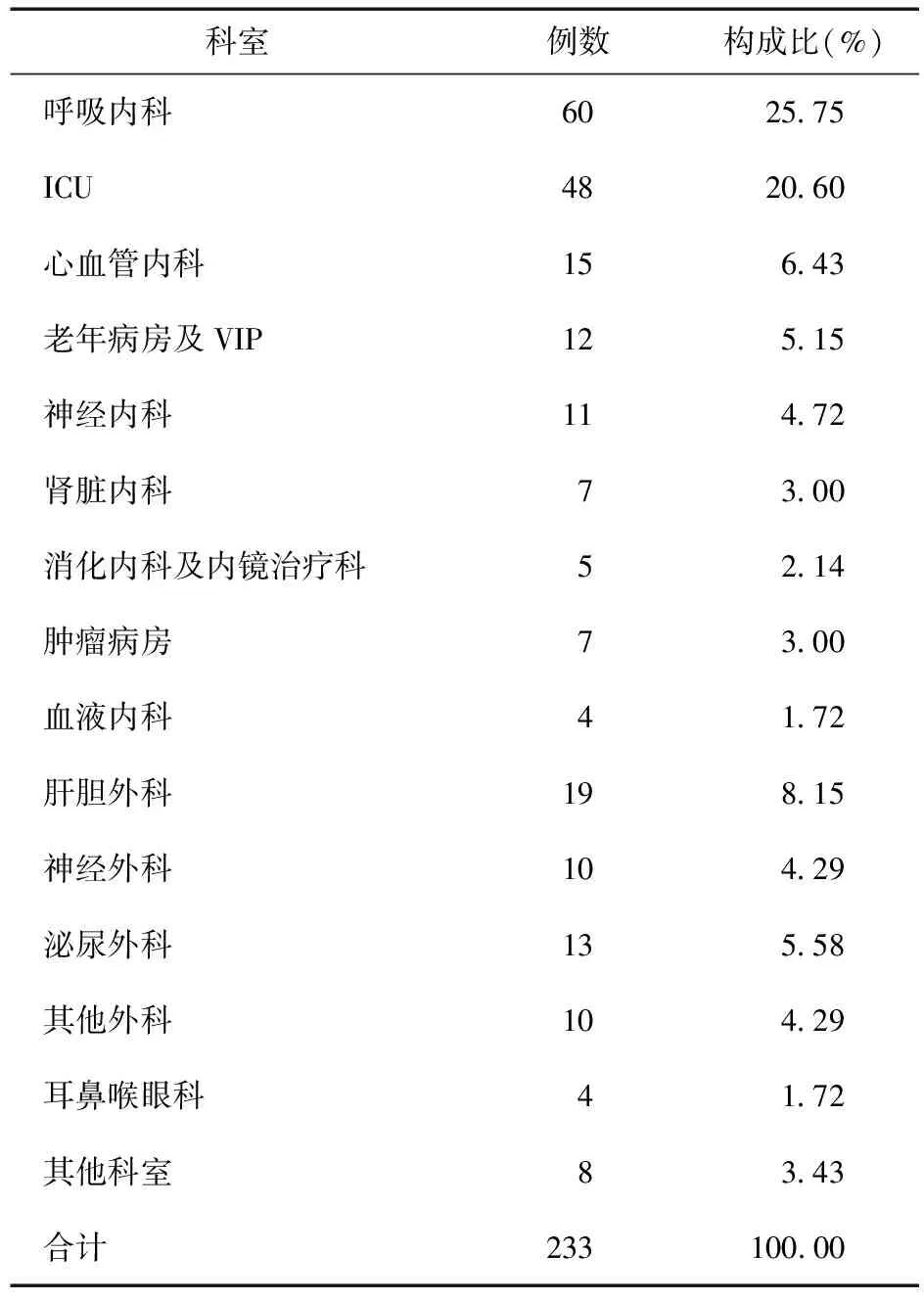
表1 铜绿假单胞菌临床科室分布
2.1.2 科室来源 233例铜绿假单胞菌标本主要集中在痰液、尿液、引流液,分别占63.95%、13.73%、7.73%。见表2。

表2 铜绿假单胞菌标本种类及分布构成比
2.2 铜绿假单胞菌的耐药分析 见表3。由表3可见,铜绿假单胞菌对常用的18种抗菌药物呈现多重耐药。阿米卡星、庆大霉素、妥布霉素耐药率较低。

表3 铜绿假单胞菌对18种抗菌药物的药敏试验结果
3 讨论
3.1 铜绿假单胞菌感染现状 铜绿假单胞菌分布于自然界及健康人的呼吸道、肠道及皮肤等。其对外界环境抵抗力较强,在潮湿处能长期生存,对湿热、紫外线及化学消毒剂均有较强的抵抗力。当人体正常防御机制被改变或受损时,如:对于气管切开或插管、留置尿管或肿瘤患者,应用激素等免疫功能缺陷患者,铜绿假单胞菌即可从潜伏状态进展为感染,甚至重症感染导致死亡。通过对我院分离的 233株铜绿假单胞菌进行研究,有63.95%菌株检自痰标本,该结果与2009、2010 和 2011 年度中国 Chinet报道结果相符[1-3],提示呼吸系统对铜绿假单胞菌易感性最强[4]。老年人铜绿假单胞菌感染部位以下呼吸道为主,其主要原因包括呼吸器官老化、肺泡组织及支气管弹力降低、纤毛活动减弱等导致呼吸道分泌物的不易排出,为细菌的繁殖创造良好条件。其次是尿液,本研究中留置尿管25例,占10.73%,增加了感染铜绿假单胞菌的风险,因此临床监测重点应放在呼吸道和泌尿系上。从临床科室分布来看,铜绿假单胞菌感染分布第一科室为呼吸内科(60株),与李进等[5-6]报道有差异,可能与我院呼吸内科具有独立的 CCU 病房有关。外科病房共计标本52例,占22.31%。外科手术后机体抵抗力下降,出现创面,增加感染风险,感染由血液迅速播散,易发生难治性菌血症,死亡率极高。故不可忽视术后伤口感染,医护人员应严格执行无菌术,避免医源性传播。
3.2 耐药分析 铜绿假单胞菌本身具有天然耐药性[7],也极容易产生获得性耐药[8-10]。铜绿假单胞菌耐药复杂多样,主要机制包括:①铜绿假单胞菌可产生多种水解酶,包括超广谱 β-内酰胺酶(ESBL)、头孢菌素酶(AmpC)、产金属酶(MBL)、碳青霉烯酶、氨基糖苷钝化酶等破坏内酰胺环,从而使抗菌药物失活,主要包括青霉素类、头孢菌素类、氨基糖苷类、碳青霉烯类;②铜绿假单胞菌能产生含有降解酶的生物被膜,抑制及阻止白细胞、巨噬细胞和抗菌药物等杀灭细菌,同时开启突变耐药基因,是造成抗菌药物耐药的重要原因之一;③对抗菌药物通透具有特殊意义的孔蛋白通道,如OprD2缺失,导致进入菌株内的碳青霉烯类等抗菌药物浓度减少,导致耐药;④青霉素结合蛋白及 DNA 拓扑异构酶结构的改变影响了抗菌药物的作用靶位,从而逃避β-内酰胺类和喹诺酮类抗菌药物的杀灭作用;⑤铜绿假单胞菌还可以通过主动外排泵机制将抗菌药物排出菌体,致使菌内药物浓度达不到有效杀菌浓度而产生耐药[11]。
根据药敏结果分析,本院铜绿假单胞菌对氨苄西林耐药最为严重,达到100%。对头孢噻肟、头孢曲松、头孢哌酮/舒巴坦也有极高的耐药率,这可能与我院临床应用较多有关。本研究中,在感染发生前使用三代或三代以上的头孢菌素151例,占64.81%,建议临床治疗中不应该经验性应用三代头孢,应根据药敏结果选择敏感的三代头孢,以恢复耐药头孢菌素的抗菌活性。哌拉西林/他唑巴坦的耐药率高达41.85%,与2011年中国CHINET铜绿假单胞菌耐药性监测数据不符(其报道哌拉西林/他唑巴坦是β-内酰胺类药物中抑菌率最高的药物,2007-2011年耐药率从32.8%下降至21.7%),可能由于本院应用哌拉西林/他唑巴坦(特治星)数量较多,如来自呼吸内科的60例患者中,14例应用该药物,占23.33%。
在中国不同地区十余家医院临床分析铜绿假单胞菌的耐药性监测中,2007-2011年亚胺培南、美罗培南的平均耐药率分别为29.1%、25.0%[2-3],本研究中亚胺培南、美罗培南耐药率高达34.97%和31.25%,表明碳青霉烯类药物的耐药性有不断升高的趋势。主要原因是近年来碳青霉烯类使用率大大增加,有报道,该类药物耐药的发生率是未使用过的24倍[12],但耐药率水平亚胺培南高于美罗培南,研究表明与外膜孔蛋白(OprD2)的缺失和数量减少有关[13],OprD2 是亚胺培南进入细菌的特殊通道[14],而此通道对美罗培南无作用。
复方新诺明属磺胺类药物,毛雄英等[15]对铜绿假单胞菌连续3年耐药率检测中,复方新诺明均为100%耐药,本研究中其耐药率仅为25.45%,可能由于该药品为临床门诊常用药物,而本研究中标本全部来自于住院患者,并且其不良反应较多,临床应用日趋减少。
阿米卡星是铜绿假单胞菌耐药率最低的抗菌药物,也是唯一敏感率超过80%的抗菌药物。Mohnarin全国细菌耐药监测及SMART全 球 性 的 耐 药 监 测等的数据显示,铜绿假单胞菌对阿米卡星敏感率最高[16-17]。2008-2011 年该菌对庆大霉素耐药率从31.2%降至29.9%,略有下降[3]。本研究中庆大霉素耐药率进一步下降,达21.43%,可能与我院临床中取消加用庆大霉素冲洗尿管,减少用药机会相关。虽然氨基糖苷类药物(阿米卡星、庆大霉素、妥布霉素)药物敏感性排名前三位,但由于本研究为老年患者,其肾功能日趋减退,加上氨基糖苷类药物毒副作用大(肾脏、听力、前庭神经),因而限制了其在临床中的应用。
3.3 治疗 2007年关于CAP管理的IDSA/ATS共识指南[18]及2012年ICS、NCCP联合颁布CAP和HAP的相关诊疗指南[19],如感染假单胞菌,推荐治疗方案:抗假单胞菌头孢菌素、碳青霉烯类、β-内酰胺类/β-内酰胺酶抑制剂三选一,联合一种抗假单胞菌氟喹诺酮类或氨基糖苷类。根据本研究中检测的药敏结果,结合老年患者的特性,治疗上单独用药往往效果欠佳,多需连用几种有效抗菌药物[20],临床上可试用:①减少阿米卡星用量,同时联合应用敏感的三代头孢。王远长等[21]在使用上述方案治疗老年社区获得性肺炎的研究中,其治疗有效率比单独应用阿米卡星有效率高16.6%,未出现肾功能损害。②碳青霉烯类联合喹诺酮类环丙沙星或左氧氟沙星等,喹诺酮类对生物膜的穿透率为90%,而阿米卡星为59%[22]。喹诺酮类在呼吸道具有很高的组织浓度,氨基糖苷类在多数组织中低于血药浓度(在肺组织中的分布浓度极低)。药敏结果示喹诺酮类(环丙沙星、左氧氟沙星、罗米沙星)的耐药率均低于30%,故临床中倾向第二种方案。对于治疗效果欠佳的铜绿假单胞菌感染患者可在两种抗菌药物联用的基础上,加用阿奇霉素,虽然大环内酯类本身并不具有杀灭铜绿假单胞菌的作用,但具有良好的生物膜穿透性,能够抑制和破坏生物膜的形成[23],以提高机体对铜绿假单胞菌的消除力。还可加入中药双黄连辅助治疗,在抑菌抗病毒的同时,与喹诺酮类药物联用,对铜绿假单胞菌生物被膜具有明显的抑制作用,且两种药物具有明显的协同作用[24]。
综上所述,我院老年患者中分离的铜绿假单胞菌耐药性情况不容乐观,呈现出多重耐药且耐药率不断上升的特点。医院应实施抗菌分级管理,医护人员应严格执行无菌操作,结合老年患者感染特点,积极治疗基础疾病,合理使用抗菌药物,减少各种侵入性操作,缩短住院时间等综合措施,以降低老年患者感染铜绿假单胞菌的发生率及耐药性。
参考文献:
[1] 张祎博,倪语星,孙景勇,等.2009 年中国CHINET铜绿假单胞菌细菌耐药性监测 [J].中国感染与化疗杂志,2010,10(6):436-440.
[2] 张祎博,倪语星,孙景勇,等.2010 年中国CHINET铜绿假单胞菌细菌耐药性监测 [J].中国感染与化疗杂志,2012,12(3):161-166.
[3] 施晓群,孙景勇,倪语星,等.2011年中国CHINET铜绿假单胞菌耐药性监测 [J].中国感染与化疗杂志,2013,13(3):218-221.
[4] 应易高,李海玲,赵勇.269 株铜绿假单胞菌耐药性分析[J].中华医院感染学杂志,2008,18(2):267-269.
[5] 李进.243 株铜绿假单胞菌的临床分布及耐药性分析[J].检验医学与临床,2012,9(14):1787-1788.
[6] 黄强,熊劲芝,黄红卫,等.2006~2012 年铜绿假单胞菌本院感染调查及耐药监测[J].中南药学,2014,12(2):187-190.
[7] 王彬.铜绿假单胞菌的耐药性分析[J].中国社区医师.医学专业,2011,13(263):163-164.
[8] 李镛,张柏膺,严峻海.60例医院获得性肺炎患者铜绿假单胞菌生物被膜形成能力的分析[J].临床肺科杂志,2014,19(4):600-604.
[9] 燕成岭,曹银芳,贾海琴.铜绿假单胞菌感染分布及耐药性分析[J].中国医药,2012,7(10):1314-1315.
[10]韦柳华.不同标本分离的耐碳青霉烯铜绿假单胞菌的耐药性分析[J].实用医学杂志,2013,29(1):117-119.
[11]周秀岚,赵建平,武芳,等.耐亚胺培南铜绿假单胞菌的耐药及基因分析[J].中国医药,2013,8(2):243-244.
[12]汪宏梅.147株铜绿假单胞菌的分布及耐药性分析[J].检验医学与临床,2008,5(2):68-71.
[13]何建方,沈翠芬,王伟洪,等.多重耐药铜绿假单胞菌耐药基因的检测与分析[J].中国卫生检验杂志,2010,20(2):392-394.
[14]王岚,吴怡,王珊珊,等.铜绿假单胞菌313株的临床分布与药敏分析[J].实用医学杂志,2012,28(9):1532-1534.
[15]毛雄英,吕婉飞,张媛媛.临床分离铜绿假单胞菌的分布特征及耐药性研究[J].中国消毒学杂志,2014,31(3):251-252.
[16]肖永红,沈萍,魏泽庆,等.Mohnarin 2011 年度全国细菌耐药监测[J].中华医院感染学杂志,2012,22(22):4946-4952.
[17]Liu YM,Chen YS,Toh Hs,et al.In vitro susceptibilities of non-Enterobacteriaceae isolates from patients with intra-abdominal infections in the Asia-Pacific region from 2003 to 2010:results from the Study for Monitoring Antimicrobial Resistance Trends(SMART)[J].Int Antimicrob Agents,2012,40 Suppl:11-17.
[18]Mandell LA,Wunderink RG,Anzueto A,et al.Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults[J].Clin Infect Dis,2007,44(Suppl 2):S27-S72.
[19]Gupta D,Agarwal R,Aggarwal AN,et al.Guidelines for diagnosis and management of community-and hospital-acquired pneumonia in adults:Joint ICS/NCCP(I)recommendations[J].Lung India,2012,29(Suppl 2):S27-S62.
[20]张栩.485例铜绿假单胞菌院内感染的耐药性及危险因素分析[D].吉林:吉林大学,2013.
[21]王远长,秦俭.依替米星联合三代头孢菌素治疗老年社区获得性肺炎的临床研究[J].临床肺科杂志,2009,14(11):1493-1495.
[22]Abdi-Ali A,Mohammadi-Mehr M,Alaei YA.Bactericidal activity of various antibiotics against biofilm-producing Pesudomonas aeruginosa[J].Int J Antimicrob Agents,2006,27(3):196-200.
[23]魏光,叶英,沈继录.2009-2012年铜绿假单胞菌耐药性分析[J].中国医院感染学杂志,2013,23(24):6115-6117.
[24]王彦,方颖,于淑芬,等.双黄连注射液与莫西沙星联用对铜绿假单胞菌生物被膜的影响[J].临床和实验医学杂志,2011,10(1):10-11.

