右美托咪定对感染性休克大鼠脾脏及胸腺caspase-3、caspase-8、caspase-9表达及淋巴细胞凋亡的影响
姬 斌,秦培顺,南 洋,黄葱葱,李 军
0 引言
感染性休克亦称脓毒性休克,主要由革兰阴性菌及该菌产生的内毒素过度刺激机体的免疫系统而产生过量炎性细胞因子[1]。感染性休克是临床危重患者常见死亡原因,尽管有多种先进的治疗方法,但在重症病房的致死率依然高达20%以上[2]。目前研究成果表明,感染性全身炎症反应患者的炎症细胞因子和免疫蛋白主要在脾脏巨噬细胞内生成,胸腺组织中也有体现[3]。本次研究采用内毒素制备感染性休克大鼠模型,采用右美托咪定予以干预,观察大鼠血清IL-4、IL-10、IFN-γ和IL-2的水平,并检测脾脏及胸腺caspase-3、caspase-8和caspase-9活性及淋巴细胞凋亡情况。
1 资料与方法
1.1 实验动物模型制作 选取雄性12周龄Walse大鼠36只(由温州医科大学实验动物中心提供,许可证号:SYXY(浙)2009-0129),每笼3只。适应性喂养3 d后,采用数字表法随机分为3组:空白组(S组)、内毒素组(E组)和右美托咪定治疗组(D组)。S组:静脉持续泵入0.9%生理盐水1.0 mL/(kg·h);E组:静脉注射内毒素15 mg/kg,2 min后持续泵入0.9%生理盐水,剂量1.0 mL/(kg·h);D组:静脉注射内毒素15 mg/kg,2 min后持续泵入右美托咪定(盐酸右美托咪定注射液,商品名:艾贝宁,规格:200 μg/2 mL,江苏恒瑞医药股份有限公司,批号:H20110086),剂量:5 μg/(kg·h)。
1.2 研究方法 用药0.5、1、2、3、4、6 h后,每组选取存活Walse大鼠6只,颈动脉采血1 mL[2],检测血清中IL-4、IL-10、IFN-γ和IL-2等炎性细胞因子水平,6 h后存活者以脱颈法处死,分离脾脏及胸腺组织,用10%福尔马林溶液固定后,石蜡包埋、切片,于-70 ℃环境保存。
1.2.1 炎性细胞因子检测 采用ELISA(酶联吸附法)检测3组大鼠血清IL-4、IL-10、IFN-γ和IL-2的含量,仪器选用μ-Quant酶标分光光度仪(美国Bio-Tek公司)、ELISA检测试剂盒(BIoSoURCE公司)。
1.2.2 脾脏及胸腺caspase-3、caspase-8和caspase-9活性检测 采用免疫组织化学染色法检测。将脾脏、胸腺石蜡切片分别脱蜡、内源性过氧化物酶封闭后,分别滴加兔抗鼠caspase-3、caspase-8和caspase-9多克隆抗体(北京中杉金桥生物技术有限公司,滴度1∶100),PBS代替一抗做阴性对照。40 ℃过夜后滴加二抗,二抗为生物素标记羊抗小鼠1gG(Santa Cruz公司,滴度1∶200),DAB(美国Sigma公司)显色,苏木素复染,脱水,透明,封片[4]。采用彩色病理图像分析系统对切片进行图像分析。
1.2.3 淋巴细胞凋亡检测 取脾脏、胸腺石蜡切片进行脱蜡、粉碎处理,经400目不锈钢筛网过滤制成单细胞悬液,1 500 r/min离心5 min,弃上清,PBS漂洗2次,重悬PBS溶液中室温孵育30 min后加入碘化丙啶(PI)染色,400目尼龙网再次过滤后,采用FACS Calibur流式细胞仪(美国Beckman公司)检测,操作按说明书要求进行。
1.2.4 淋巴细胞亚群的检测 取脾脏、胸腺单细胞悬液PBS漂洗2次,采用双管标记检测法,即采用CD4、CD8和IFN-γ FITC三色标记一管检测Th1细胞,CD4、CD8和IL-4 PE三色标记一管检测Th2细胞。室温孵育15 min、SBP洗涤2次后,每管分为2份,分别加入APC标记的anti-mouse IFN-γ和IL-4与各自的同型对照,计算Th1(CD4+/IFN-γ+)和Th2(CD4+/IL-4′)的百分率。
1.2.5 图像分析 采用Image-pro PLUS 6.0彩色病理图像分析系统对切片进行图像分析,采用阳性细胞计数法,每张切片在高倍镜下随机选取4个无重叠视野,计数每个视野的阳性细胞数,取平均值记录。
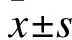
2 结果
2.1 三组大鼠不同时间点血清中各细胞因子浓度情况 与S组相比,E组、D组大鼠血清的抗炎因子IL-4、IL-10水平和促炎因子IFN-γ、IL-2均显著提高,差异有统计学意义(P<0.05);随治疗时间延长,E组的IL-4、IL-10水平降低,IFN-γ、IL-2水平升高;D组的IL-4、IL-10水平升高,IFN-γ、IL-2水平降低,两组间比较差异有统计学意义(P<0.05)。见表1。
2.2 三组大鼠脾脏caspase-3、caspase-8、caspase-9表达及淋巴细胞凋亡情况 与S组相比,E组、D组的大鼠脾脏caspase-3、caspase-8、caspase-9表达及淋巴细胞凋亡的阳性细胞数均显著增多,差异均有统计学意义(P<0.05);与E组相比,D组大鼠脾脏caspase-3、caspase-8、caspase-9表达及淋巴细胞凋亡的阳性细胞数均显著减少,差异有统计学意义(P<0.05),且caspase-9表达的阳性细胞数减少幅度最为明显。见表2。
2.3 三组大鼠胸腺caspase-3、caspase-8、caspase-9表达及淋巴细胞凋亡情况 与S组相比,E组、D组的大鼠胸腺caspase-3、caspase-8、caspase-9表达及淋巴细胞凋亡的阳性细胞数均显著增多,差异有统计学意义(P<0.05);与E组相比,D组大鼠胸腺caspase-3、caspase-8、caspase-9表达及淋巴细胞凋亡的阳性细胞数均显著减少,差异有统计学意义(P<0.05),且caspase-9表达的阳性细胞数减少幅度最为明显。见表3。
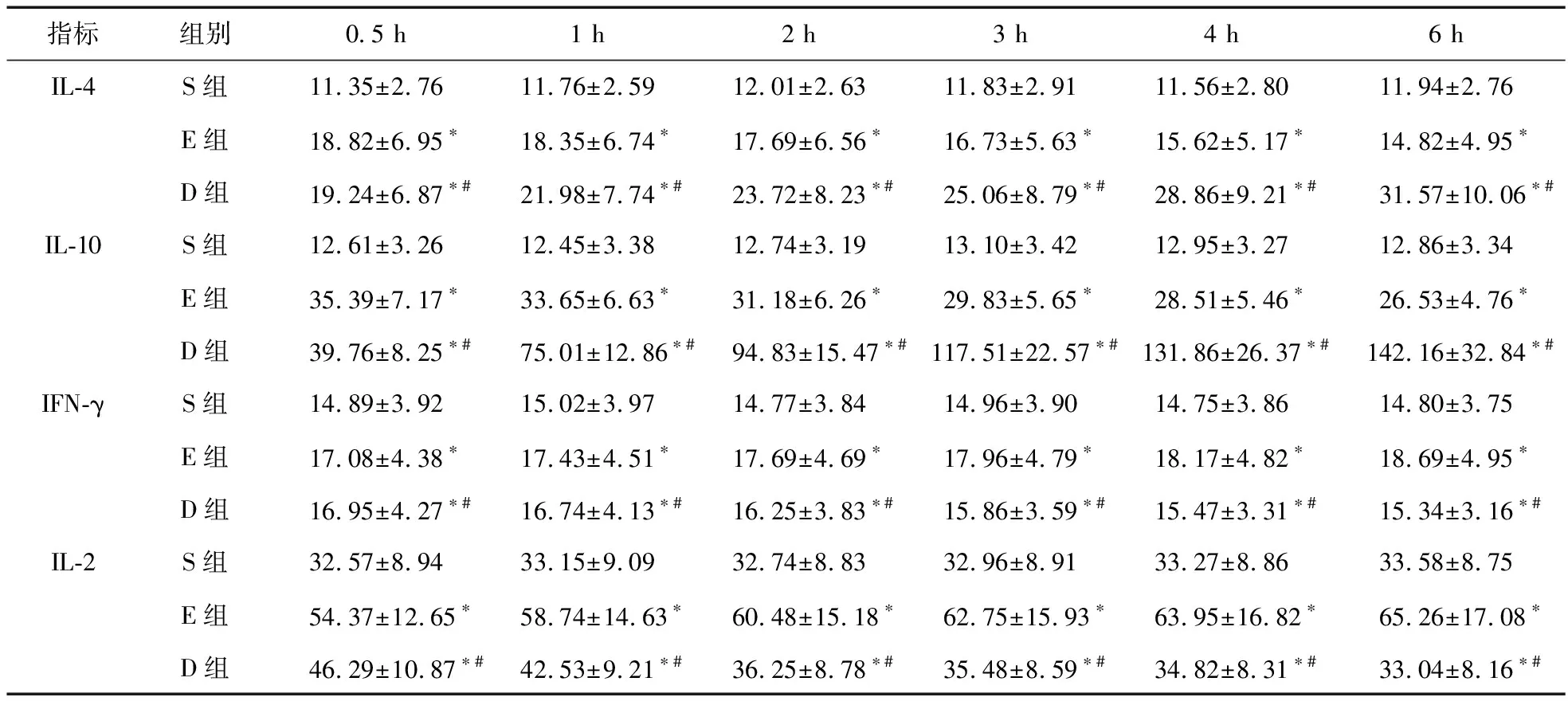
表1 三组大鼠不同时间点血清中各细胞因子浓度比较(ng/L)

表2 三组大鼠脾脏caspase-3、caspase-8、caspase-9表达及淋巴细胞凋亡的阳性细胞数比较(个/400倍野)

表3 三组大鼠脾脏caspase-3、caspase-8、caspase-9表达及淋巴细胞凋亡的阳性细胞数比较(个/400倍野)
2.4 E组和D组的Th1/Th2比率比较 D组大鼠脾脏及胸腺Th1/Th2比率均显著高于E组,两组的脾脏及胸腺Th1/Th2比率比较差异均有统计学意义(P<0.05)。见表4。

表4 E组和D组的Th1/Th2比较(%)
3 讨论
IFN-γ和IL-2属于促炎因子,IFN-γ主要由Thl与Tcl细胞分泌,IL-2由Thl细胞分泌;IL-4和IL-10属于抗炎因子,主要由Th2细胞分泌[5]。发生感染性休克后,机体内的炎性反应体系迅速启动,多种炎性细胞因子被释放进入微循环[6]。现有研究结果表明,感染可以使免疫应答或向Thl或向Th2极化,这对成功控制感染和避免免疫能力下降的修复都非常重要[7]。Nikonenko等[8]认为,促炎因子介导细胞免疫反应,诱导 Thl细胞产生 IFN-α,增大 T淋巴细胞和 NK细胞的细胞毒作用。Boyman等[9]认为,IL-2水平与T淋巴细胞的免疫功能呈正相关,IL-2水平下降,T淋巴细胞的免疫清除能力就减弱,导致免疫损伤。Foitzik等[10]的研究则显示,IL-10的抗炎作用在机体内十分普遍,贯穿炎症反应的所有环节,其抑制炎症、维持细胞因子平衡的作用已被众多学者认可。而IL-4具有显著的抗炎作用,可以有效抑制内毒素(LPS)介导的炎性因子产生[11],Th2细胞也主要通过IL-4参与机体免疫反应,调节机体免疫系统进行不同种类的免疫应答反应[12]。
炎性反应早期,促炎因子处于优势,引发淋巴细胞凋亡,导致caspase-8聚合而发生激活,随机产生caspase蛋白酶解级联反应,并进一步激活其同源酶。caspase-3通常是以无活性前体存在于细胞中,当细胞进入凋亡时才被激活;caspase-8的级联反应也能够促使caspase-3激活[13]。细胞色素C(Cyt C)在细胞凋亡早期从线粒体膜间隙进入细胞浆中参与激活caspase-9,再激活caspase-3发生链式生物效应,最终使细胞DNA断裂、细胞开始凋亡。激活后的caspase能再次促使线粒体释放Cyt C,使细胞凋亡形式更加严重[14]。右美托咪定是一种高选择性α肾上腺素受体激动药[15],具有减轻炎症介质的释放和部分抑制炎症因子的放大效应,使去甲肾上腺素的释放减少,而去甲肾上腺素的水平具有调节机体免疫应答和炎症反应的重要作用。因此,右美托咪定可能是通过减少去甲肾上腺素的释放而使炎症反应减轻,并改善免疫能力[16]。
本研究采用右美托咪定干预治疗感染性休克大鼠,结果IL-4、IL-10水平随治疗时间延长而升高,IFN-γ、IL-2水平降低,说明Th1/Th2随治疗时间而升高,此结果与Memisx等[17]的研究成果一致。本研究结果表明,右美托咪定干预治疗可使感染性休克大鼠Th1/Th2升高。右美托咪定干预使感染性休克大鼠脾脏及胸腺caspase-3、caspase-8、caspase-9表达及淋巴细胞凋亡的阳性细胞数显著减少,且caspase-9表达的阳性细胞数减少幅度最为明显。因此,右美托咪定可能通过调节感染性休克大鼠机体内的炎性反应,促进Th1/Th2平衡,减少淋巴细胞凋亡;而且还可能通过调节其体内炎性反应抑制脾脏及胸腺的caspase-3、caspase-8、caspase-9活性,从而也减少淋巴细胞凋亡。
综上所述,右美托咪定对感染性休克大鼠具有减轻炎症反应和改善免疫能力的作用,有利于改善预后。
参考文献:
[1] 薛娜,梁辉,姚辉,等.脾脏在电刺激迷走神经抗大鼠感染性休克中的作用[J].中国危重病急救医学,2011,23(5):263-276.
[2] 吴云,柯建娟,张宗泽.布托啡诺对感染性休克大鼠细胞因子的影响[J].中华急救医学杂志,2010,19(2):132-134.
[3] Nance DM,Sanders VM.Autonomic innervation and regulation of the immune system[J].Brain Behav Immun,2011,21(17):736-745.
[4] 王乐,陈磊,李雪芬,等.三氧化二砷对肝癌细胞系SMMC-7721凋亡及Smac caspase-9,caspase-3蛋白表达的影响[J].现代生物医学进展,2013,13(33):6440-6444.
[5] 章莉莉,孙志坚,张东军,等.右美托咪定镇静对机械通气脓毒症休克患者细胞免疫和炎性因子的影响[J].河北医科大学学报,2013,34(1):33-36.
[6] 张昌锋,吴秀娟,蒋宗明,等.右美托咪定镇静对机械通气脓毒症休克患者细胞免疫和炎性因子的影响[J].河北医科大学学报,2013,34(1):33-36.
[7] 蒋红涛,陈艳,唐贵文.曼氏裂头蝴感染小鼠外周血T淋巴细胞亚群及IL-4,IL-10,IFN-γ,TNF-α的动态变化[J].中国病原生物学杂志,2009,4(11):840-843.
[8] Nikonenko BV,Portopopova M,Samala R,et al.Drug therapy of experimental tuberculosis(TB):improved outcome by combining SQl09,a new dimaine antibiotic,with existing TB drugs[J].Antimierob Agents Chemother,2007,51(4):l563-1565.
[9] Boyman O,Surh CD,Sprent J.Potentialuse of IL-2/anti-IL-2 antibody immune complexes for the treatment of cancer and autoimmune disease[J].Expert Opin Biol Ther,2006,6(12):1323-1331.
[10]Foitzik T,Hotz HG,Eibl G et al.Therapy for microcirculatory disorders in severe acute pancreatitis:effectiveness of platelet-activating factor receptor blockade vs.endothelin receptor blockade[J].J Gastrointest Surg,1999,3(3):244-251.
[11]Li B,Tournier C,Davis RJ,et al.Regulation of IL-4 expression by the transcirption factor Jun B duirng T helper cell differentiation[J].EMBOJ,2009,18(2):420-432.
[12]李旭芳,刘玲玲,张菊,等.急性MCMV感染对小鼠脾Thl/Th2/Th17细胞亚群分化的影响[J].中国免疫学杂志,2013,29(5):464-467.
[13]吴文秀,崔利娟,陈煌,等.截断逆挽方对慢加急性肝衰竭大鼠肝细胞凋亡指数及caspase8,caspase3表达的影响[J].北京中医药,2012,31(1):62-64.
[14]Zhuge J,Cederbaum AI.Inhibition of the mitochondrial permeability transition by cyclosporin A prevents pyrazole plus lipopolysaccharide-induced liver injury in mice[J].Free Radic Biol Med,2009,46(3):406-413.
[15]甘建辉,史金麟,胡万宁,等.右美托咪定在乳腺癌前哨淋巴结活检术中的临床应用[J].中国药房,2013,21(10):921-924.
[16]李志鹏,柳垂亮.右美托咪定的临床应用进展[J].实用医学杂志,2013,29(19):3254-3256.
[17]Memisx D,Hekimoglu S,Vatan I,et al.Effects of midazolam and dexmedetomidine on inflammatory responses and gastric intramucosal pH to sepsis,in critically ill patients[J].Br J Anaesth,2007,98(12):550-552.

