乳果糖对乙肝后肝硬化患者肝功能、炎症及肠道通透性水平的影响
季晓军,王伟军
0 引言
随着慢性乙肝发病率的升高,肝硬化也已经成为我国居民重要的死亡原因之一。肝硬化的发病机制较复杂,迄今国内外尚未完全研究清楚[1]。近年来研究发现,乙肝后肝硬化患者常伴有不同程度炎症反应和肠道通透性增加,炎症细胞分泌大量的炎症因子,通过通透性增加的肠道粘膜进入血,通过介导肝细胞的损伤,在肝硬化的发病机制中发挥极其重要的作用。如何有效地阻断炎症反应,减少炎症因子的分泌,降低肠道粘膜的通透性,保护肠粘膜的屏障功能在肝炎后肝硬化患者的治疗和并发症的预防中显得尤为重要[2-3]。乳果糖是一种不被小肠黏膜双糖酶分解的人工合成的双糖,近年来研究发现,其辅助治疗肝硬化具有一定的作用,但其作用机制尚不完全明了[4]。本研究观察了乳果糖对乙肝后肝硬化患者肝功能、炎症因子和肠道粘膜的通透性水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 选择2011年1月至2013年4月在我院消化科门诊就诊的乙肝后肝硬化患者80例。纳入标准:符合2000年全国病毒性肝炎会议制定的肝硬化诊断标准[5],均经实验室血清指标、肝胆超声或CT等检查明确诊断,且具有典型的乙肝后肝硬化临床表现。排除标准:①治疗前4周内有明显急、慢性感染,腹膜炎或发生消化道出血;②伴发其他基础代谢疾病;③对药物成分过敏者;④治疗前1个月服用过抗生素、益生菌和促胃肠动力药。采用随机数字表法将80例患者随机分为治疗组和对照组,每组40例。两组患者性别、年龄、病程等一般情况比较差异无统计学意义(P>0.05),具有可比性。见表1。本研究方案均经我院伦理委员会批准通过,纳入的所有患者研究前均知情同意,并签署知情同意书。

表1 两组患者治疗前一般情况比较
1.2 治疗方法 两组患者均行利尿、常规保肝和对症支持治疗,治疗组在此基础上加用乳果糖口服液10 g,2~3次/d,并根据大便情况适当调整乳果糖剂量。对照组除不使用乳果糖口服液外,其余治疗均与治疗组基本相同。1个月后观察两组患者治疗前后肝功能、炎症因子水平和肠道通透性的变化,并比较自发性腹膜炎(SBP)的发生率。
1.3 观察指标
1.3.1 肝功能的测定 采用全生化分析仪测定丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)和血总胆红素(TB)。
1.3.2 血清炎症因子水平的测定 取晨空腹静脉血5~8 mL,3 000 r/min低温分离出上层的血清,将血清分装于EP管内于-20 ℃冰箱保存。采用酶联免疫法测定血清白介素-6(IL-6)、白介素-8(IL-8)和肿瘤坏死因子-α(TNF-α)的水平,试剂盒分别由深圳晶美生物公司和上海西塘生物公司提供,严格按照试剂盒的说明书进行实验操作。
1.3.3 肠道通透性水平的测定 采用血清内毒素、D-乳酸和降钙素原(PCT)3个间接指标测定患者的肠道通透性水平。采用偶氮基质显色法测定血清内毒素水平,试剂盒由上海伊华临床医学科技公司提供;用改良酶学分光光度法测定血清D-乳酸水平,试剂盒由Sigma公司提供;采用化学发光法测定血清PCT水平,试剂盒由南京诺尔曼生物技术有限公司提供,均严格按照试剂盒的说明书进行实验操作。
1.3.4 SBP的诊断标准 采用腹水培养多形核白细胞(PMNL)的方法进行间接诊断,如果PMNL计数≥250 cells/m3,排除继发性腹膜炎可确诊SBP。
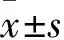
2 结果
2.1 两组患者治疗前后肝功能指标改善情况 两组患者治疗前ALT、AST和TB水平比较差异无统计学意义(P>0.05)。治疗1个月后,两组患者ALT、AST和TB水平较治疗前均显著下降,差异有统计学意义(P<0.05或P<0.01),且治疗组患者下降程度显著高于对照组(P<0.01),见表2。

表2 两组患者治疗前后肝功能指标ALT、AST和TB水平的改善情况
2.2 两组患者治疗前后血清炎症因子改善情况 两组患者治疗前血清炎症因子IL-6、IL-8和TNF-α水平比较差异无统计学意义(P>0.05)。治疗1个月后,两组血清IL-6、IL-8和TNF-α均较治疗前有显著下降,差异有统计学意义(P<0.05),且治疗组下降程度显著高于对照组(P<0.01),见表3。

表3 两组患者治疗前后血清炎症因子IL-6、IL-8和TNF-α水平的改善情况
2.3 两组患者治疗前后肠道通透性指标变化 两组患者治疗前内毒素、D-乳酸和PCT水平比较差异无统计学意义(P>0.05)。治疗1个月后,两组患者内毒素、D-乳酸和PCT水平均较治疗前明显下降,差异有统计学意义(P<0.05或P<0.01),且治疗组下降幅度较对照组更明显(P<0.05)。见表4。

表4 两组患者治疗前后肠道通透性指标血清内毒素、D-乳酸和PCT水平的变化
2.4 两组患者治疗过程中SBP的发生率比较 治疗组治疗过程中发生SBP 3例(7.5%),对照组发生SBP 10例(25.0%)。治疗组的SBP发生率明显低于对照组,差异有统计学意义(χ2=4.50,P<0.05)。
3 讨论
肝炎后肝硬化是临床常见病和多发病,是肝炎患者病情进展的必经之路。肝炎后肝硬化患者肝功能损伤严重,免疫功能低下,并发症多,易引起腹腔感染发生SBP[6-8]。据统计,肝硬化患者伴SBP的发生率高达10%~25%,病死率更是高达60%,预后较差[9]。近年来研究发现,炎症因子在SBP的发生和发展过程中起重要作用,主要由于肠黏膜屏障功能受损和肠细菌易位引起血清炎症因子表达异常引起,其中关系较密切的有IL-6、IL-8和TNF-α[10-11]。IL-6主要由单核巨噬细胞分泌,能激活并促进T、B淋巴细胞和自然杀伤细胞的合成与分化,参与急性肝细胞炎症反应过程[12]。TNF-α具有增强NK细胞杀伤靶细胞、激活T细胞和B细胞分化、增强吞噬的功能,是参与肝硬化炎症反应过程的重要炎症介质之一[13]。IL-8是一种趋化性炎症因子,具有趋化和激活中性粒细胞作用,参与了肝硬化患者炎症反应损伤过程[14]。陈银芸等[15]研究也发现,肝炎肝硬化合并SBP患者较未合并SBP患者血清、腹腔积液中TNF-α、IL-8和IL-18水平显著升高。因此,调节血清IL-6、IL-8和TNF-α水平,抑制肝硬化患者的局部炎症反应过程是治疗乙肝后肝硬化患者的新途径。
乙肝后肝硬化患者肠道粘膜屏障受损,从而削弱了肠道的粘膜屏障功能,增加肠道粘膜的通透性,使肠道细菌和内毒素大量易位,引起肠源性内毒素血症和肝昏迷等并发症,加重肝功能损伤,导致肝硬化病情的加重[16-19]。肠粘膜屏障的完整性受损,肠道内的细菌、内毒素、D-乳酸及PCT移位入血,引起血内毒素和D-乳酸及PCT异常升高。因此,血清内毒素和D-乳酸及PCT水平可作为肠粘膜通透性、肠道粘膜屏障异常的主要血清学指标[20-23]。因此,通过调节血清内毒素、D-乳酸和PCT水平,降低肠道粘膜通透性也是治疗乙肝后肝硬化患者的新途径。
乳果糖是一种人工合成的双糖,口服后在结肠被A-半乳糖苷酶分解成为双歧杆菌生长所需要的碳源,促进了双歧杆菌的繁殖,从而使得肠道B族维生素产生增多,起到营养肠道作用[24-26]。徐红等[27]研究发现,乳果糖能明显降低乙型肝炎后肝硬化血清内毒素水平,减少肠源性内毒素血症的发生,辅助治疗肝硬化具有较好的疗效。孙瑜等[28]通过动物研究发现,乳果糖能通过降低血浆内毒素水平,降低肠道通透性,显著降低血清炎症因子TNF-α水平,减轻肝硬化患者的炎症反应,减少自发性腹膜炎的发生率。本研究结果显示,治疗1个月后,两组患者ALT、AST和TB水平较治疗前均显著下降,且治疗组下降程度显著高对照组;同时两组血清IL-6、IL-8和TNF-α均较治疗前显著下降,且治疗组下降程度显著高对照组。提示乳果糖能明显改善乙肝后肝硬化患者的肝功能指标,促进患者肝功能恢复,降低炎症因子的水平。同时研究发现,治疗1个月后,两组患者内毒素、D-乳酸和PCT水平均较治疗前明显下降,且治疗组下降幅度较对照组更明显。提示乳果糖能明显降低乙肝后肝硬化患者血清内毒素、D-乳酸和PCT水平,降低肠道通透性,保护肠粘膜屏障功能。同时研究还发现,治疗组的SBP发生率显著低于对照组(P<0.05)。提示乳果糖能减少乙肝后肝硬化患者自发性腹膜炎的发生率。
总之,乳果糖用于治疗乙肝后肝硬化患者,能促进患者肝功能恢复,降低炎症因子的水平,降低肠道通透性,保护肠粘膜屏障功能,从而减少自发性腹膜炎的发生率。
参考文献:
[1] 王昱澍,李杰.肝硬化患者细胞因子TNF-α、IL-8检测的意义[J].中国医学工程,2011,19(8):61-63.
[2] 孙明珠,党双锁.细胞因子与慢性肝脏疾病的研究进展[J].世界华人消化杂志,2009,281(21):2121-2125.
[3] 苏英,杨宣,李新月,等.肝硬化腹水患者内毒素、细胞因子水平的检测及临床意义[J].临床肝胆病杂志,2006,22(3):202-204.
[4] 徐义军,王超.乳果糖对门脉高压大鼠肠粘膜屏障功能保护作用的研究[J].中外医疗,2012,20(12):18-20.
[5] 中华医学会传染病寄生虫病学会修订.病毒性肝炎防治方案[J].中华传染病学杂志,2000,l9(6):241-243.
[6] 张风兰.恩替卡韦治疗失代偿期乙型肝炎肝硬化的临床疗效[J].医学理论与实践,2011,24(20):2454-2455.
[7] Rau BM,Krüger CM,Hasel C,et al.Effects of Immunosuppressive and immunostimulative treatment on pancreatic injury and mortality in severe acute experimental pancreatitis[J].Pancreas,2006,33(2):174-183.
[8] 胡敏涛,孙彤,裴豪,等.血必净注射液对乙型肝炎肝硬化腹膜炎患者多种细胞因子的影响[J].实用医学杂志,2012,28(21):3629-3631.
[9] 崔凤芹,黄凯,崔海彬,等.肝硬化自发性细菌性腹膜炎的治疗和预防[J].中国临床医生,2013,41(8):6-7.
[10]González Alonso R,González García M,Albillos Martínez A.Physiopathology of bacterial translocation and spontaneous bacterial peritonitis in cirrhosis[J].Gastroenterol Hepatol,2007,30(2):78-84.
[11]Ancel D,Barraud H,Peyrin-Biroulet L,et al.Intestinal permeability and cirrhosis[J].Gastroenterol Clin Biol,2006,30(3):460-468.
[12]全敏,邢卉春.肝硬化合并自发性细菌性腹膜炎诊断的研究进展[J].中华实验和临床感染病杂志(电子版),2012,6(2):156-158.
[13]王西栋,张广兰.乙型肝炎患者血清IL-2、IL-6、IL-8和TNF-α水平研究[J].预防医学论坛,2008,14(4):309.
[14]王文仙,周锋利.肝硬化患者外周血及腹腔积液TNF-α、IL-6、IL-8与自发性腹膜炎关系的探讨[J].中国医师杂志,2003,5(10):1418-1420.
[15]陈银芸,霍继荣.乙型肝炎肝硬化并发腹膜炎患者血清及腹腔积液TNF-α、IL-8、IL-18水平临床意义的探讨[J].中国当代医药,2010,17(14):32-33.
[16]宋于生,赖卫国,曾敏,等.部分性脾栓塞术治疗肝炎后肝硬化门脉高压合并脾功能亢进的临床疗效[J].实用医学杂志,2013,29(24):4077-4079.
[17]周伏喜,卢方根,吴小平,等.肝炎肝硬化患者肠壁通透性变化与细菌移位的临床研究[J].中国现代医学杂志,2008,18(10):1438-1440.
[18]刘树人,罗显荣,陈汉先,等.选择性肠道去污染对肝硬化自发性细菌性腹膜炎肠黏膜通透性的影响[J].胃肠病学和肝病学杂志,2011,20(8):719-721.
[19]邹俊,李学明,陈海鸣.门静脉高压症脾切除贲门周围血管离断术后门静脉血栓形成的相关因素分析[J].实用医学杂志,2013,29(4):581-583.
[20]陈秀凯,邱方,程爱国.肠道屏障功能的监测方法的现状与进展[J].中国煤炭工业医学杂志,2003,6(7):669-671.
[21]于淑霞,王惠吉.肝硬化患者肠道通透性及乳果糖对其影响的研究[J].临床肝胆病杂志,2006,22(2):108-110.
[22]高金生,时志民,韩转叶,等.肝硬化肠黏膜屏障损伤患者血浆D-乳酸、二胺氧化酶及内毒素的变化[J].临床荟萃,2009,24(3):219-221.
[23]张崴,陈礼明,张世兰,等.肝硬化伴自发性细菌性腹膜炎患者血浆降钙素原的检测及其临床意义[J].中华医学杂志,2003,83(7):605-606.
[24]金晓慧,王伟军.乳果糖对肝硬化患者肝功能及肠黏膜屏障功能的影响[J].中国药师,2012,15(12):1756-1758.
[25]沈琦,俞亚峰.乳果糖联合培菲康预防肝硬化自发性细菌性腹膜炎的疗效观察[J].中国微生态学杂志,2013,25(8):943-945.
[26]胡世红,郑岳,张顺财,等.乳果糖对肝硬化大鼠细菌易位和内毒素的影响[J].中国临床医学,2002,9(4):407-409.
[27]徐红,李睁,金水忠.乳果糖治疗乙型肝炎后肝硬化内毒素血症的疗效观察[J].中国临床新医学,2011,4(5):451-453.
[28]孙瑜.乳果糖对肝硬化大鼠血浆内毒素(LPS)、肿瘤坏死因子(TNF)及血清ALT的影响[J].中国临床新医学,2008,17(6):4-5.

