抗雄激素联合双侧睾丸切除术在前列腺癌患者中的应用
陈世瞻,宋 珺,邓振农
0 引言
前列腺癌是指发生在前列腺的上皮性恶性肿瘤,我国肿瘤登记地区前列腺癌发病率为9.92/10万,列男性恶性肿瘤发病率的第6位,近年来随着社会的发展和人们生活方式的变化,我国前列腺癌的发病率持续上升[1-2]。同时,由于前列腺癌起病隐匿,早期症状不明显,且我国居民普遍缺乏常规体检习惯,导致大部分前列腺癌患者发病就诊时已发生周围组织浸润或转移,失去了根治性治愈的机会[3-4]。目前,临床上对于失去根治机会的前列腺癌患者主要以药物或手术治疗为主[5]。手术去势或药物去势治疗的目的是使血清睾酮浓度降低,二者的疗效基本相同,可以使60%~70%患者的病情得到有效控制,去势后的患者长期处于低雄激素和相对高雌激素状态,会导致心血管系统疾病、骨密度下降、骨质疏松症等一系列并发症,严重影响治疗的效果,同时,双侧睾丸切除术后,患者会患有不同程度的血糖、血脂等代谢综合征。药物去势医疗费用较高,无法全面推广应用,而且患者最终都会发展为激素非依赖性前列腺癌或激素抵抗性前列腺癌[6]。近期的研究显示,肿瘤局部雄激素水平的维持以及雄激素受体的扩增或突变,在激素非依赖性前列腺癌或激素抵抗性前列腺癌中发挥了重要作用,因此,我们推测,使用抗雄激素治疗有可能取得一定的临床治疗效果[7]。本研究以我院2007年3月至2013年3月收治的失去根治手术机会的前列腺癌患者80例为研究对象,探讨抗雄激素联合双侧睾丸切除术在治疗晚期失去根治手术机会前列腺癌患者中的作用。
1 资料与方法
1.1 一般资料 收集我院2007年3月至2013年3月收治的失去根治手术机会的前列腺癌患者80例,年龄58~75岁,平均年龄(68.31±3.29)岁,所有患者均经临床检测与穿刺活检确诊为前列腺癌,随机将研究对象分为常规药物去势治疗对照组和抗雄激素联合双侧睾丸切除术治疗观察组,每组40例。两组患者在年龄、Gleason评分和临床分期等方面未见显著差异,组间具有可比性(P>0.05),见表1。本研究方案上报医院伦理委员会批准,所有患者均签署知情同意书。
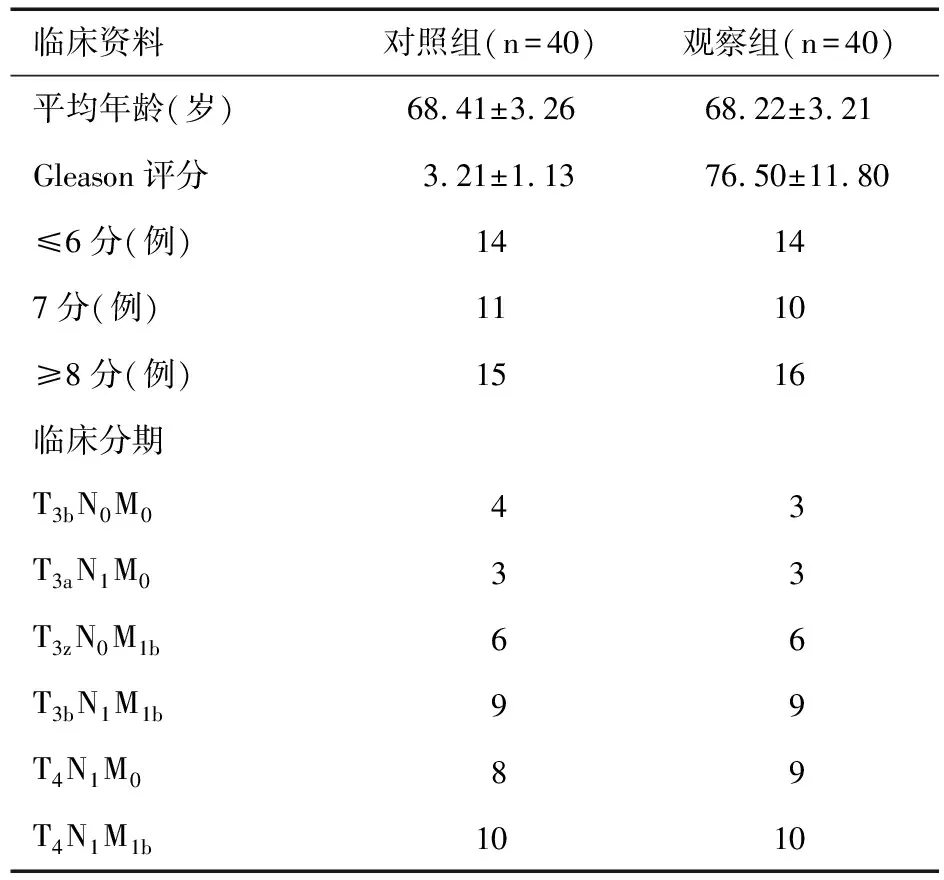
表1 两组患者临床资料比较
1.2 治疗方法 所有患者均行基础治疗与护理。对照组常规使用诺雷得(阿斯利康制药有限公司,国药准字:J20120015),皮下注射,2.8 mg/次,共注射1~2次。观察组使用双侧睾丸切除术手术去势治疗,患者术后1周开始口服抗雄激素药物比卡鲁胺胶囊(山西振东制药股份有限公司,国药准字:H20060983),50 mg/d。疗程为3个月。
1.3 研究指标及评价方法 功能情况和临床症状评价使用EORICQLQ-C30生活质量评价量表体系完成,其中生活质量评价包括躯体功能、认知功能、情绪角色功能和社会功能4项,满分100分,分值越高,代表患者此项社会功能越好;临床症状评价包括疼痛、恶心、呕吐和疲倦4项,满分100分,分值越高,代表患者此项症状越明显。不良反应包括呼吸困难、失眠、食欲不振、便秘及腹泻等。QLQ-PR25量表评价患者的生活质量,此量表包括性生活状况、肠道症状、排尿功能、治疗相关症状等25个因子。
2 结果
2.1 两组患者功能情况比较 治疗3个月后,观察组患者躯体功能、认知功能、情绪角色功能和社会功能4项得分分别为78.79±5.49、75.40±5.37、78.41±6.50、71.19±5.43,对照组分别为71.19±5.32、75.40±5.37、71.10±8.54、65.09±5.48,观察组上述4项得分均显著高于对照组(P<0.05)。见表2。
2.2 两组患者临床症状情况比较 治疗3个月后,观察组患者疼痛、恶心、呕吐和疲倦得分分别为51.11±4.32、43.21±7.70、42.11±8.23、58.40±12.12,对照组分别为67.60±10.13、54.30±7.60、50.48±9.21、68.54±3.89,观察组上述四项得分均显著低于对照组(P<0.05)。见表3。
2.3 两组患者不良反应情况和生活质量比较 观察组患者人均报告不良反应次数为(3.21±1.13)次,显著低于对照组的(5.49±2.98)次(P<0.05);而观察组患者生活质量评分为76.50±11.80,显著高于对照组的62.29±12.18(P<0.05)。见表4。

表2 两组患者功能情况比较

表3 两组患者临床症状情况比较

表4 两组患者不良反应情况和生活质量比较
3 讨论
自上个世纪40年代Huggins和Hodges发现前列腺癌的激素依赖性后,内分泌治疗成为晚期前列腺癌患者的主要治疗策略[8]。就目前而言,主要有药物去势和手术去势两种方法可以选择[9-10],但无论是何种方法,都不能彻底治愈前列腺癌,只能起到延缓其发展的作用,而几乎所有的晚期前列腺癌患者都会最终转为激素非依赖性癌。以往的研究认为,前列腺癌患者体内的雄激素主要是由睾丸产生,但是近年来的研究发现,虽然去势后前列腺癌患者血清中睾酮的水平可以降低95%以上,但是前列腺组织中睾酮和双氢睾酮的表达水平仅仅降低70%~80%,进一步的实验研究证实,睾酮在肾上腺合成后的主动运输以及前列腺癌细胞的自身合成是维持前列腺癌组织内雄激素水平的主要机制,而且在前列腺癌转移灶中也发现了高的雄激素水平,这一现象也支持了实验的发现[11]。目前治疗的重点也在于如何延缓激素非依赖性这一转变发生的速度和进程。以往,双侧睾丸切除术去势法一直被广泛应用,尤其是在医疗条件不佳的情况下,更是被作为治疗晚期前列腺癌的金标准。但有研究显示,双侧睾丸切除术后,患者的血糖、血脂等都会出现问题,患者会患有不同程度的代谢综合征,并极大增加患者发生心血管事件的风险[12-13]。药物去势是另外一个重要的治疗策略,但在实际应用中发现,一方面药物去势医疗费用较高,一些患者或医疗服务条件不理想的区域无法使用,另一方面,药物治疗并未彻底纠正患者体内激素分泌紊乱,甚至进一步造成了紊乱,导致药物去势的效果并不理想[14-15]。前列腺癌局部雄性激素的聚集发挥促进癌细胞增殖的活性,主要是依赖癌细胞表面的雄激素受体实现的,然而雄激素受体的激活并不完全依赖于雄激素,其只需要在一定量雄激素水平下就可以被生长因子、细胞因子、激酶等功能蛋白激活,例如胰岛素样生长因子、表皮生长因子等,通过这些旁路激活途径就可以使雄激素受体通路与许多信号通路间相互交流,可见雄激素在整个通路激活过程中担负着重要的功能[16]。在本研究中,我们将双侧睾丸切除术应用于晚期失去手术机会的前列腺癌患者,并辅以口服抗雄激素治疗拮抗雄激素的作用,取得了较好的临床效果,患者功能情况和生活质量都得到了显著的改善。
本研究结果显示,治疗3个月后,观察组患者躯体功能、认知功能、情绪角色功能和社会功能4项得分均高于对照组,差异有统计学意义(P<0.05)。同时,观察组患者在疼痛、恶心、呕吐和疲倦4项得分上均低于对照组,差异有统计学意义(P<0.05)。说明采用双侧睾丸切除术配合抗雄激素药物的治疗方案可以更有效地提高晚期前列腺癌患者的各项功能,降低患者临床症状。同时,提高患者的各项机体功能,降低疾病给患者带来的痛苦,在临床中具有重要意义[17]。另外,本研究结果显示,在整个研究期间,观察组患者人均报告不良反应次数低于对照组,在研究结束时,观察组患者生活质量评分高于对照组,差异均有统计学意义(P<0.05)。说明使用双侧睾丸切除术配合口服抗雄激素药物的治疗方案发生不良反应的比率更低,原因可能是由于双侧睾丸切除术后,患者仍处于雄激素敏感时段,此时恰当的抗雄激素,使患者的血糖、血脂及体内多种因子的分泌更趋于平稳,所以产生的并发症少,而较少的不良反应又可以作为促进患者功能恢复的基础与保障,使患者可以保留更多功能,两者之间是互为因果、相辅相成的[18-19]。同时,本研究结果显示,治疗后3个月时,观察组患者生活质量高于对照组,改善癌症晚期患者的生活质量,在现阶段的医疗环境及医学趋势下,具有积极意义。
综上所述,我们认为,使用抗雄激素联合双侧睾丸切除术可以有效提高晚期前列腺癌患者的各项生理、心理和社会功能,改善患者临床症状,降低不良反应发生率,改善患者生活质量,值得在临床上推广使用。但受实验条件和水平的限制,我们未对研究对象进行更长时间的随访,未能说明这种治疗方式对于晚期前列腺癌患者长期生存情况的影响,相关结果将在后续研究中开展。
参考文献:
[1] 彭鹏,龚杨明,鲍萍萍,等.中国2008年前列腺癌发病、死亡和患病情况的估计及预测[J].中华流行病学杂志,2012,33(10):1056-1059.
[2] 周毅彬,单玉喜,范秋虹,等.三维适形放疗联合内分泌治疗局部晚期前列腺癌25例[J].实用医学杂志,2012,28(23):3971-3973.
[3] 王永川,魏丽娟,刘俊田,等.发达与发展中国家癌症发病率与死亡率的比较与分析[J].中国肿瘤临床,2012,39(10):679-682.
[4] 戴亮,关晓海.前列腺癌的相关危险因素分析[J].中国医药,2012,7(11):1481-1484.
[5] Mitsiades N.A road map to comprehensive androgen receptor axis targeting for castration-resistant prostate cancer[J].Cancer Res,2013,73(15):4599-4605.
[6] 王潇然,王伟华.激素非依赖性前列腺癌的治疗进展[J].中国老年学杂志,2011,31(5):903-906.
[7] Mottet N,Van Damme J,Loulidi S,et al.Intermittent hormonal therapy in the treatment of metastatic prostate cancer:a randomized trial[J].BJU Int,2012,110(9):1262-1269.
[8] 唐翌姝,张叔人.前列腺癌免疫治疗进展[J].中华微生物学和免疫学杂志,2011,(3):283-288.
[9] 郑军华,耿江.局部进展期前列腺癌的治疗进展[J].上海医学,2011,34(7):491-495.
[10]万克松,胡卫列,夏照明,等.手术去势间断联合抗雄激素药物治疗晚期前列腺癌临床疗效分析[J].实用医学杂志,2012,28(3):421-423.
[11]Ryan CJ,Molina A,Li J,et al.Serum androgens as prognostic biomarkers in castration-resistant prostate cancer:results from an analysis of a randomized phase III trial[J].J Clin Oncol,2013,31(22):2791-2798.
[12]胡萍,司同国,郭志,等.局部进展期前列腺癌的治疗进展[J].国际肿瘤学杂志,2013,40(3):225-228.
[13]Lunardi A,Ala U,Epping MT,et al.A co-clinical approach identifies mechanisms and potential therapies for androgen deprivation resistance in prostate cancer[J].Nat Genet,2013,45(7):747-755.
[14]孙颖浩.前列腺癌诊治进展[J].上海医学,2011,34(7):487-488.
[15]Heidenreich A,Bastian PJ,Bellmunt J,et al.EAU guidelines on prostate cancer.Part II:Treatment of advanced,relapsing,and castration-resistant prostate cancer[J].Eur Urol,2014,65(2):467-479.
[16]杨春光,王志华,胡志全.雄激素受体信号通路与去势抵抗性前列腺癌[J].现代泌尿生殖肿瘤杂志,2013,5(2):118-121.
[17]刘继红,陈瑞宝.前列腺癌免疫治疗研究进展[J].中华实验外科杂志,2012,29(12):2355-2356.
[18]Sciarra A,Abrahamsson PA,Brausi M,et al.Intermittent androgen-deprivation therapy in prostate cancer:a critical review focused on phase 3 trials[J].Eur Urol,2013,64(5):722-730.
[19]杨艳,陈莉.前列腺癌患者去势治疗后心理障碍的原因分析及干预策略[J].上海交通大学学报(医学版),2011,31(6):730-732.

