龙血素A和龙血素B的酶联免疫检测方法的建立
雷丽云,沈 洲,龙 蓉,陈 素,成 波,刘向明
(中南民族大学生物医学工程学院,湖北 武汉430074)
龙血竭又称国产血竭,是传统名贵中药,系百合科龙血树属剑叶龙血树 Dracaena cochinchinensis(Lour.)S.C.Chen的含脂木材经提取得到的树脂[1],具有活血散瘀、定痛止血等药理作用[1-2]。龙血素A(LA)和龙血素B (LB)为龙血竭的主要活性成分[3-4],LA对脑缺血有一定的保护作用[5],LB通过调制电压门控性钠通道和 TRPV1受体产生镇痛作用[6-7],LA和LB有望成为新的药物前体。
目前对LA和LB含量的检测只有高效液相色谱法[8-9],但昂贵的仪器设备以及对操作者的专业要求限制了其应用。酶联免疫检测法(ELISA)具有高通量、易操作、低成本等特点,在药物检测中已有广泛的应用[10],建立灵敏便捷的测定LA和LB的ELISA方法具有重要的现实意义。鉴于此,作者建立了LA和LB间接竞争酶联免疫吸附分析方法,并将其用于LA和LB的含量测定。
1 材料
1.1 动物
6周龄雌性BALB/c小鼠(18~22g),许可证号SCXK(鄂)2008-0005,湖北省实验动物研究中心。
1.2 药品与试剂
LA标准品(批号111660-200402)、血竭素高氯酸盐(批号110811-201105),中国食品药品检定研究院;LB(纯度>98%)、剑叶LA(纯度>98%)、剑叶LB(纯度>98%)、龙血竭、龙血竭总黄酮,广西中医药研究院卢文杰教授提供并鉴定;雨林牌龙血竭胶囊(批号110403),西双版纳雨林制药有限责任公司;云杉牌龙血竭胶囊(批号111032),云南云河药业有限公司;弗氏完全佐剂、弗氏不完全佐剂、二甲基亚砜、辣椒素(capsaicin)、辣椒平(capsazepine),Sigma公司;牛血清白蛋白(BSA)、鸡卵清蛋白(OVA),Biosharp公司;HRP标记羊抗小鼠IgG,天津三箭生物技术有限公司;TMB双组分显色液A、B,郑州博威嘉生物科技有限公司;96孔可拆酶标板,Corning公司;总蛋白定量测试盒(BCA法),南京建成生物工程研究所;其它试剂均为国产分析纯。
1.3 仪器
HH-CP-T型二氧化碳细胞培养箱,上海益恒实验仪器有限公司;101-1AB型电热鼓风干燥箱,天津泰斯特仪器有限公司;DZF-0B6020型真空干燥箱,上海龙跃仪器设备有限公司;UV-3200PC型扫描型紫外可见分光光度计,上海美谱达仪器有限公司;Thermo Labsystems Multiskan Ascent 354型酶标仪,赛默飞世尔科技公司。
2 方法与结果
2.1 半抗原的合成
采用溴乙酸法[11]给LA和LB加上游离羧基基团合成半抗原,合成路线如图1所示。
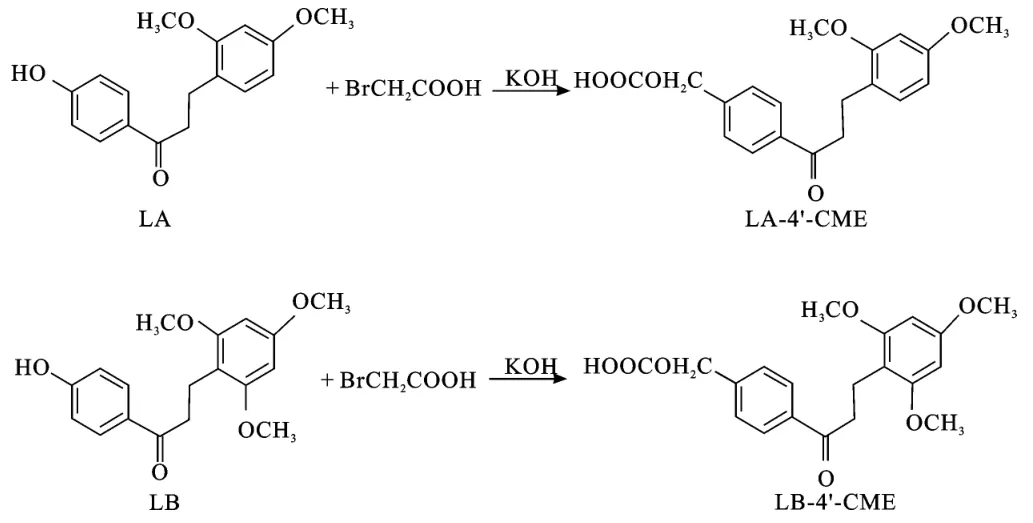
图1 半抗原的合成路线Fig.1 Synthetic route of haptens
取LA和LB各60mg,分别溶于2mL干燥的二甲基亚砜中,各加入KOH粉末0.3g,搅拌5min后,加入溴乙酸60mg,继续室温搅拌反应4h,加入冰水20mL,滴加2mol·L-1的HCl溶液酸化至溶液变为白色浑浊状,4℃过夜后,用G5砂芯漏斗过滤,沉淀物用冰蒸馏水洗涤,加丙酮收集沉淀,真空干燥得到半抗原:LA-4′-羧甲基醚(LA-4′-CME)和 LB-4′-羧甲基醚(LB-4′-CME)。
2.2 人工抗原的合成和鉴定
采用碳二亚胺法[12]将制备的半抗原与载体蛋白BSA偶联合成完全抗原,即免疫抗原:LA-BSA和LBBSA。同法合成包被抗原:LA-OVA和LB-OVA。用总蛋白定量测试盒(BCA法)测定各人工抗原的浓度:LABSA为2.2mg·mL-1、LB-BSA为4.8mg·mL-1、LAOVA 为2.3mg·mL-1、LB-OVA 为2.4mg·mL-1。在190~300nm波长间分别扫描LA、LB、载体蛋白和人工抗原的紫外吸收光谱,结果见图2。
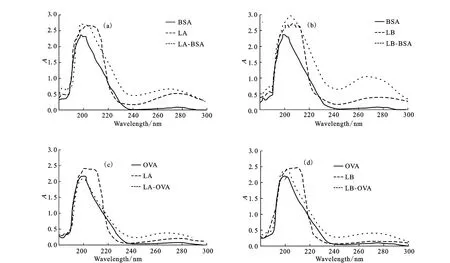
图2 LA、LB、载体蛋白和人工抗原的紫外吸收光谱Fig.2 UV Spectra of LA,LB,carrier proteins and artificial antigens
由图2可知,人工抗原的紫外吸收光谱与载体蛋白和对应LA或LB的紫外吸收光谱明显不同,且在波长275nm附近人工抗原的吸收值显著高于载体蛋白,可认为半抗原与载体蛋白已发生偶联。按文献[13]方法,根据样品浓度和紫外扫描的吸收值,估算各人工抗原的结合比:LA-BSA为41∶1、LA-OVA为15∶1、LB-BSA为76∶1、LB-OVA为17∶1。
2.3 动物免疫
用免疫抗原LA-BSA和LB-BSA各免疫3只6周龄BALB/c雌鼠,免疫时取等量免疫抗原与弗氏完全佐剂(初免)或弗氏不完全佐剂(第2次和第3次免疫)混合,充分乳化后,经背部皮下多点注射,每只注射免疫抗原25μg。第3次免疫后第10d摘小鼠眼球取血,同时取没有免疫的小鼠血作阴性对照。全血置37℃温箱1h,再置4℃冰箱过夜后于3 000r·min-1离心15min分离出血清,分装后于-20℃冻存。
2.4 间接竞争酶联免疫检测步骤
1)将包被抗原用0.05mol·L-1、pH 值为9.6的碳酸盐缓冲溶液稀释至一定浓度后包被96孔酶标板,每孔100μL,2~8℃过夜,洗涤液洗板3次后甩干。
2)每孔加封闭液(含1%脱脂奶粉的PBS)120 μL,37℃培养孵育2h,洗板3次后甩干,置30℃干燥箱中干燥3~4h,2~8℃密封存放,备用。
3)用PBST配制系列浓度的LA或LB标准品,包被酶标板孔内添加标准品或待测样品各50μL,各孔再添加一定稀释度的抗血清溶液50μL,37℃孵育30min,洗板5次,甩干。
4)每孔添加稀释5 000倍的HRP标记羊抗小鼠IgG溶液100μL,37℃孵育15min,洗板5次,甩干。
5)每孔依次添加显色液A和B各50μL,避光反应10min,再加入2mol·L-1硫酸50μL终止反应。
6)用酶标仪测量450nm和630nm双波长OD值,以(OD450-OD630)作为反应OD 值,绘制标准曲线,计算得到样品浓度。
2.5 抗血清效价的测定
包被抗原浓度为4μg·mL-1,将各动物抗血清稀释至不同浓度,检测空白样品OD值,以OD值在0.9~1.2之间的最大抗血清稀释度作为此抗血清的效价。经间接ELISA测试,抗LA血清效价最高达到8 000、抗LB血清效价最高达到30 000。
2.6 最佳包被浓度和抗血清稀释倍数的确定
采用棋盘滴定法。包被抗原浓度:1μg·mL-1、2 μg·mL-1、4μg·mL-1、8μg·mL-1,抗血清稀释倍数:500、1 000、1 500、2 000、4 000,测定 PBST 空白样品和0.5μg·mL-1样品的OD值,结果见表1。
选择空白样品OD值在1.0~1.4之间,且抑制率[抑制率=(OD空白-OD样品)/OD空白×100%]最大的包被抗原浓度和抗血清稀释倍数组合作为最适条件。由表1可得LA最适工作条件为:包被抗原浓度8μg·mL-1、抗血清稀释1 000倍;LB最适工作条件为:包被抗原浓度4μg·mL-1、抗血清稀释1 500倍。
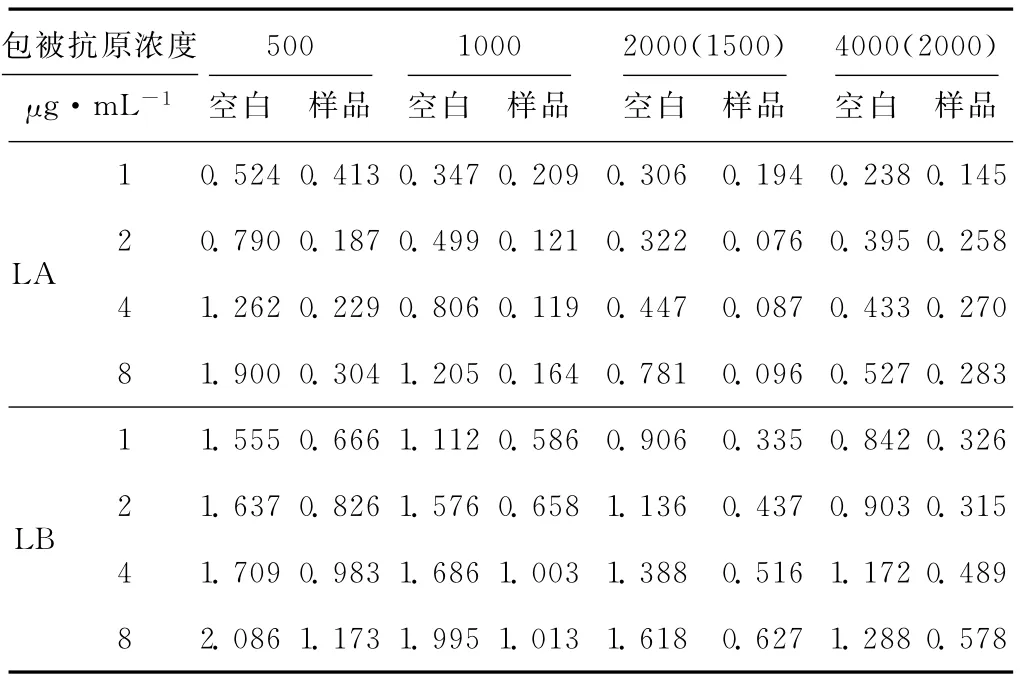
表1 LA和LB的棋盘滴定结果Tab.1 The result of checkerboard titration of LA and LB
2.7 ELISA标准曲线的绘制
LA和LB标准品浓度(ng·mL-1):0、10、20、40、80、160、320、640。在最佳包被浓度和最佳抗血清稀释倍数下进行间接竞争ELISA检测,以标准品浓度为横坐标、B/B0为纵坐标(B为反应OD 值,B0为0ng·mL-1标准品反应OD 值),用 GraphPad Prism5软件拟合四参数Logistic方程得到标准曲线(图3),LA和LB标准曲线的相关系数R2均大于0.99。经10次检测得到LA的IC50为(92.2±15.1)ng·mL-1,LB的IC50为(258.7±22.5)ng·mL-1。
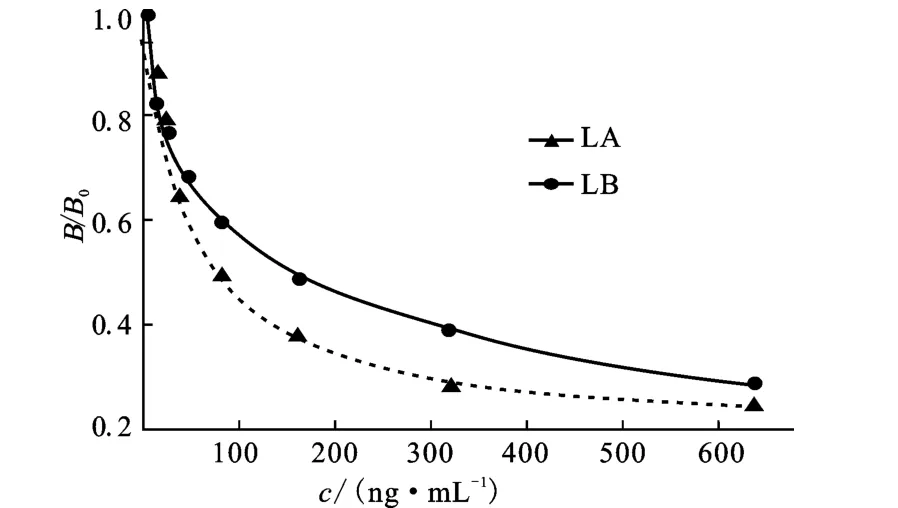
图3 LA和LB的ELISA标准曲线Fig.3 The ELISA standard curves of LA and LB
2.8 最低检测限测定
重复检测10次0ng·mL-1LA和LB标准品,通过标准曲线拟合计算测得的浓度,以其均值加上2倍的标准差(x+2sd)作为最低检测限。结果发现,LA的最低检测限为3.9ng·mL-1,LB的最低检测限为26.1ng·mL-1。
2.9 精密度评价
分3批次测定高、中、低浓度LA和LB样品,每批次各设10个复孔,结果见表2。
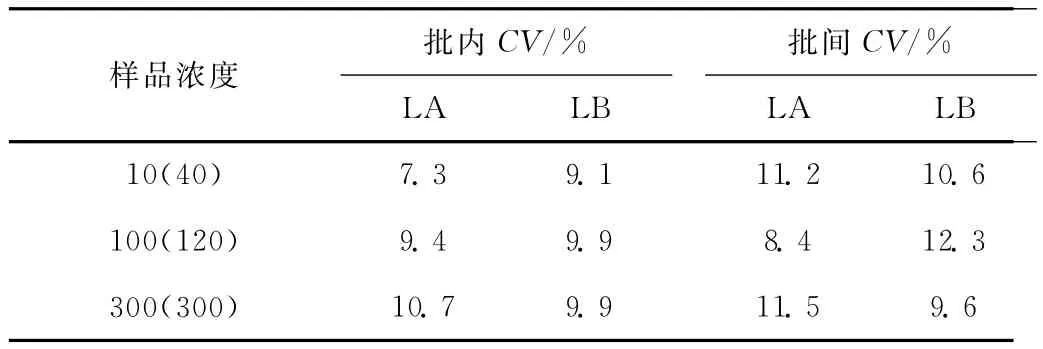
表2 批内精密度和批间精密度Tab.2 The intra and inter assay precisions
由表2可以看出:LA检测方法批内精密度CV≤10.7%、批间精密度CV≤11.5%;LB检测方法批内精密度CV≤9.9%、批间精密度CV≤12.3%。
2.10 准确度评价
分别测定2.9中的高、中、低浓度LA和LB样品,每个样品设10个复孔,计算回收率。结果发现:LA回收质量浓度均值分别为9.2ng·mL-1、110.8 ng·mL-1、244.7ng·mL-1,回收率分别为92.0%、110.8%、87.4%;LB回收质量浓度均值分别为44.6 ng·mL-1、131.7ng·mL-1、317.8ng·mL-1,回收率分别为111.5%、109.8%、113.5%。
2.11 交叉反应率检测
采用间接竞争ELISA方法检测LA和LB的6种结构或功能类似物的IC50,计算类似物的交叉反应率,如表3所示。

表3 交叉反应率/%Tab.3 The cross reactivity/%
由表3可以看出,LA与类似物、LB与类似物的交叉反应率最大分别为9.20%、3.64%,均不超过10%,表明检测特异性较好。
2.12 药物中LA和LB含量测定(表4)
由表4可以看出:LA和LB在4种龙血竭药物中的最大含量与最小含量分别相差4.05倍和3.57倍;龙血竭总黄酮和胶囊B中2种成分含量均达到龙血竭药物的2倍以上,说明龙血竭总黄酮进一步浓缩了龙血竭的药效成分;而胶囊A中LB含量虽然超过胶囊B,但其LA含量在4种药物中最低。

表4 药物中LA和LB的含量测定Tab.4 Determination of the contents of LA and LB in the drugs
4种药物中LB含量均达到国家药品标准的规定(≥0.40%)[14]。用 GraphPad Prism5软件进行2种成分含量相关性分析得到相关系数R为0.12、P>0.05,说明LA和LB含量不具有显著相关性,这可能是由于不同厂家采用的生产工艺或提取方法不同造成的。为更有效地控制龙血竭药物质量,可以在药品标准中增加对LA含量测定的要求。
3 结论
利用溴乙酸在强碱催化下与酚羟基发生亲核取代反应生成羧甲基醚作为半抗原,再用碳二亚胺法使其与载体蛋白偶联合成人工抗原。建立的LA和LB的酶联免疫检测方法具有较高的精密度、准确度和特异性,提供了检测LA和LB的便捷有效方法。
[1]GUPTA D,BLEAKLEY B,GUPTA P K.Dragon′s blood:Botany,chemistry and therapeutic uses[J].Journal of Ethnopharmacology,2008,115(3):361-380.
[2]何书平.血竭的药理研究[J].中国药房,2008,19(24):1912-1914.
[3]陈素,刘向明,郭敏.龙血竭抑制大鼠脊髓背角广动力范围神经元诱发放电的药效物质[J].中国科学:C辑,2008,38(12):1130-1142.
[4]刘芳,戴荣继,邓玉林,等.龙血竭化学成分研究进展[J].中国药房,2010,21(15):1437-1439.
[5]杨波,郭建恩,韩俊婷,等.龙血素A对大鼠局灶性脑缺血再灌注引起的脑损伤及机制探讨[J].中药新药与临床药理,2010,21(2):103-107.
[6]LIU X M,CHEN S,ZHANG Y X,et al.Modulation of dragon′s blood on tetrodotoxin-resistant sodium currents in dorsal root ganglion neurons and identification of its material basis for efficacy[J].Science in China Ser C Life Sciences,2006,49(3):274-285.
[7]WEI L S,CHEN S,HUANG X J,et al.Material basis for inhibition of dragon′s blood on capsaicin-induced TRPV1receptor currents in rat dorsal root ganglion neurons[J].European Journal of Pharmacology,2013,720(1-3):275-284.
[8]李忠琼,向东.HPLC测定龙血竭中龙血素A和龙血素B的含量[J].华西药学杂志,2005,20(4):348-349.
[9]刘立权.HPLC法同时测定龙血竭片中龙血素A、龙血素B和白藜芦醇的含量[J].中国药房,2013,24(36):3442-3444.
[10]王硕,张鸿雁,王俊平.酶联免疫吸附分析方法[M].北京:科学出版社,2011:1-15.
[11]刘珒,雷红涛,孙远明,等.雌二醇间接竞争酶联免疫吸附方法的建立[J].食品科学,2012,33(8):146-150.
[12]甘金华,邓薇,李进平,等.强力霉素人工抗原的合成与抗体制备[J].食品与生物技术学报,2011,30(2):316-320.
[13]汪晓莉.己烯雌酚人工抗原的制备和间接竞争ELISA检测方法的建立[D].武汉:湖北大学,2009.
[14]WS3-082(Z-016)-99(Z),龙血竭[S].

