1208例食管癌患者术后吻合口瘘风险因素分析
田 烨,周凌霄,任光国
(1.广西医科大学研究生学院,南宁 530000;2四川省肿瘤医院特殊检查科 成都 610000;3.四川省肿瘤医院胸科一病区,成都 610000)
目前,食管癌的治疗是以手术为主的综合治疗模式,而术后吻合口瘘是食管切除消化道重建术后最常见的严重并发症之一。术后吻合口瘘分为颈部吻合口瘘和胸内吻合口瘘,胸内吻合口瘘一旦发生,诊断、处理不及时,病死率较颈部吻合口瘘更高[1]。文献报道,食管癌术后吻合口瘘的发生率仍为8%~24%[2-4],病死率11.0%~35.7%。众所周知食管癌术后吻合口瘘的原因是多方面的,本文对四川省肿瘤医院2009年1月至2012年1月食管癌术后1208份临床资料进行食管癌术后吻合口瘘相关危险因素系统分析,提出食管癌术后发生吻合口瘘的高危因素,并分析原因。
1 资料与方法
1.1 一般资料 将2009年1月至2012年1月四川省肿瘤医院临床资料完整的食管癌患者共1208例,其中,男909例,女299例;年龄31~86岁,平均61.2岁。术后病理组织学检查证实食管鳞癌1101例,Ⅰ期71例,Ⅱ434例,Ⅲ期573例,Ⅳ期23例(术中发现);腺癌107例,Ⅰ期2例,Ⅱ期16例,Ⅲ期76例,Ⅳ例13例(术中发现)。
1.2 病理分期 依据2009年版UICC TNM分期。
1.3 食管癌术后吻合口瘘的诊断 (1)颈部吻合口瘘主要临床表现为颈部皮肤红肿、压痛、皮下气肿,并有腐臭脓液流出,拆开缝线观察可有食物残渣、胆汁等脓液流出,可伴或不伴有发热。颈部吻合口瘘位置表浅,易发现,根据患者临床症状、体征就可以诊断明确。(2)胸内吻合口瘘主要临床表现以中毒症状为主:持续高热、咳大量脓痰、剧烈胸痛、呼吸困难、术侧液气胸、部分患者诊断及治疗不及时出现中毒性休克。辅助检查:胸片可见包裹性积液或液气胸。泛影葡胺食管造影可证实。若无创检查未能发现后壁小瘘口或局限的瘘口,可行胸腔穿刺有浑浊液体或含有食物残渣及胃镜明确诊断。
1.4 统计学处理 采用SPSS16.0统计软件分析,单因素分析采用计数四格表资料的χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 食管癌术后吻合口瘘单因素分析 本组1208例患者,术后吻合口瘘105例,发生瘘的平均时间为(7±2)d,发生率8.7%(105/1208),死亡3例,病死率2.9%(3/105)。鳞癌1101例,腺癌107例。颈部吻合728例,82例术后吻合口瘘发生率11.3%(82/728),死亡1例,病死率1.2%(1/82);行胸内吻合480例,23例术后吻合口瘘,发生率4.8%(23/480),无1例死亡。经胸骨后途径颈部吻合245例,术后吻合口瘘48例,发生率19.6%(48/245),经食管床行颈部吻合及胸内吻合共983例,术后吻合口瘘57例,发生率5.9%(57/983),见表1。
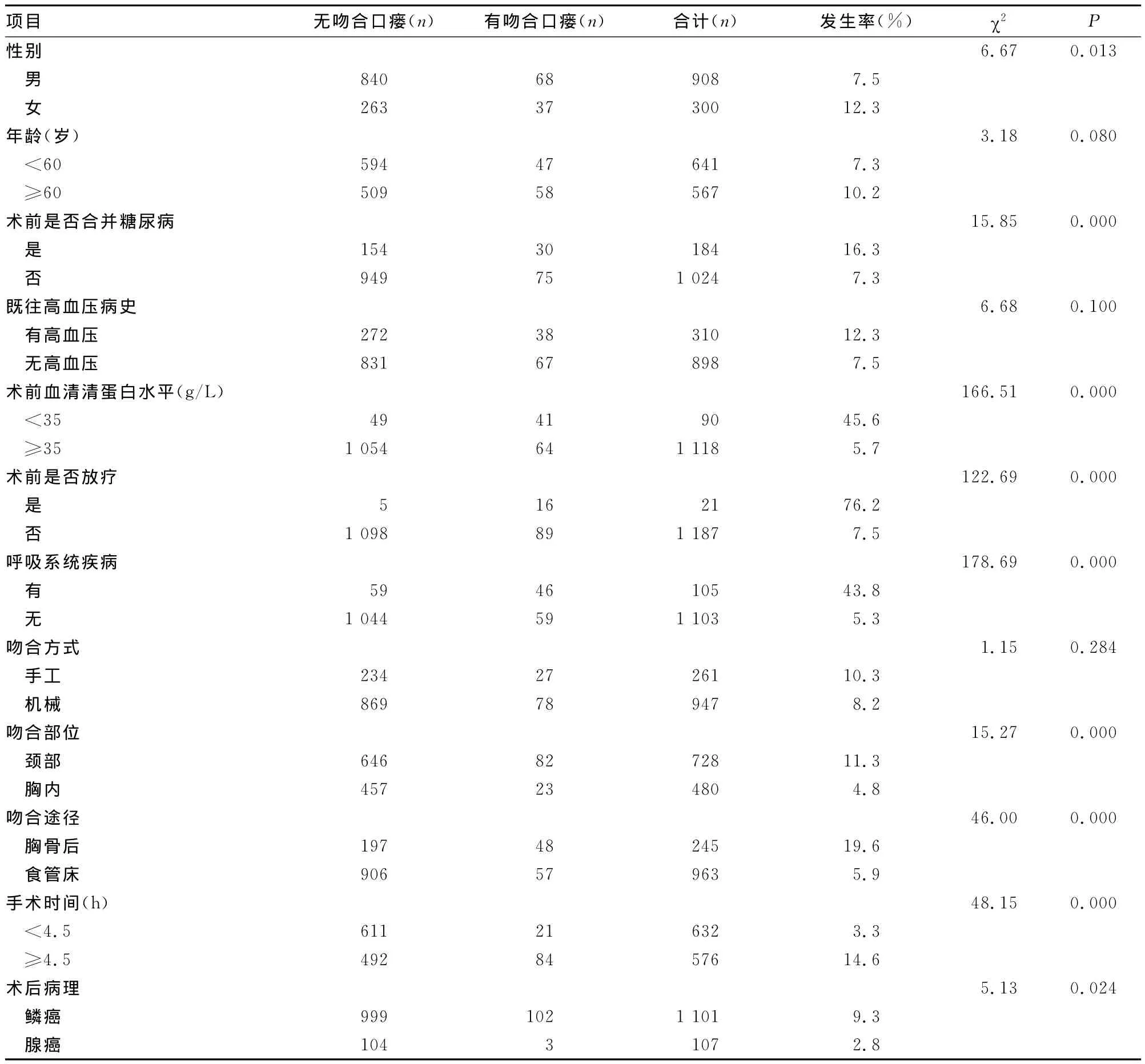
表1 食管癌术后吻合口瘘危险因素分析
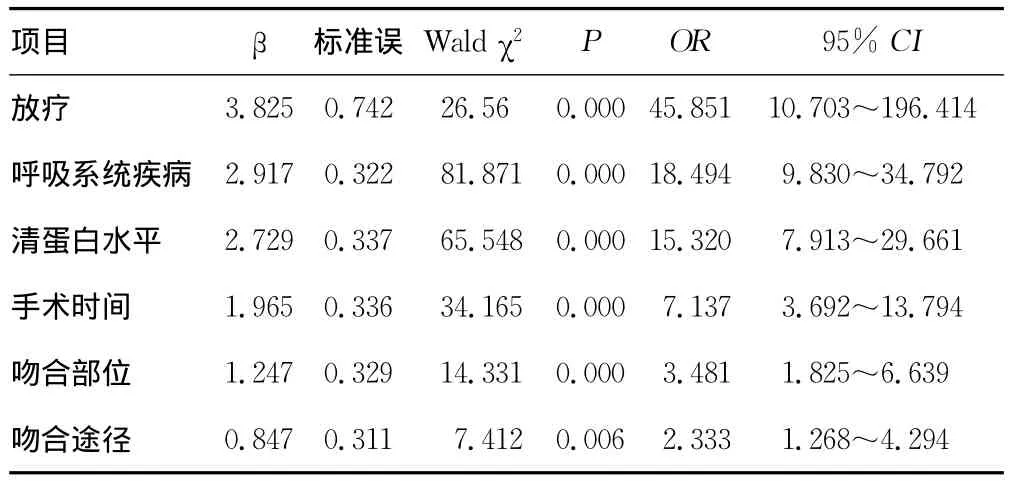
表2 食管癌术后吻合口瘘发生风险多因素Logistic回归分析结果
2.2 多因素分析结果 本组患者Logistic回归多因素分析结果显示,术前进行了放疗(P=0.000,OR=45.85)、呼吸系统基础疾病(P=0.000,OR=18.49)、术前血清清蛋白水平(P=0.000,OR=15.32)、手术时间大于或等于4.5h(P=0.000,OR=7.14)、吻合部位(P=0.000,OR=3.48)、管胃上行途径(经胸骨后或经食管床)(P<0.05,OR=2.33)等因素是食管癌术后吻合口瘘发生的独立危险因素,见表2。
3 讨 论
食管癌术后吻合口瘘是食管癌术后最严重的并发症之一。近年来随着医疗水平的提高,虽然食管癌术后吻合口瘘发生率及病死率都有所降低,但仍有发生,胸内吻合会发生严重的胸腔或纵隔的感染,处理不及时或不正确可能危及患者生命,而颈部吻合口瘘虽没有胸内吻合口瘘凶险,但一旦发生瘘就会延长患者的进食时间及住院时间,增加患者的痛苦和经济负担。因此分析食管癌术后吻合口瘘发生原因,有效预防和降低术后瘘口的发生仍然是胸外科医生所面临的重要课题[4-5]。
3.1 术前放疗对食管癌术后吻合口瘘的影响 一般而言食管癌术前放疗目的是缩小肿瘤体积及减少外侵,提高切除率。本组资料显示,术前接受放疗组患者较未接受术前放疗的患者术后发生吻合口瘘的发生率高(P<0.05),前者增加了术后吻合口瘘发生风险(OR=45.85)。术前放疗会导致放疗区域正常组织纤维化,不仅抑制了肿瘤细胞生长,而且也会抑制正常细胞的生长,从而使放疗区域的组织愈合能力下降,使术后吻合口瘘发生率增加。因此,术前放疗方式的选择可能影响食管癌术后吻合口瘘的发生。笔者经验认为,对要行术前放疗的患者应与放疗科医生协商,避开手术重要吻合的部位,放疗野的上限控制在肿瘤上缘的2cm。术前放疗总量应控制在4周20次,每次40Gy,放疗结束2周后手术较为适宜。
3.2 术前合并呼吸系统疾病对食管癌术后吻合口瘘的影响本组资料显示,术前有呼吸系统疾病与无呼吸系统疾病发生吻合口瘘比较,差异有统计学意义(P<0.05),术前有呼吸系统疾病为食管癌术后吻合口瘘的风险因素(OR=18.49)。笔者认为,术后血气分析异常,术前肺功能有中度以上损害的患者,术后往往容易发生肺部感染,如果术后咳嗽、咳痰无力,痰排出不顺利,就会伴有肺不张,加重肺部感染,造成机体的器官和组织或轻或重的缺氧,影响吻合口组织愈合;肺部感染伴咳痰无力又未做气管切开的患者,往往在吸痰时误入食管,如吻合口在颈部就会造成损伤。部分患者则由于肺部继发感染,术后痰多而用力咳嗽排痰,剧烈的咳嗽会增加吻合口的压力,对吻合口造成冲击;咳嗽时颈部的伸展也会对颈部吻合口有所牵拉。
3.3 血清清蛋白对食管癌术后吻合口瘘的影响 本组患者资料显示,术前清蛋白小于35g/L较血清清蛋白正常组吻合口瘘有较高发生率(P<0.05),为食管癌术后吻合口瘘的风险因素(OR=15.32)。众所周知,术前食管癌患者大多有脱水及血液浓缩情况,术后随着脱水的纠正血液处于相对稀释状态,如果术前患者就有清蛋白的降低,术后将进一步的加重,加之外科手术尤其是大手术后人体蛋白代谢均处于负氮平衡状态,若此时外源性的蛋白未得到及时足够补充,血浆蛋白将会降到相当低的水平(约25g/L),术后给予肠内营养时患者出现腹泻症状,因为低蛋白血症患者的肠壁水肿,肠内营养的营养液很难吸收利用,吻合口也可能因为营养的缺乏而水肿出现瘘。Vincent等[6]认为,患者术后血清清蛋白随治疗回升到30g/L以上时,患者腹泻症状逐渐消失,肠道吸收功能逐渐恢复。由于患者胃肠道对肠内营养液的吸收和利用增强,患者营养状况因此逐渐改善,吻合口瘘也可能会因为患者的营养状况改善,瘘口水肿减轻,而逐步愈合。笔者认为,对于术前就有低蛋白血症的患者,应在术前尽可能加以纠正;对于术前血清清蛋白在正常范围内,术后随着脱水的纠正和负氮平衡所发生的术后早期低蛋白血症患者,应静脉输入清蛋白,给予肠内营养,使患者低蛋白血症在短期内得以纠正。
3.4 手术时间对食管癌术后吻合口瘘的影响 本组资料显示,手术时间大于或等于4.5h组与手术时间小于4.5h组比较,差异有统计学意义(P<0.05),手术时间的长短是术后吻合口瘘风险因素(OR=7.14)。手术时间长多数情况发生在胸腔有严重粘连、病期较晚、手术特别困难时。手术时间的延长相应增加了术野暴露时间,增加了对肺组织反复的挤压和搓揉的次数,在胃游离困难时增加了对胃壁的牵拉和搓揉,胃壁的血管网由于术中过多的搓揉、牵拉而损伤,造成吻合口局部组织血液供应障碍和对缺氧的耐受性明显降低,从而引发吻合口瘘。
3.5 食管癌手术吻合部位对吻合口瘘的影响 本组资料结果显示,行颈部吻合会增加食管癌术后吻合口瘘发生风险(OR=3.84),该结果与目前Biere等[7]及国内多数笔者的观点相同。目前,国内食管癌规范化诊疗指南指出颈部吻合口瘘发生率为10%~20%,此回顾性分析颈部吻合口瘘发生率为11.3%,在发生率范围中偏低。笔者认为,手术的方式及围手术期的处理是极其重要的。尽管本研究颈部吻合口瘘发生率相对较低,然而颈部吻合会增加术后吻合口瘘风险,考虑颈部易发生术后瘘的主要原因为管胃要通过狭小的胸廓入口到达颈部行吻合,与胸内吻合相比较,理论上更容易造成管胃的缺血,导致吻合口瘘的发生[7-8]。
3.6 颈部吻合管胃上行途径(经食管床或胸骨后)对吻合口瘘的影响 国外资料显示,胸骨后途径颈部吻合吻合口瘘的发生率为2.1%~70.0%[9-10],本组发生率为 19.6%,且明显增加了术后吻合口瘘发生风险(OR=2.33,P<0.05)。国内外许多研究认为,经胸骨后途径较食管床途径长,在腹腔游离胃不够充分或患者胃短小情况下就会增加吻合口张力;由于胸骨后的纵隔间隙相对狭小,正常情况下无其他器官经此路过,当全胃或较大的管状胃经此间隙上提至颈部时胃在胸骨后就会受到纵隔内器官前后挤压如胸骨、心脏、气管的挤压,颈部肌群在胸廓上口的胸骨柄有多条肌肉附着,当在胸廓上口解剖和扩张不够充分时也会对胃形成挤压。食管残端游离过长、吻合口张力过大和胃或较大的管胃受挤压也可能造成胸骨后颈部吻合吻合口瘘发生。其次由于经胸骨后路径颈部吻合需要食管残端有足够的长度以降低吻合后吻合口的张力,在高位食管癌切除时很难保证有足够的安全距离,容易造成吻合的断端癌残留,这也是引起高位食管癌术后吻合口瘘的又一个因素。因此,这些因素有可能增加颈部吻合吻合口瘘发生的风险。然而,目前随机对照试验及Meta分析结果并未得出胸骨后路径颈部吻合会增加食管癌术后吻合口瘘的风险,这与Khiria等[11]及Urschel等[12]的研究一致,并且Chen等[13]对比解剖学研究的结果认为胸骨后途径行食管吻合的距离短于食管床途径,可能对吻合口的张力影响较小。
3.7 食管癌手术吻合方式对吻合口瘘的影响 本研究结果显示,吻合方式不是术后吻合口瘘发生风险因素。笔者认为,无论选择手工吻合还是机械吻合,吻合的关键是食管胃黏膜的良好对合、缝针疏密适宜、线结的松紧适度、良好的吻合口血供及在无张力下吻合。
[1]中国抗癌协会食管癌专业委员会.食管癌规范化诊治指南[M].北京:中国协和医科大学出版社,2011:125-131.
[2]刘奎,魏煜程.食管吻合口瘘诊疗进展[J].医学综述,2012,18(8):1191-1104.
[3]Hu Z,Yin R,Fan X,et al.Treatment of intrathoracic anastomotic leak by nose fistula tube drainage after esophagectomy for cancer[J].Dis Esophagus,2011,24(2):100-107.
[4]Kim RH,Takabe K.Methods of esophagogastric anastomoses following esophagectomy for cancer:a systematic review[J].J Surg Oncol,2010,101(6):527-533.
[5]Tabatabai A,Hashemi M,Mohajeri G,et al.Incidence and risk factors predisposing anastomotic leak after transhiatal esophagectomy[J].Ann Thorac Med,2009,4(4):197-200.
[6]Vincent JL,Dubois MJ,Navickis RJ,et al.Hypoalbuminemia in acute illness:is there a rationale for intervention[J].Ann Surg,2003,237(3):319-334.
[7]Biere S,Maas K,Cuesta M,et al.Cervical or thoracic anastomosis after esophagectomy for cancer:a systematic re-view and meta-analysis[J].Digestive surgery,2011,28(1):29-33.
[8]Reavis KM.The esophageal anastomosis:how improving blood supply affects leak rate[J].J Gastrointest Surg,2009,13(9):1558-1560.
[9]Orringer MB,Marshall B,Chang AC,et al.Two thousand transhiatal esophagectomies:changing trends,lessons learned[J].Ann Surg,2007,246(3):363-367.
[10]Chan ML,Hsieh CC,Wang CW,et al.Reconstruction after esophagectomy for esophageal cancer:Retrosternal or posterior mediastinal route[J].J Chin Med Assoc,2011,74(11):505-510.
[11]Khiria LS,Pal S,Peush S,et al.Impact on outcome of the route of conduit transposition after transhiatal oesophagectomy:a randomized controlled trial[J].Dig Liver Dis,2009,40(10):711-716.
[12]Urschel JD,Urschel DM,Miller JD,et al.A meta-analysis of randomized controlled trials of route of reconstruction after esophagectomy for cancer[J].Am J Surg,2001,182(5):470-475.
[13]Chen H,Lu JJ,Zhou J,et al.Anterior versus posterior routes of reconstruction after esophagectomy:a comparative anatomic study[J].Ann Thorac Surg,2009,87(2):400-404.

