树鼩呼肠孤病毒RT-nPCR检测方法的建立及初步应用
李晓飞,殷安国,张 媛,罗 军,孙晓梅,代解杰
(中国医学科学院北京协和医学院医学生物学研究所树鼩种质资源中心,云南省重大传染病疫苗研发重点实验室,昆明 650118)
哺乳动物呼肠孤病毒(mammalian orthoreovirus,MRV)在分类学上属呼肠孤病毒科(Reoviridae)正呼肠孤病毒属(Orthoreovirus)第一亚群[1]。基因组为10个节段的双链RNA,分为3个大片段(L1~L3)、3个中片段(M1~M3)及4个小片段(S1~S4)。根据红细胞凝集活性MRV分为三种血清型及标准株,分别为:血清1型(T1L, Long)、血清2型(T2J, Jone)和血清3型(T3D, Dearing; T3A, Abney)[2]。MRV具有广泛的宿主谱,牛、羊、马、猪、狗、猫、小鼠、蝙蝠、人及非人灵长类体内都已报道分离到呼肠孤病毒[3-5]。呼肠孤病毒与肺部感染、神经系统感染、消化系统感染密切相关[6]。Reo-3感染可致小鼠呼吸窘迫综合症,肺水肿、肺泡出血、肺纤维化和致死性间质性肺炎等症状,最后显现病毒血症及神经系统感染所致脑炎心肌炎等[7],Reo-3型是国标要求SPF级实验小鼠必检的项目之一。
近年来,树鼩(tree shrews)由于其独特的生物学特性和分类学地位正在被培育成为实验动物新品种,研究证实它在感染性疾病动物模型方面独具价值。中国医学科学院医学生物学研究所树鼩种质资源中心目前正在开展实验树鼩饲养繁殖和标准化研究工作。
2011~2012年期间,本中心先后从同一地区野外引进了三批树鼩,少数树鼩出现精神萎靡、眼角膜及鼻分泌物增多,足爪皮肤溃烂脱皮等类似病毒性感染的临床症状。为探明何种感染病原体,我们对死亡动物粪便中的未知病毒进行分离鉴定,确认得到三株呼肠孤病毒毒株,分别命名为TRV1、TRV2、TRV3。鉴于树鼩对呼肠孤病毒易感,且在抵抗力差的情况下可出现致死性后果,需建立相应的灵敏快速的检测方法,作为实验树鼩种群病原微生物质量控制的有效手段。
1 材料和方法
1.1 病毒及样品
呼肠孤病毒III型(Reo3)由中国食品药品检定研究院实验动物资源研究所赠予;轮状(RV)病毒Wa株,甲肝(HAV)病毒,单纯疱疹(HSV-1)病毒由中国医学科学院医学生物学研究所保存;三株树鼩呼肠孤病毒TRV1、TRV2、TRV3来源于三只动物(表1);25只树鼩病毒感染疑似病例的粪便处理样本。
1.2 设备及试剂
美国产Forma恒温培养箱,日本产Nikon显微镜,Hitachi透射电镜,美国产Bio-Rad梯度PCR仪、Bio-Rad电泳仪系统、Bio-Rad凝胶成像系统。 病毒DNA/RNA提取试剂盒购自Axygen公司;逆转录试剂盒购自Fermentas;PCR试剂盒购自Thermo公司;胶回收试剂盒购自TakaRa公司。
1.3 病毒分离及电镜观察
采集发病树鼩粪便(1~2)g,用磷酸盐缓冲液(PBS) 制成10%~20%粪便悬液,5 000 r/min离心30 min,取上清液经0.22 μm微孔滤膜过滤,滤液加入终浓度10%的双抗(青霉素和链霉素),按1/10(V/V)接种比接种于铺满80%~90%的VERO单层细胞,37℃吸附30 min,弃接种液,立即加入2%胎牛血清MEM维持液,37℃,5% CO2培养并观察CPE,继续盲传并收集病毒液,反复冻融三次置-80℃保存待鉴定。

表1 从不同批次野外引入树鼩中分离到的MRV
收集的病毒液于4 500 r/min离心30 min,取上清液,经40%、20%、10%蔗糖密度梯度离心(35 000 r/min,2.5 h,4℃),以100 μL PBS 4℃过夜溶解,次日取20 μL经1%磷钨酸常规染色,于Hitachi透射电镜下观察病毒形态。
1.4 病毒RNA提取
对正常VERO细胞,TRV1、TRV2、TRV3感染的VERO细胞上清液,呼肠孤病毒III型(Reo3),轮状(RV)病毒Wa株,甲肝(HAV)病毒,单纯疱疹(HSV-1)病毒以及25只树鼩病毒感染疑似病例的粪便处理样本按照AxyPrep体液病毒DNA/RNA小量试剂盒操作步骤提取核酸。提取后的RNA立即反转录合成cDNA,剩余的RNA冻存于-80℃冰箱备用。
1.5 聚丙烯酰胺凝胶电泳鉴定
将TRV1、TRV2、TRV3三株病毒细胞培养上清液中提取的病毒RNA按9∶1与10× loading buffer 混匀后经核酸聚丙烯凝胶电泳(积层胶3.5%,分离胶10%),每孔上样15 μL,90 V恒压电泳9 h,硝酸银染色观察[8]。
1.6 反转录巢式PCR
1.6.1 引物设计:哺乳动物呼肠孤病毒(MRV)的L1基因片段编码呼肠孤病毒内衣壳蛋白λ3,λ3具有RNA依赖的RNA聚合酶活性,在呼肠孤病毒的整个基因组中是最保守的[9]。分析已报道的MRV的L1基因的保守区域,用Primer Premier 5.0软件设计巢式引物见表2,依次使用两对引物进行巢式PCR扩增后的目的片段为513 bp。引物由宝生物工程(大连)有限公司合成。
1.6.2 反转录合成cDNA:参照Fermentas RevertAidTMFirst Strand cDNA Synthesis Kit使用说明书确定反转录体系为:病毒RNA 8 μL、 Random Hexamer Primer 1 μL、nuclease-free water 3 μL、5× reaction buffer 4 μL、RiboLock RNase inhibitor (20 U/μL) 1 μL、10 mM dNTP Mix 2 μL、RevertAid M-MuLV RT (200 U/μL) 1 μL。反应条件为:25℃ 5 min,42℃孵育60 min,70℃ 5 min获得cDNA。
1.6.3 巢式PCR:对巢式PCR反应体系的引物、模板及反应体系的退火温度及循环次数等进行优化,确定最佳反应模式。第一次PCR反应体系:反转录cDNA 模板3 μL、DreamTaq Green PCR Master Mix 12.5 μL、nuclease-free water 7.5 μL,以外围引物TRV-F1 (5 μM)、TRV-R1 (5 μM)各1 μL进行巢式第一次PCR扩增。扩增条件:95℃变性5 min;95℃ 30 sec,50℃ 30 sec,72℃ 2 min,35个循环;72℃延伸10 min。取第一次PCR产物3 μL,以内围引物TRV-F2 (5 μM)、TRV-R2 (5 μM)各1 μL 进行第二次PCR扩增,反应体系及反应条件同第一次PCR扩增。利用此RT-nPCR方法对正常VERO细胞、TRV1、TRV2、TRV3感染的细胞上清液进行检测。
1.6.4 RT-nPCR产物的检测:取10 μL扩增产物于1.5%琼脂糖凝胶(含0.5 μg/mL EB)进行电泳检测,在1× TAE电泳缓冲液中,90 V电泳40 min,于凝胶成像系统紫外灯下观察并切下PCR产物条带,使用胶回收试剂盒纯化PCR产物,由宝生物(大连)工程公司测序,测序结果于NCBI BLAST 进行序列相似性和同源性分析,以确定RT-nPCR检测的准确性。
1.6.5 特异性的试验:使用巢式引物TRV-F1,R1;TRV-F2,R2分别以三株树鼩呼肠孤病毒(TRV1、TRV2、TRV3),呼肠孤病毒III型(Reo3),轮状(RV)病毒Wa株,甲肝(HAV)病毒RNA的cDNA及单纯疱疹(HSV-1)病毒的DNA为模板,用所建立的RT-nPCR方法进行扩增,扩增产物于1.5%琼脂糖凝胶电泳检测。
1.6.6 敏感性的试验:将起始浓度为10.2 ng/μL的RNA样本做倍比稀释,分设100、10-1到10-10浓度梯度进行RT-nPCR扩增,扩增产物于1.5%琼脂糖凝胶电泳检测,判断可扩增的最小RNA模板浓度。

表2 用于扩增L1基因的巢式引物序列及位置
1.6.7 初步应用:对25只树鼩病毒感染疑似病例的粪便处理样本(编号:1 ~25号,其中1~15号为存活动物组,16~25号样本为死亡动物组)提取RNA,进行RT-nPCR扩增,扩增产物于1.5%琼脂糖凝胶电泳检测。
2 结果
2.1 病毒的细胞病变、电镜形态及聚丙烯酰胺凝胶电泳图谱
接种病毒后的VERO细胞于12 h即出现明显的细胞病变(cytopathic effects,CPE),继续盲传第2~6代均出现稳定的CPE,细胞颗粒感增强、圆缩、聚集最终脱落;病毒液浓缩纯化后透视电镜下观察,可见病毒为球形颗粒,完整直径约70 nm,双层衣壳,为呼肠孤病毒的典型形态特征见图1;提取三株TRV RNA进行聚丙烯凝胶电泳鉴定,结果显示三株病毒均由10个基因片段组成,按分子量大小可分为大(L1、L2、L3)、中(M1、M2、M3)和小(S1、S2、S3,S4)三个类群,呈现典型的3:3:4排列。各分离株的PAGE电泳图谱特征见图2。
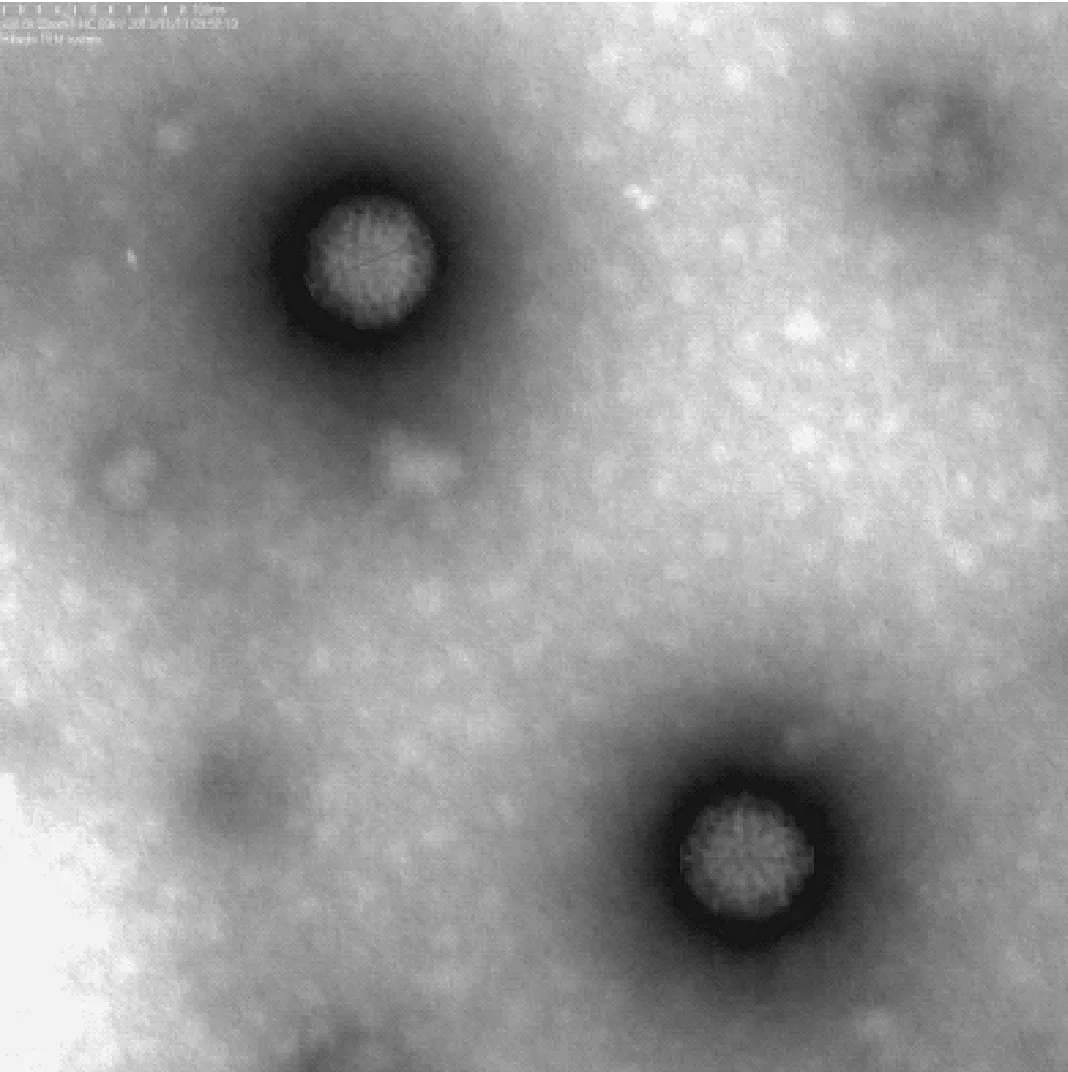
图1 树鼩呼肠孤病毒株TRV2透视电镜观察
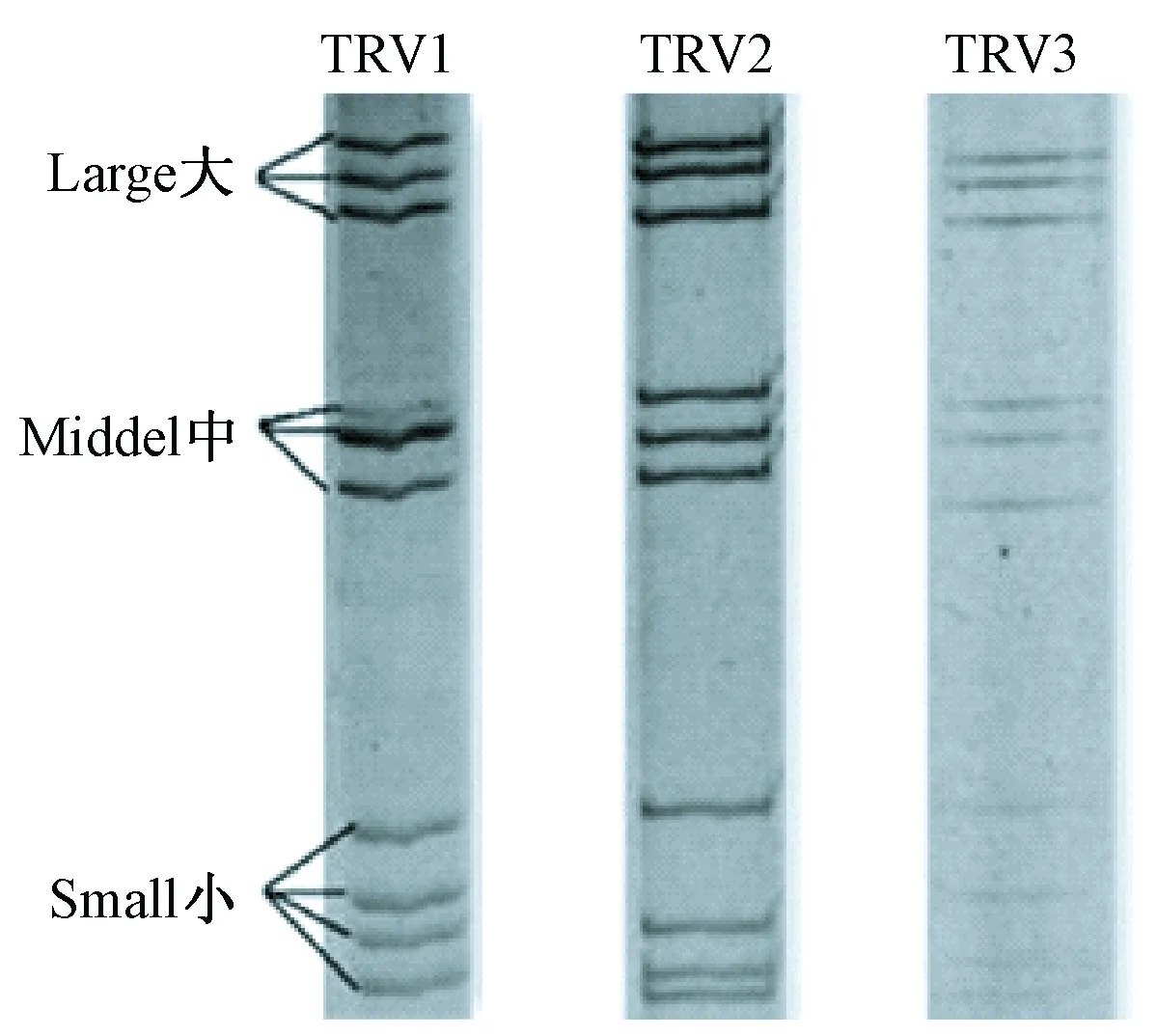
图2 三株呼肠孤病毒PAGE电泳图谱
2.2 RT-nPCR产物的检测
巢式引物TRV-F1,R1;TRV-F2,R2对三株树鼩呼肠孤病毒(TRV1、TRV2、TRV3)扩增均得到长度为513 bp的特异性目的条带;VERO细胞阴性对照未扩增到特异性目的条带(图3)。目的片段纯化后测序,测序结果经BLAST分析,TRV1与GenBank中MRV分离株T3/Bat/Germany/342/08株和SI-MRV01株的序列同源性最高,为96%;TRV2与MRV分离株Ndelle virus株的序列同源性为90%;TRV3与MRV分离株MRV-HLJ/2007株的序列同源性为94%。

M: 2 000 bp DNA marker;1:VERO细胞对照;2:TRV1;3:TRV2; 4: TRV3
2.3 特异性试验
巢式引物TRV-F1,R1;TRV-F2,R2在以TRV1、TRV2、TRV3及呼肠孤病毒III型(Reo3)为模板进行扩增有明显目的条带出现,轮状(RV)病毒Wa株,甲肝(HAV)病毒及单纯疱疹(HSV-1)均无目的条带(图4)。

M:2000bp DNA marker;1:呼肠孤病毒Ⅲ型;2:轮状(RV)病毒Wa株;3:甲肝(HAV)病毒;4:单纯疱疹(HSV-1);5:TRV1;6:TRV2;7:TRV3

M: 2000 bp DNA marker;1:RNA原液;2:10-1稀释;3:10-2稀释;4:10-3稀释;5:10-4稀释;6:10-5稀释;7:10-6稀释;8:10-7稀释;9:10-8稀释;10:10-9稀释。

M: 2000 bp DNA marker;1~15:存活动物组;16~25号:死亡动物组
2.4 敏感性试验
巢式引物TRV-F1,R1;TRV-F2,R2在起始浓度为10.2 ng/μL的 TRV2 RNA模板稀释至10-4时仍可见清晰的目的条带(图5),即所能检测到的最小RNA模板浓度至少能达到0.01 pg/μL。
2.5 初步应用
应用建立的RT-nPCR方法对25只树鼩病毒感染疑似病例的粪便处理样本的检测结果如下:存活动物组(1~15号)中2、7、10、12号粪便样本及死亡动物组(15~25号)的15~25号粪便样本均扩增出513 bp的目的片段。 死亡动物(15~25号)中TRV阳性携带率为100%;存活动物(1~15号)中TRV阳性携带率为27%。(图6)
3 讨论
我中心在实验树鼩种群建立过程中,先后三次从昆明郊区同一地域野外引进的部分树鼩中发现了病毒感染的临床症状,通过病毒分离培养鉴定,发现所分离的TRV1、TRV2和TRV3病毒株具有呼肠孤病毒独特的CPE和典型的电镜形态,独特的3:3:4基因组带型,且三株病毒的L1基因序列与哺乳动物呼肠孤病毒有较高的序列同源性。采用建立的RT-nRCR方法对25只野外来源树鼩疑似病例样本进行检测,发现具有较高的感染率,说明MRV的宿主范围确实广泛,建议作为树鼩微生物质量控制必须考虑的指标之一。
目前已建立的呼肠孤病毒检测方法有:ELISA检测[10]、免疫荧光检测[11]、电镜法(DEM)、聚丙烯酰胺凝胶电泳(PAGE)、PCR[12,13]等。电镜法需扩增病毒、纯化浓缩、超速离心,耗时耗力;PAGE法需谨慎防止RNA酶的降解影响,灵敏度有限,易出现假阴性;PCR方法具简单、快捷、灵敏的优点,我们曾尝试使用Leary TR[14]报道的引物rv5m和rv4m对所分离的3株TRVs进行扩增,但未获得理想结果。因此改用针对L1基因保守区域设计巢式引物,并建立RT-nPCR的方法。该方法对Reo3和3株TRVs通用,且不针对同为呼肠孤病毒科的轮状病毒、单链RNA的甲肝病毒和双链DNA的单纯疱疹病毒进行扩增,特异性好;最低RNA模板检测浓度为0.01pg/μL,不仅可检测到经细胞培养增殖后的病毒,亦可直接检测到动物粪便中的病毒RNA。当前我们正在研究TRV对树鼩的致病性及致病机理,以进一步揭示TRV的感染机制,此RT-nPCR方法可作为TRV检测的有效手段。此外,我们提议利用此方法对野外引进的树鼩在隔离检疫期间进行TRV的筛查,这对树鼩TRV进行微生物控制有重要意义。
分析三株呼肠孤病毒TRV1、TRV2、TRV3基因组的聚丙烯酰胺凝胶电泳的带型,不难发现三株病毒的基因组10个片段分布特征有区别,M片段和S片段差异较大。另外,经RT-nPCR得到的L1基因的513 bp片段序列也有差异。推导不同时间来源的三株病毒具有一定遗传差异,这对今后开展树鼩呼肠孤病毒的分子流行病学研究提供了基础。至于TRV1、TRV2、TRV3之间的变异关系或与已报道的哺乳动物呼肠孤病毒(MRV)的亲缘性关系,有赖于今后全基因序列的测定结果作进一步的研究。
参考文献:
[1] 张云,刘明,欧阳岁东, 等. 呼肠孤病毒及其分类学依据研究进展 [J]. 动物医学进展,2004, 25(6):46-49.
[2] 孙颖,辛绍杰,貌盼勇. 呼肠病毒的生物学特征及其致病性 [J]. 国外医学. 流行病学传染病学分册,2005, 32(3):145-148.
[3] Tyler KL. Mammalian reoviruses.In: Knipe DM and Howley PM (eds): Fields Virology [M]. 4th edition. Philadelphia, Lippincott-Raven, 2001,1729-1745.
[4] Kohl C, Lesnik R, Brinkmann A, et al. Isolation and characterization of three mammalian orthoreoviruses from European bats [J]. PloS One, 2012, 7(8):e43106.
[5] Hrdy DB, Rosen L, Fields BN. Polymorphism of the migration of double-stranded RNA genome segments of reovirus isolates from humans, cattle, and mice [J]. Jf Virol, 1979, 31(1):104-111.
[6] 左庭婷, 端青. 呼肠病毒感染实验动物致病性的研究进展 [J]. 军事医学科学院院刊, 2008, 32(4):389-391.
[7] Gauvin L, Bennett S, Liu H, et al. Respiratory infection of mice with mammalian reoviruses causes systemic infection with age and strain dependent pneumonia and encephalitis [J]. Virol J, 2013, 10:67.
[8] 徐娟, 黄晓燕, 李晓飞, 等. 树鼩呼肠孤病毒的分离鉴定 [J]. 动物学研究, 2013, 34(2):116-120.
[9] Leary TR, Erker JC, Chalmers ML, et al. Detection of mammalian reovirus RNA by using reverse transcription-PCR: sequence diversity within the λ3-encoding L1 gene [J]. J Clini Microbiol, 2001, 1368-1375.
[10] 侯丽波, 佟巍, 谢军芳, 等. 小鼠呼肠孤病毒III型标准化血清制备及ELISA检测方法的建立 [J]. 中国比较医学杂志, 2010, 20(8):60-64.
[11] 王吉, 卫礼, 岳秉飞, 等. 呼肠孤病毒III型免疫荧光检测方法的建立及初步应用 [J]. 中国比较医学杂志, 2011, 21(8):1-4.
[12] 冉旭华. 犬蝠源呼肠孤病毒的分离鉴定及其生物学特性的研究 [D]. 中国农业科学院研究生院哈尔滨兽医研究所, 2006:1-106.
[13] 王吉, 卫礼, 贺争鸣, 等. 呼肠孤病毒III型(Reo3)RT-PCR检测方法的建立 [J]. 中国比较医学杂志, 2012, 22(9):46-50.
[14] Leary TR, Erker JC, Chalmers ML, et al. Detection of reovirus transcription-polymerase chain reaction using primers corresponding to conserved regions of the viral L1 genome segment [J]. J Virol Methods, 2001, 104(2):161-165.

