长爪沙鼠动情周期血清激素水平与卵泡发育的动态研究
肖 丽,陈立青,戴方伟,宋晓明,郭红刚,卢领群,吕 宇,萨晓婴
(1. 浙江省医学科学院 实验动物与安全性评价重点实验室, 杭州 310013;2. 杭州师范大学实验动物中心, 杭州 310036)
长爪沙鼠作为实验动物应用于医学领域已有较长时间,其独特的解剖学、生理学和行为学等特征使其在微生物感染、营养代谢病、脑血管疾病、自发性肿瘤和慢性铅中毒等诸多研究中应用广泛[1]。更深入细致的生理学特性研究将有助于拓展该动物在人类疾病实验动物模型研究中发挥更大的应用价值,也有助于加快长爪沙鼠的实验动物化进程。目前,有关长爪沙鼠生殖特性的文献已有报道[2,3],但仅包括性成熟时间、产仔数量等概况,关于长爪沙鼠动情周期血清激素变化和卵泡发育的研究,国内未见报道,而陆续开展的长爪沙鼠生殖生理、胚胎移植等研究亟需上述背景信息。基于此,本文对长爪沙鼠动情周期各阶段卵巢形态、卵泡数量和血清激素水平等进行了观察测定,以期逐步揭示其生殖机理,为长爪沙鼠的进一步应用提供基础参数。
1 材料和方法
1.1 实验动物
未交配成年清洁级雌性长爪沙鼠,4月龄,50 g~60 g,由浙江省实验动物中心提供。饲养于12 h光照和12 h黑暗的环境中,温度20 ℃~26℃,湿度40%~70%,有通风系统保持室内空气流畅,动物自由摄食和饮水。生产许可证号为SCXK(浙)2008-0034,使用许可证号为SYXK(浙)2008-0114,并按实验动物使用的3R原则给予人道关怀。
1.2 试剂和仪器
主要试剂为生理盐水、苏木精-伊红染液、ELISA试剂盒(购自上海博谷生物科技有限公司)等。主要仪器有Leica CM1900冰冻切片机(上海来卡仪器有限公司)、Leica DM2500荧光显微镜成像系统(上海来卡仪器有限公司)、Bio-Rad Model 680酶标仪、细胞分类计数器、细胞计数板等。
1.3 实验方法
1.3.1 长爪沙鼠动情周期的确定:每天早上8:30保定动物,以30 μL生理盐水轻轻冲洗长爪沙鼠阴道后吸出,加至洁净的96孔板中直接镜检,观察细胞的种类和形态[4],根据下述判定标准进行动情周期判断。①动情前期:持续时间为(21.0±10.0)h,阴道涂片中可见大量椭圆形的有核上皮细胞,偶见少量角化细胞;②动情期:持续时间为(25.8±9.8)h,阴道涂片可见大量外形不规则的角化上皮细胞,偶有少量有核上皮细胞;③动情后期:持续时间为(17.6±8.7)h,阴道涂片不规则角化上皮细胞、有核上皮细胞和淋巴细胞均可见,且比例相当;④动情间期:持续时间为(48.0±37.8)h,可见大量淋巴细胞及少量有核上皮细胞[4]。
1.3.2 标本采集:待确定长爪沙鼠的动情周期后,眼球采血,采血时防止溶血和杂质污染。室温放置30 min,2 500 r/min离心10 min,分离血清,分装成2个EP管,-20℃ 保存。室温下,采用颈椎脱臼法处死长爪沙鼠,剥离双侧卵巢,用 4%甲醛溶液固定后常规石蜡包埋切片,置于Leica切片机上连续切片,厚度为5 μm,苏木精-伊红染色后进行显微镜观察并拍照。
1.3.3 卵泡的计数:取长爪沙鼠的双侧卵巢,固定后进行石蜡切片,苏木精-伊红染色,显微镜下计数各样本切片的原始卵泡、初级卵泡、次级卵泡、成熟卵泡和黄体的数目。哺乳类动物随着动情周期变化卵巢内会出现不同数量的卵泡和黄体,按下述方法进行判断[5]。①原始卵泡:靠近白膜,中央有一个卵细胞,其外周为单层扁平的卵泡细胞;②初级卵泡:初级卵母细胞体积较大,单层或多层(5~6层)立方形或柱状卵泡细胞;③次级卵泡:卵泡体积扩大,形成卵丘,卵泡细胞增至6~12层;④成熟卵泡:卵泡体积很大,并向卵巢表面突出,颗粒层很薄,卵丘非常明显;⑤黄体:排卵后残留在卵巢内的卵泡壁塌陷,卵泡膜的结缔组织和血管等伸入到颗粒层,在LH的作用下演变成体积较大,富含毛细血管并具有分泌功能的细胞团。
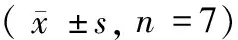
表1 长爪沙鼠动情周期各时相的卵泡和黄体数量
1.3.4 性激素水平的测定:用酶联免疫吸附测定法(ELISA法)[6,7]定量测定各组长爪沙鼠血清催乳素(PRL)、雌二醇(E2)、促卵泡刺激素(FSH)和黄体生成素(LH)水平。
1.4 统计学方法

2 结果
2.1 长爪沙鼠动情周期各阶段阴道涂片的观察
长爪沙鼠动情周期中各时相阴道涂片的特点:①动情前期阴道涂片主要以有核上皮细胞为主(图1A);②动情期主要为不规则的角化细胞,图1B;③动情后期可观察到不规则角化上皮细胞、有核上皮细胞和淋巴细胞均存在,以角化细胞、淋巴细胞两者为主,图1C;④动情间期时主要为淋巴细胞,偶有少量有核上皮细胞(图1D)(图1见彩插2)。
2.2 动情周期卵巢形态观察和卵泡数量的变化
由表1可见,长爪沙鼠动情周期各时相原始卵泡数量自动情前期开始呈现先减少后增多的趋势,初级卵泡和次级卵泡数量在各时相差异未见显著性,成熟卵泡数量先增多再减少,无统计学差异。长爪沙鼠动情前期和动情期的卵泡数量较多,其中动情前期初级卵泡数量居多,次级卵泡和成熟卵泡开始生成,见图2A。动情期的成熟卵泡数量多于动情周期其他时相,并逐渐有新的黄体形成(图2B)。动情后期原始卵泡和初级卵泡相比于其他时相有所增多,其中初级卵泡较各时相最多,黄体数量增多,见图2C。动情间期原始卵泡和初级卵泡较多,黄体数量显著性低于动情前期、动情期和动情后期(P<0.05),且较大呈片状,见图2D(图2见彩插2)。动情周期各时相间各级卵泡数量差异未见显著性。
2.3 动情周期血清PRL、E2、 FSH 和LH水平的变化
长爪沙鼠血清PRL水平从动情前期、动情期、动情后期至动情间期分别为(3.43±0.27)ng/mL、(5.11±0.27)ng/mL、(5.15±0.37)ng/mL、(7.58±0.18)ng/mL,呈逐渐升高,动情间期PRL水平与其他各组差异显著(P<0.05),见图3A。血清E2水平从动情前期至动情间期分别为(42.45±2.83)mIU/mL、(23.29±2.20)mIU/mL、(20.42±0.60)mIU/mL、(22.42±0.25)mIU/mL,由前期到间期逐渐减少,动情前期血清E2水平显著性高于其他各组(P<0.05),见图3B。长爪沙鼠血清FSH水平(图3C)从动情前期到动情间期分别是(4.47±0.45)mIU/mL、(2.87±0.37)mIU/mL、(1.96±0.07)mIU/mL、(0.91±0.04)mIU/mL,整体呈下降趋势,动情前期FSH水平显著性高于动情后期和动情间期(P<0.05)。血清LH水平从动情前期到动情间期分别是(4.77±0.52)mIU/mL、(7.07±0.48)mIU/mL、(4.81±0.38)mIU/mL、(11.11±0.31)mIU/mL,呈逐渐升高,至动情间期达到峰值,并显著性高于其他各组(P<0.01),见图3D。

(A)图为血清催乳素(PRL)水平,(B)图为血清雌二醇(E2)水平,(C)图为血清促卵泡刺激素(FSH)水平,(D)图为血清黄体生成素(LH)水平。P为动情前期,E为动情期,M为动情后期,D为动情间期。
3 讨论
本文根据雌性啮齿类动物在动情周期的不同时相,阴道黏膜受卵巢雌、孕激素的影响会发生典型变化的原理[8],用直接镜检法计数角化细胞,统计阴道脱落细胞的类型及比例,从而确定长爪沙鼠动情周期的四个时相[4],并采用ELISA法测定长爪沙鼠动情周期各时相性激素的变化。长爪沙鼠动情周期期间血清中促性腺激素(FSH和LH)、催乳素(PRL)和雌二醇(E2)的动态变化与动情周期各时相的卵泡和黄体生成密切相关。在动情前期,血清E2增多,通过对下丘脑的反馈作用调节GnRH和促性腺激素大量分泌,引起FSH在动情前期含量急剧增高,促进卵巢卵泡的快速生长。血清LH水平从动情前期到动情间期呈逐渐升高,先在动情期达到一个峰,动情后期有所下降,至动情间期达到最高峰(图3D)。E2通过正反馈作用作用于下丘脑的周期中枢,引起排卵前LH增高[9]。在动情间期血清E2的含量稍微增加, LH大量增多(图3),在LH峰出现之后,卵泡的内膜细胞和颗粒细胞开始黄体化[9],在动情前期生成大量黄体(表1)。FSH从动情前期到动情间期,呈现逐渐下降趋势,动情前期达到峰值(图3C),为卵泡发育和LH的生成奠定了基础。FSH可促进卵巢卵泡的生长,促进卵泡颗粒细胞的增生和雌激素的合成和分泌,并可刺激卵泡细胞上LH受体产生,而LH可促进卵泡的成熟和排卵,刺激卵泡内膜细胞产生雄激素(为颗粒细胞合成雌激素提供前体物质),并可促进排卵后的颗粒细胞黄体化,维持黄体细胞分泌孕酮[9]。FSH和LH在动情周期中相互协调,对动情周期中卵泡发育和黄体生成至关重要。PRL在未经交配的啮齿类动物体内有促黄体溶解的功能[9]。血清PRL在动情间期达到峰值,当PRL血清浓度达到最高,黄体逐渐退化,卵巢内的黄体数量达到最低(表1)。动情间期黄体的退化为新一周期的黄体生成奠定了基础,也为新一周期的卵泡发育提供了空间。长爪沙鼠动情周期中出现的FSH和E2峰值的时相与大小鼠一致[7,10,11]。而PRL和LH出现峰值的时相与大小鼠有差异,大小鼠的血清PRL和LH均在动情前期出现峰值[7,10, 12]。另外,关于长爪沙鼠动情周期血清PRL、FSH和E2水平出现峰值的时相,Lv XH等[6,7]的结果与本研究结果相同。Lv XH等[7]在长爪沙鼠动情期测到LH的峰值,本研究在动情间期测得LH峰值,LH动情周期各时相的血清含量变化与黄体计数的结果一致,动情间期血清LH出现峰值,促进黄体大量生成,黄体的数量在动情前期达到最多。动情周期各时相中各级卵泡数量未见显著性差异,有待进一步研究。
随着长爪沙鼠科研用途的不断扩展,动情周期各时相卵泡数量与血清激素水平变化规律的揭示将完善长爪沙鼠生殖生理特性,为长爪沙鼠应用于妇科、产科和计划生育等医学科学研究提供参考。
参考文献:
[1] 肖丽, 戴方伟, 宋晓明, 等. 长爪沙鼠在病原感染研究中的应用 [J]. 中国比较医学杂志, 2013, 23(7):61-67.
[2] 路静, 朱祥宇, 王超, 等. 周龄和激素水平对长爪沙鼠超数排卵效果的影响 [J]. 中国比较医学杂志, 2012, 22(8):15-17.
[3] 戴丽军, 黄莉, 廖军. 长爪沙鼠血清雌性激素的比较研究 [J]. 中国实验动物学报, 2006, 13(4):246-248.
[4] 陈立青, 戴方伟, 郭红刚, 等. 长爪沙鼠发情周期规律与判定方法 [J]. 中国实验动物学报, 2014, 22(1):67-70.
[5] 李力, 乔杰. 实用生殖医学[M]. 人民卫生出版社, 2012:45-82.
[6] Lv XH, Shi DZ. Variations of serum estradiol and progesterone levels during consecutive reproductive states in Mongolian gerbils (Merionesunguiculatus) [J]. Exp Anim, 2010, 59(2):231-237.
[7] Lv XH, Shi DZ. Variations in serum gonadotropin and prolactin levels during consecutive reproductive states in Mongolian gerbils (Merionesunguiculatus) [J]. Exp Anim, 2011, 60(2):169-176.
[8] Long JA, Evans HM. The estrous cycle in the rat and its associated phenomena [J]. Mems Univ Calif, 1922, 6:1-148.
[9] 朱士恩. 动物生殖生理学[M]. 中国农业出版社, 2006:50-69.
[10] Smith MS, Freeman ME, Neill JD. The control of progesterone secretion during the estrous cycle and early pseudopregnancy in the rat: prolactin, gonadotropin and steroid levels associated with rescue of the corpus luteum of pseudopregnancy [J]. Endocrinology, 1975, 96(1):219-226.
[11] Nelson JF, Felicio LS, Osterburg HH, et al. Differential contributions of ovarian and extraovarian factors to age-related reductions in plasma estradiol and progesterone during the estrous cycle of C57BL/6J mice [J]. Endocrinology, 1992, 130(2):805-810.
[12] Michael SD. Plasma prolactin and progesterone during the estrous cycle in the mouse [J]. Exp Biol Med, 1976, 153(2):254-257.

