黑线仓鼠及其白化突变系肌张力异常蛋白变体X1基因的克隆与序列分析研究
易思萌,刘慧芳,曾 林,孙兆增,王 新
( 1. 军事医学科学院实验动物中心,北京 100071;2.青岛农业大学,山东 青岛 266109)
黑线仓鼠白化突变系的建立是为了给人类白化病提供动物模型,动物白化现象出现的原因多种多样,关于基因突变导致白化性状的出现,已经被很多次报道,最常见的是有关于酪氨酸酶的研究,但是对于仓鼠尤其是黑线仓鼠的白化性状的相关研究并未出现明确的相关研究报道[1]。总而言之,基因的突变导致白化简单来说就是基因控制着酶,这些酶又控制着机体生化反应的过程,最后决定了动物体的性状。但是具体是哪一部分的基因出现突变尚有待进一步的研究[1-2]。本文拟以肌张力异常蛋白变体X1段基因编码区作为研究对象,依照其设计出6对引物,再通过RT-PCR的方法,试图证明黑线仓鼠及其白化突变系肌张力异常蛋白变体X1基因编码区之间的差异性,以及与白化现象是否存在联系。肌张力异常蛋白是一种大型多域并与细胞骨架相关的蛋白质,它在神经系统中有着重要作用[3]。
肌张力异常蛋白主要分为三种亚型,分别为dystonin-e、dystonin-a、dystonin-b;其中的dystonin-a又可以通过可变剪接衍生出三种同种型神经元,分别是dystonin-a1、dystonin-a2、dystonin-a3,肌张力异常蛋白变体X1是dystonin-a连接细胞骨架中重要的一段,以上三种同种型神经元共享的N-末端肌动蛋白结合结构域,广泛的卷曲螺旋区域,和一个C-末端微管结合域,从而允许用于与细胞骨架细丝相互作用并促进它们的功能,如细胞骨架连接。虽然dystonin-a同种型具有相似的域机构,但是区分他们并定位其亚细胞定位独特性的N端区域;具体来说,dystonin-a1是一个短的N端结构域,其包括一种肌动蛋白结合结构域,其位于肌动蛋白丝,而dystonin-a2具有跨膜结构域,它定位于核膜和核周膜;dystonin-a3拥有去豆蔻酰化结构域,协助确定等离子体[4]。损失肌张力异常蛋白会导致小鼠和大鼠出现肌肉紧张障碍,小鼠会出现神经肌肉功能障碍甚至过早死,该蛋白血小板溶素保守区域决定了该蛋白的亚型特征,但其相互作用尚未有详细的阐述和报道[3-5]。本研究旨在明确黑线仓鼠白化突变系肌张力异常蛋白变体X1与其白化性状产生机制有无影响,本实验拟通过克隆肌张力异常蛋白变体X1段基因编码区设计的6对引物,分析其编码区的序列,找出可能存在的突变位点,为与黑线仓鼠及其白化突变系的相关研究,提供相应的研究数据及其理论依据。
1 材料和方法
1.1 材料
1.1.1 菌种
大肠菌株DH5a为本实验室保存菌种。
1.1.2 主要试剂
RNA提取试剂盒RNases Mini Kit为QIAGEN公司产品; 反转录试剂盒、pMD18-T载体出自大连TaKaRa公司产品;标准分子量核酸DNA maker购自Biomed;DNA胶回收试剂盒、质粒提取试剂盒是QIAGEN公司的产品。
1.1.3 实验动物
黑线仓鼠及其白化突变系,体重均在19~20 g,雌性3只,5周龄。均由军事医学院实验动物中心提供【SCXK(军)2007-004】。
1.2 方法
1.2.1 黑线仓鼠及其白化突变系皮肤组织总RNA的制备
采用活体皮肤采取的方法,采取黑线仓鼠及其白化突变系背部皮肤组织30 mg用于总RNA的制备;将30 mg左右的皮肤组织剪碎移至匀浆器内,再按照说明书的提取方法抽取总RNA,抽提的总RNA取2 uL测定A260/A280分析提取纯度,之后再用甲醛变性电泳实验分析总RNA确定提取RNA的完整性。
1.2.2 引物设计与合成
由同种型肌张力异常蛋白设计的6对引物扩增全长cDNA:
d-1-F:5’-taaacatggagacaaactga-3’;d-1-R:5’-cagcgattttctgtctcccg-3’;
d-2-F:5’-tagcctacaaaattttgaac-3’;d-2-R:5’-tatcactgaaacttccctga-3’;
d-3-F:5’-tgaggcacagtcagggaagt-3’;d-3-R:5’-gatactttggttttcatcct-3’;
d-4-F:5’-tgtaaaggaacatgaggatg-3’;d-4-R:5’-aaattggtattttctccaca-3’;
d-5-F:5’-tcttaaaagtgtggaggact-3’;d-5-R:5’-aactgcttaagctgattctt-3’;
d-6-F:5’-tctagaagctttgaagaatc-3’;d-6-R:5’-tcgtttagcttctgctcaat-3’。
1.2.3 RT-PCR
按照大连TaKaRa公司合成试剂盒提供的方法先用逆转录试剂盒合成cDNA的第一条链,并且通过PCR扩增获得大量的目的基因产物,之后再通过1.5 %的琼脂糖凝胶电泳进行分析。25 uL的PCR扩增体积中,组成该体系不同组分的浓度分别为:10×loading Buffer 2.5 uL,dNTP 4 uL,上游引物1 uL,下游引物1 uL,cDNA模板 2 uL,Lataq聚合酶0.25 uL,最后加无菌蒸馏水至25 uL。PCR运行程序为95℃欲变性5 min;95℃ 变性30 s;6对引物的退火温度分别为d1 55℃、d2 59℃、d364℃、d4 58℃、d5 58℃、d6 61℃;72℃复性延伸2 min;35个循环;最后72℃延伸7 min后终止。
1.2.4 肌张力异常蛋白cDNA的克隆及其序列测定
通过RT-PCR大量扩增出目的基因,再经过凝胶电泳纯化分离目的基因产物,再用QIAGEN公司的胶回收试剂盒进行产物的胶回收,之后再将回收的目的基因产物连接到pMD-18T上,16℃连接过夜后,再将连接产物转化大肠杆菌DH5a感受态里,通过菌液PCR和1.5%琼脂糖凝胶电泳的方法筛选鉴定阳性重组,随机挑取3个阳性克隆分别制备成菌液,送去Biomed测序。测序结果应用BLAST对其进行比较分析。
2 结果
2.1 黑线仓鼠及其白化突变系皮肤组织总RNA的制备
用RNases Mini Kit试剂盒采取黑线仓鼠及其白化突变系皮肤的总RNA,其A260/A280的值分别为2.05、1.98、1.94、1.85;1.95、1.98、2.03、1.88.,经琼脂糖电泳后可见较清晰的八条带,说明所抽提的总RNA无明显的降解,是完整的(图1)。

注:1-4为黑线仓鼠;5-8为黑线仓鼠白化突变系。
2.2 RT-PCR获取肌张力异常蛋白及其序列测定
以黑线仓鼠及其白化突变系皮肤总RNA为模板,进行反转录省去了纯化mRNA的步骤。RT-PCR反应产物经琼脂糖凝胶电泳分析,如图2所示,清晰可见各片段的扩增条带产物,再用QIAGEN公司的胶回收试剂盒回收后,连接到质粒pMD18-T上,连接产物转化到大肠杆菌DH5a感受态中,再经菌液PCR鉴定成阳性。
2.3 肌张力异常蛋白的序列比对
将RT-PCR扩增得到的片段送去Biomed公司进行拼接测序,获得了6条的包含大部分编码区的序列,编码6条不同片段大小的氨基酸并且利用NCBI的BLAST功能比对显示,该序列与仓鼠的肌张力异常蛋白的基因序列具有99%的相似性,由此可知该序列与仓鼠的肌张力异常蛋白变体X1基因序列具有高度保守性,进一步证实了所分离基因的正确性,可以断定该序列为黑线仓鼠及其白化突变系肌张力异常蛋白基因的编码区序列。
利用DNASTAR软件的MegAlign程序,将黑线仓鼠及其白化突变系的肌张力异常蛋白基因序列进行比对,发现其编码区序列共6563 bp仅存在17处突变位点,翻译成氨基酸序列共24处变化,黑:白差异点有pos=99 R:K、pos=135Y:N、pos=140 D:N、pos=442.:Q、pos=442.:Q、pos=643K:X、pos=789R:H、pos=820 D:N、pos=851 N:D、pos=856 G:S、pos=890 C:Y、pos=1034 S:P、pos=1184 W:.、pos=1269 E:G、pos=1518 L:F、pos=1528 P:S、pos=1883 L:.、pos=1884 E:R、pos=1885 A:L、pos=1886 L:.、pos=1887 K:R、pos=1888 N:I、pos=1890 Q:S、pos=1892 K:S、pos=2024 H:R;但关键核酸蛋白并未见突变(图3,彩插3)。
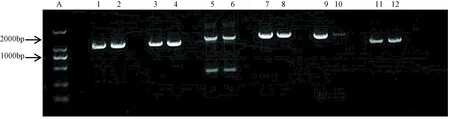
注:A:Marker 2000;1、3、5、7、9、11:为黑线仓鼠;2、4、6、8、10:为黑线仓鼠白化突变系。
3 讨论
本实验扩增了黑线仓鼠及其白化突变系肌张力异常蛋白变体X1段较完整的基因编码区,该序列通过NCBI的BLAST可知,其与黑线仓鼠的肌张力异常蛋白变体X1段基因序列具有99%左右的相似性,通过对该序列的数据分析和生物信息学方法,鉴定了分离基因的正确性,黑线仓鼠及其白化突变系肌张力异常蛋白变体X1段基因编码区有与仓鼠等动物类似的结构序列,通过研究肌张力异常蛋白变体X1段基因序列,可以进一步证实该类基因是否就是影响黑线仓鼠出现退行性白化突变的原因,但通过对该蛋白基因片段的研究可知,我们通过RT-PCR手段扩增得出肌张力异常蛋白变体X1段基因序列并进行多态分析,进而为研究肌张力异常蛋白基因与黑线仓鼠白化性状产生机制提供了相应的理论基础。
通过DNASTAR的MegAlign软件,分析了黑线仓鼠及其白化突变系肌张力异常蛋白基因编码区的序列,发现其编码区序列存在17个突变位点,翻译成氨基酸序列比对发现24处不同,分别为:pos=99 R:K、pos=135Y:N、pos=140 D:N、pos=442.:Q、pos=442.:Q、pos=643K:X、pos=789R:H、pos=820 D:N、pos=851 N:D、pos=856 G:S、pos=890 C:Y、pos=1034 S:P、pos=1184 W:.、pos=1269 E:G、pos=1518 L:F、pos=1528 P:S、pos=1883 L:.、pos=1884 E:R、pos=1885 A:L、pos=1886 L:.、pos=1887 K:R、pos=1888 N:I、pos=1890 Q:S、pos=1892 K:S、pos=2024 H:R;但是没有关键蛋白出现变化。说明黑线仓鼠白化突变系白化性状产生的原因与该基因导致的神经退行性疾病的产生原因不同,并不编码区序列的突变造成的,可能是与其他基因的突变有关,黑线仓鼠白化性状产生的机制仍有待进一步的研究。
参考文献:
[1] Spritz RA Chiang PW,Naoki Oiso N,etal. Human and mouse disorders of Pigmentation[J]. CurrOpin Genetics Dev 2003,13:284-289.
[2] Carden SM,Boissy RE,Schoettker PJ,etal. Albinism: moderm molecular diagnosis[J]. Brit J Ophthalamol, 1998,82:189-195.
[3] Bhanot K, Young K G, Kothary R. MAP1B and clathrin are novel interacting partners of the giant cyto-linker dystonin[J]. Journal of proteome research, 2011, 10(11): 5118-5127.
[4] Ryan S D, Bhanot K, Ferrier A,etal. Microtubule stability, Golgi organization, and transport flux require dystonin-a2-MAP1B interaction[J]. The Journal of cell biology, 2012, 196(6): 727-742.
[5] Duchen L W,Falconer,D.S. Dystonia Musculorum. A hereditary neuropathy ofmice affecting mainly pathways [C]. JournalofPhysiol.Ysiology-London. 40 West 20th Street New York, NY 10011-4211: Cambridge Univpress, 1963, 165(1): 7-9.

