介孔SO42−/W-TiO2@SiO2可见光催化剂的制备及催化性能
占昌朝 ,钟明强 ,陈 枫,杨晋涛,曹小华 ,张 旭,刘 涛
(1. 浙江工业大学 化学工程与材料学院,杭州 310014;2. 九江学院 化学与环境工程学院,九江 332005)
因具有无毒、化学性质稳定、难溶、抗光及化学腐蚀等优点,TiO2光催化剂在降解空气和水中有机污染物方面有着广阔的应用前景[1−3]。因而,有关 TiO2光催化剂的研究也受到了越来越多的关注,并在制备方法及机理研究方面取得了许多新进展。然而,由于存在激发波长短,太阳能利用率低,光生电子及空穴复合几率高,量子效率低等不足,因此,开发具有可见光响应的高活性光催化剂成为目前光催化领域的一个重要课题[4−6]。通过金属离子掺杂、硫酸化修饰、介孔化和负载等方法对TiO2光催化剂进行改性,能拓展光谱响应范围、抑制光生载流子复合、增大比表面积使其催化活性得到提高[7−10]。
介孔TiO2虽然具有比表面积较大的优点,但是在高温后处理过程中,往往会发生介孔结构坍塌,比表面积减小,晶型从锐钛矿转变到金红石相,从而导致光催化剂活性下降[11]。采用在介孔TiO2中引入金属氧化物 (如 SiO2、ZrO2、Al2O3等)或过渡金属离子掺杂(如 W6+、Nb5+、Mo5+和 Mn2+等)的方法已证明能克服以上不足[7,12−14]。FU 等[12]报道加入 SiO2或 ZrO2能提高TiO2光催化剂的热稳定性和表面酸性,增大催化剂的比表面积。刘松等[14]采用W6+掺杂介孔TiO2提高了降解亚基兰的可见光催化活性。
近来,有研究表明TiO2表面采用硫酸化修饰后能提高其锐钛矿的含量,比表面积及表面酸性[15−16]。TiO2表面的酸性质点有利于对有机污染物的吸附,从而提高其光催化活性[15]。付贤智等[16]研究发现:SO42−/TiO2光催化降解含 CHBr3、C6H6、C2H4气相有机污染物空气的降解效率是未进行硫酸化表面修饰TiO2的 6倍。PERIYAT等[17]研究发现硫掺杂 TiO2,经800 ℃焙烧后,催化剂仍可保持100%锐钛矿晶型,对罗丹明B脱色具有较高的可见光催化活性。为此,本文作者采用钛酸四丁酯为起始原料,经溶胶−凝胶法制备一种可见光响应、高活性的介孔SO42−/W-TiO2@SiO2光催化剂,并探讨研究钨掺杂量对介孔SO42−/W-TiO2@SiO2光催化剂组织结构及光催化活性的影响。
1 实验
1.1 试剂及仪器
钛酸四丁酯为化学纯,钨酸铵、过硫酸铵、无水乙醇、冰乙酸、盐酸、甲基橙等均为分析纯;非离子表面活性剂 EO20PO70EO20(P123)、P25光催化剂及气相SiO2(AEROSIL300)分别购于西格玛及德固赛公司;水为去离子水。
上海意丰公司SK2−2−10型管式电阻炉;荷兰FEI公司 Quanta200F型场发射环境扫描电子显微镜(SEM);荷兰 Philips-FEI 公司 Tecnai G2 F30 S−Twin型高分辨率透射电子显微镜(HRTEM);美国热电公司Thermo ARL SCINTAG X’TRA 型X射线衍射分析仪(Cu Kα靶,λ=0.154 178 nm,管电压40 kV,管电流40 mA,扫描范围 10°~80°,扫描速度 4 (°)/min);日本岛津公司Kratos AXIS Ultra DLD型光电子能谱仪(激发源为A1 KαX射线,分析室基础真空度为9×10−7Pa,结合能用污染碳的C ls峰(284.6 eV)校正);日本SHIMADZU 公司 UV−2550 型紫外可见分光光度仪;美国麦克公司 ASAT2010 自动多站比表面积和孔隙度分析仪(200 ℃脱气处理1 h,77 K下吸附N2);美国Nicolet−6700 型傅里叶红外外光谱仪;瑞士Mettler Toledo 公司TGA/DSC1型热分析仪器 (空气气氛,升温速率采取10 ℃/min);日本Hitachi公司F−4500 型荧光分光光度计(PL);上海精密科学仪器有限公司752 N型紫外可见−光分光光度计。
1.2 光催化剂的制备
介孔SO42−/W-TiO2@SiO2可见光响应催化剂采用溶胶−凝胶法制备。在室温条件下,首先将0.2 g 模板剂P123、5 mL冰乙酸溶解在15 mL无水乙醇中;继而在剧烈搅拌下,将5 mL钛酸四丁酯缓慢滴入以上溶液中,滴加完毕后搅拌1 h;然后依次加入一定量的气相SiO2、钨酸铵溶液及1 mol/L过硫酸铵溶液,保持钛酸丁酯、二氧化硅、钨和过硫酸铵的摩尔比为1:1:x:0.05,继续搅拌2 h后得到淡黄色的溶胶;溶胶在70 ℃ 干燥 24 h,冷却后用玛瑙研钵磨细得干凝胶样品。
样品置于管式炉中不同设定温度下进行空气气氛下焙烧2 h,即得介孔SO42−/xW-TiO2@SiO2W掺杂量(n(W)/n(Ti),分别为 0、0.001、0.002 5、0.005、0.01)光催化剂,将以上制备的光催化剂缩写成为:xWSTS-t,经 600 ℃下焙烧 2 h 的 SO42−/0.002 5WTiO2@SiO2样品即可标记为0.002 5WSTS-600。
1.3 光催化性能测试
在自制带夹套的光催化反应器中加入250 mL质量浓度为20 mg/L的甲基橙溶液和0.25 g光催化剂,体系温度维持在25 ℃。搅拌均匀30 min达到吸脱附平衡,测量此时甲基橙浓度作为初始浓度。紫外及可见光降解分别采用500 W的自镇流高压汞灯(主波长365 nm)及400 W卤素灯为光源,并将其置于液面正上方20 cm处,卤素灯需要加入滤光片滤去紫外光部分(λ<400 nm)。在匀速搅拌条件下,进行光降解,每隔10 min取样5 mL,离心取上层清液,用分光光度计测定甲基橙浓度变化。用脱色率(η=(1−ct/c0)×100%,c0和 ct分别为起始和降解后的浓度)来表征废水的降解效果。
介孔0.002 5WSTS-600光催化剂紫外光下的重复使用性能考察方法同上,每次紫外光解2 h后进行离心回收、60 ℃干燥6 h、称取质量后再循环使用,光催化剂每次仅有微量损失。
2 结果与讨论
2.1 X射线衍射(XRD)表征
图1(a)所示为介孔 xWSTS-600(x=0,0.001,0.002 5,0.005,0.01)光催化剂的广角XRD谱。由图1(a)可知,经 600 ℃热处理后出现锐钛矿型衍射峰,即衍射峰的 2θ分别为 25.3°(101)、37.9°(004)、47.8°(200)和 54.9°(211), 这 与 标 准 的 锐 钛 矿TiO2(JCPDS卡片号为 21−1272)一致。同时峰的对称性良好,说明已经形成完整的锐钛矿结构。且未发现WO3的特征峰,说明钨的含量较低且分散效果良好。且其峰的强度随着钨掺杂量的增加而增宽变弱。图1(b)所示为0.002 5WSTS-600小角XRD谱,经600 ℃焙烧2 h 的0.002 5WSTS-600样品在 2θ=0.9° 位置处出现了一个对应(l00)面的特征衍射峰,这说明材料通过P123的结构导向作用后形成了介孔。
表1所列为介孔 xWSTS-600(x=0,0.001,0.002 5,0.005,0.01)的晶格参数变化。由表1可知,催化剂的晶格参数 c随着 W 的掺杂浓度的增加而减小。由于W6+离子半径(0.062 nm)比Ti4+离子半径(0.068 nm)小,W 可能以取代或者掺入的方式到锐钛矿晶格中。同时,由于两者电荷相差较大,所以导致晶格畸变增加,晶格参数 c变小。根据 Scherrer公式D=kλ/(βcosθ)计算出的不同掺杂样品下对应的晶粒尺寸。由表1可知,随着掺杂量的增加,晶粒逐渐减小。
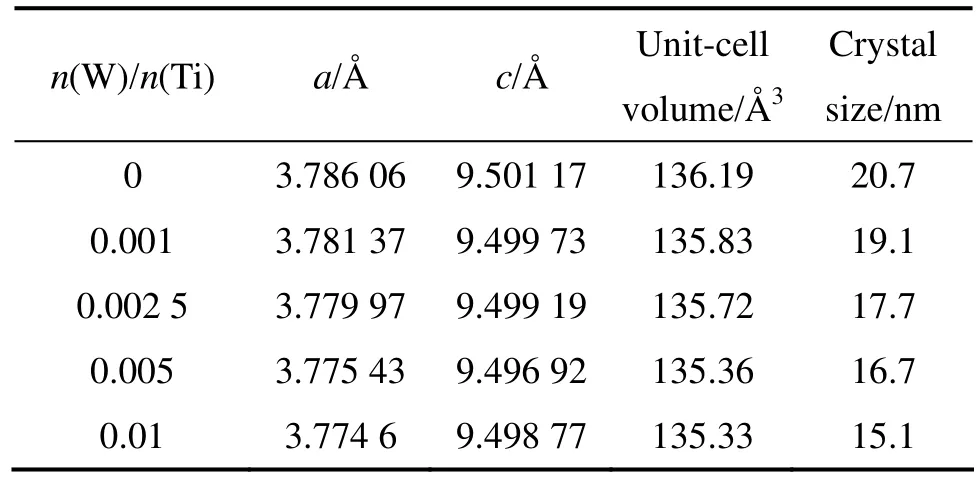
表1 不同W掺杂量光催化剂的特性参数Table 1 Characteristic parameters of photocatalysts with different W doping contents
2.2 SEM与TEM形貌分析
图2(a)所示为介孔0WSTS-600的SEM像(其中内插图为气相 SiO2)。图 2(b)所示为介孔0.002 5WSTS-600光催化剂的SEM像。从图2(a)和(b)可以看出,钨掺杂前后的样品粒子形状均接近于球形,气相SiO2粒径较小,负载后的介孔0WSTS-600粒径增大,在20 nm左右并局部有团聚;钨掺杂后的介孔0.002 5WSTS-600样品粒径变小,分散性得到改善且呈现多孔结构,这也与TEM结果(见2(c)和(d))相吻合。
图2(c)所示为介孔 0WSTS-600 的 TEM 像,图2(d)~(f)所示为介孔 0.002 5WSTS-600光催化剂的TEM及HRTEM图。比较图2(c)和(d)可以看出,制备的产物为近球形纳米粒子,钨掺杂后催化剂粒径变小,在17 nm左右,与表1中谢乐公式计算值较吻合;催化剂的颗粒分散度较高,有局部聚集现象;但钨掺杂后样品分散性明显改善,并呈现介孔结构,这与前面的小角XRD谱及N2吸附脱附等温线所得结果一致。图2(e)中的内插图表明介孔0.002 5WSTS-600催化剂是多晶结构。图2(f)中标出的TiO2的晶面间距d值为0.35 nm,对应于锐钛矿型TiO2的(101)的晶面间距值。但是,对应于WO3晶体的晶面间距却完全没有在HRTEM图中发现,这与XRD图分析结果一致。

图2 介孔0WSTS-600和0.002 5WSTS-600催化剂的SEM像和TEM像Fig. 2 SEM and TEM images of catalysts 0WSTS-600 and 0.002 5WSTS-600 with mesostructure: (a)0WSTS-600 (inset figure for fumed SiO2), SEM; (b)0.002 5WSTS-600, SEM; (c)0WSTS-600, TEM (d)~(f)0.002 5WSTS-600, TEM
2.3 X射线光电子能谱(XPS)表征
图3所示为介孔 0.0 0 1 W S T S-6 0 0 和0.002 5WSTS-600 样品的 Ti 2p、O 1s、S 2p、W 4f的XPS谱。图3(a)是Ti 2p XPS谱。由图3(a)可知,随着钨掺杂量的增加,Ti的结合能向高结合能方向移动,且其强度逐渐减弱,这与W6+掺杂进TiO2晶格形成了W—O—Ti有关[18]。图3(b)表明n(W)/n(Ti)为0.001和0.0025催化剂O 1s XPS谱峰形十分相似,随着W掺杂量的增加,O 1s的峰变宽且强度轻微下降。通过O 1s谱的拟合表明存在 Ti—O与 W—O晶格氧及Si—O—Ti、SO42−、—OH、Si—O—Si 5 种类型的氧,其对应的结合能分别是529.6[19]、530.8[20]、531.6[21]、532.5[22]和533 eV[23]。由图3(c)可知,W物种主要存在 2种价态,W6+对应于 37.8 eV, W5+对应于 36.1 eV[19],同时和位于37.1 eV Ti 3p产生了重合[24]。因为S2−离子半径(1.7 Å)比 O2−离子半径(1.22 Å)大,同时,Ti—S键能(418.0 kJ/mol)远低于 Ti—O 键能(467.2 kJ/mol),所以,从化学反应角度上讲,Ti4+被S6+取代比 O2−被 S2−取代更有利[17]。0.001WSTS-600 和0.002 5WSTS-600两者的S 2p峰(见图3(d))十分相似,且其S 2p结合能均位于168.8 eV,表明硫以S6+(SO42−)形式存在[17,25],与文献[17]中 SO42−/TiO2光催化剂 S 2p结合能位于168.4 eV相比提高了0.4 eV,表明其所处的化学环境不同。表2数据表明钨掺杂量提高后,表面的硫含量相同,氧空穴数量进一步增加,这与图3(d)相吻合。
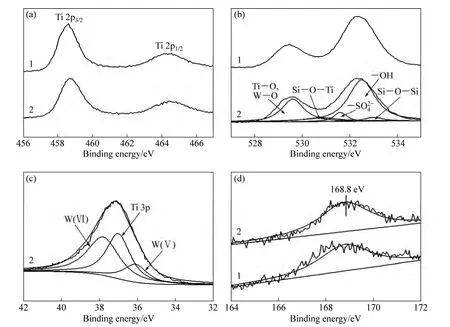
图3 0.001WSTS-600和0.002 5WSTS-600介孔光催化剂的XPS谱Fig. 3 XPS spectra of 0.001WSTS-600 (1)and 0.002 5WSTS-600 (2)Photocatalysts with mesostructure: (a)Ti 2p; (b)O 1s;(c)W 4f; (d)S 2p
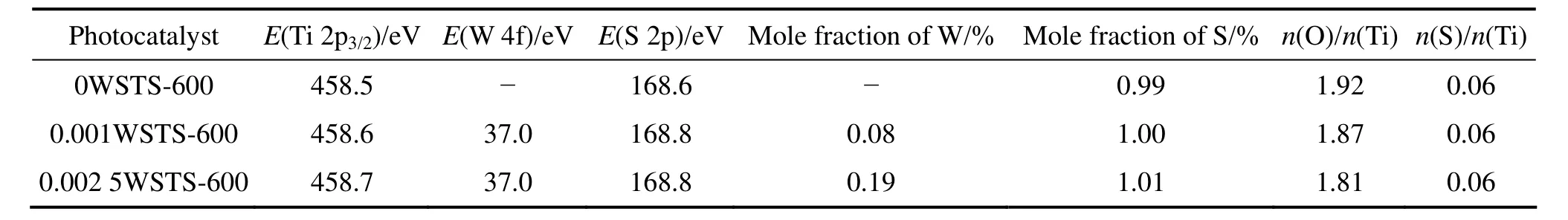
表2 介孔xWSTS-600(x=0, 0.001, 0.002 5)光催化剂XPS分析Table 2 XPS analysis of xWSTS-600 (x=0, 0.001, 0.002 5)photocatalysts with mesostructure
2.4 比表面积及孔径分布(BET)表征
表3和图4所示为BET的测试结果。由表3可以知,经过钨掺杂后的光催化剂比表面积和孔容及孔径均得到了提高,随着W掺杂量的进一步提高,比表面积、孔容积反而有所下降,并导致光催化活性的降低。说明W的掺杂量存在一个最佳量,过多后会在表面聚集。图4所示为不同催化剂的N2吸附等温线和孔径分布。图4(a)均属于带有H3滞留环的IV型等温线,体系存在介孔结构。图4(b)表明同时存在介孔和大孔,孔径分布不均匀,是由纳米粒子之间的堆积孔和模板剂脱除形成的介孔组成。随着W含量的增加,样品比表面积和孔容有所下降,其N2吸附向低压方向移动,孔径变小。孔径减小,比表面积和孔容降低可能是由部分颗粒团聚以及孔洞坍塌等引起的。
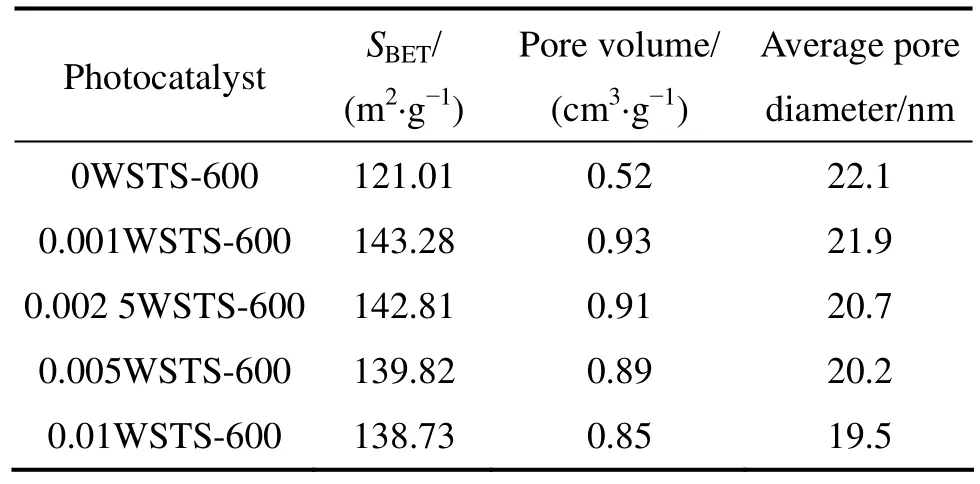
表3 多点BET法测得的相关数据Table 3 Data measured by multi-point BET

图4 介孔xWSTS-600(x=0.001, 0.002 5, 0.01)样品吸附脱附等温线及孔分布Fig. 4 N2 adsorption-desorption isotherms (a)and pore volume distribution (BJH desorption)of mesoporous xWSTS-600 (x=0.001, 0.002 5, 0.01)
2.5 紫外−可见光谱(UV-Vis)表征
图5所示为不同样品的紫外−可见光谱。由图 5可以看出,所有W掺杂SO42-/TiO2@SiO2样品的光吸收截止波长(光吸收阀值)同未掺杂样品相比,都向可见光区域发生了红移。将样品的光吸收阀值代入公式Eg=1 240/λg能定量估算其带隙,介孔0.002 5WSTS-600样品红移到408 nm,其对应的禁带宽度是3.04 eV。发生红移的主要原因是W6+离子进入TiO2晶格,部分取代Ti4+的晶格位置,产生了晶格点缺陷,在TiO2带隙中形成杂质能级并与TiO2导带重叠,导致光生电子跃迁到导带的能量减小,即能吸收波长较长的波,光谱产生红移。
2.6 红外光谱(FTIR)表征
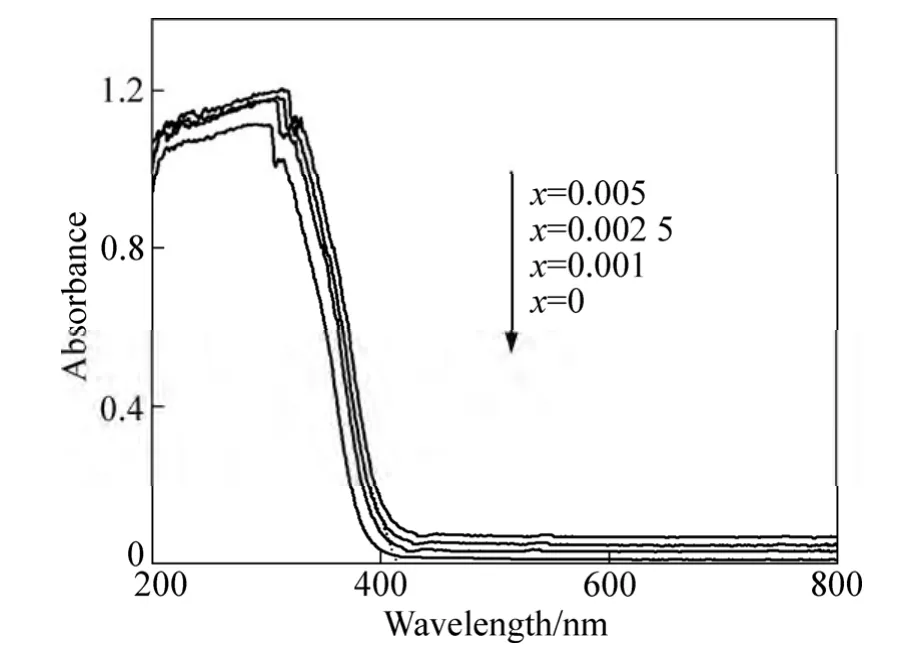
图5 不同样品的紫外−可见光谱Fig. 5 Absorbance UV-vis spectra of different samples
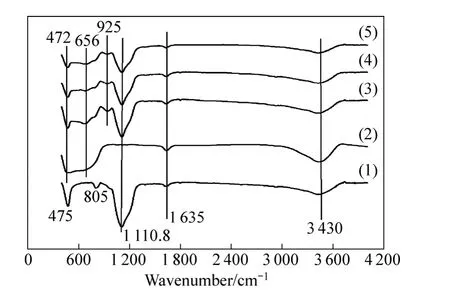
图6 样品的红外光谱Fig. 6 FTIR spectra of samples: (1)SiO2; (2)P25; (3)0.0025WSTS-500; (4)0.0025WSTS-600; (5)0.0025WSTS-700
图6所示为样品的红外光谱。由图6可知,所有样品均在3 430、1 635 cm−1处出现了处吸收峰,其分别为表面O—H的伸缩振动、H—O—H弯曲振动吸收峰。0.002 5WSTS-t(t=500,600,700 )样品与 P25光催化剂在472、656 cm−1处出现Ti—O—Ti与 Ti—O的振动吸收峰[26],前三者还在 925 cm−1处出现Si—O—Ti 的伸缩振动峰[27−28],表明 TiO2和载体 SiO2之间形成了化学键,说明两者结合得比较牢固,从而光催化剂在使用过程中不易流失。在1 110.8 cm−1附近1 000 ~1 270 cm−1的宽吸收峰为S=O对称伸缩吸收峰和Si—O—Si非对称伸缩振动峰[29]的重叠峰,这与文献[21, 30−31]所报道Ti和SO42−形成了双齿桥联及双齿螯合配合物,S=O对称伸缩特征吸收峰区间在995~1 265 cm−1一致。从图6还可知,随着温度提高,峰强度逐步下降,表明有硫物种不断除去,这与热重分析相吻合。SiO2还在 805、475 cm−1出现了吸收峰,分别是由 Si—O—Si对称伸缩振动、弯曲振动引起。此外,未发现有关W成键特征峰,与其高分散度及低含量有关。
2.7 热重分析(TG)表征
0.0025 WSTS-600干凝胶在空气氛中的热稳定性见图7。由图7可知,当温度升至500 ℃时,总质量损失了29.87%,是吸附的水分、有机物及部分硫物种从催化剂中去除;当温度从500 ℃升至600 ℃时,总质量下降了12.8%,主要是硫的脱除;当温度升至700℃时,大部分硫物种已经消除[32]。硫物种在焙烧去除过程中能在催化剂次层表面产生氧缺陷,同时残余的硫物种(SO42−)使表面显酸性,特别是 Brönsted 质子酸质点数会显著增加[33]。
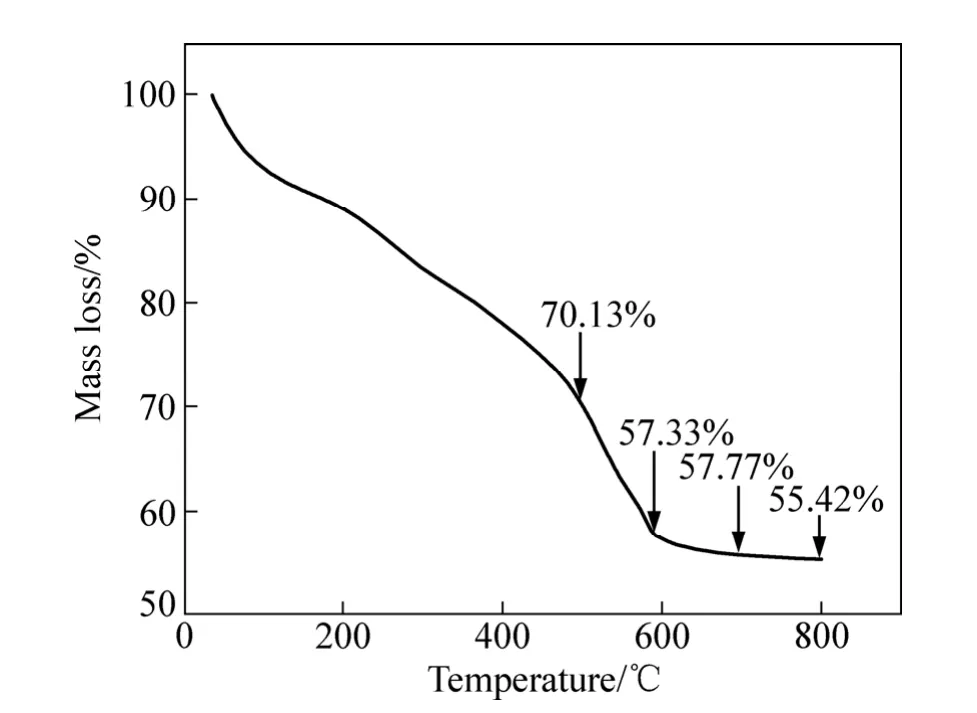
图7 0.002 5WSTS-600干凝胶热重分析Fig. 7 Thermogravimetric analysis of 0.0025WSTS-600 xerogels
2.8 荧光光谱(PL)分析

图8 xWSTS-600(x=0, 0.001, 0.002 5, 0.005, 0.01)光催化剂的荧光光谱(激发波长300 nm)Fig. 8 Photoluminescence spectra of xWSTS-600 (x=0, 0.001,0.002 5, 0.005, 0.01)photocatalysts with excitation wavelength of 300 nm
图8所示为 xWSTS-600(x=0,0.001,0.002 5,0.005,0.01)(摩尔分数)光催化剂荧光光谱(PL)图。由图 8可看出,钨掺杂样品的荧光强度比SO42−/TiO2@SiO2有所下降,荧光光强度由大到小的顺序为 0WSTS-600、0.001WSTS-600、0.01WSTS-600、0.005WSTS-600和0.002 5WSTS-600;与之相反,钨掺杂光催化剂的光生电子−空穴对分离效率逐步增加,这也与钨掺杂样品的紫外光催化降解甲基橙的活性一致。
2.9 光催化性能
以水中有机污染物甲基橙为目标降解物来考察光催化剂 P25 及介孔 SO42−/xW-TiO2@SiO2(x=0,0.001,0.002 5,0.005,0.01)光催化活性(见图9)。从图9可知,当钨掺杂量低于0.25%时,随着W掺杂量的增加,光催化活性逐渐提高;当n(W)/n(Ti)=0.002 5时,催化活性最好,60 min紫外光降解脱色率为98.89%,40 h可见光降解脱色率为91.7%;而P25可见光降解甲基橙脱色率很低,最后仅为9.2%;W掺杂量继续增加,光催化效率呈下降趋势。光催化主要机理如图 10所示,光催化活性得到提高是因为:
1) 在光催化反应中,W(Ⅵ)和 W(Ⅴ)的共存对延长光生载流子的寿命可能起重要的作用。其中 W(Ⅵ)和 W(Ⅴ)可分别充当光生电子和空穴的浅势俘获阱,从而发生W(Ⅵ)和W(Ⅴ)相互转化:

这一过程抑制了光生电子和空穴的简单复合,使反应的光量子效率增高,导致光催化活性提高。但当掺W的量过高时,W(Ⅵ)和W(Ⅴ)的浓度增加,W(Ⅵ)和W(Ⅴ)之间的距离靠近,W(Ⅵ)和W(Ⅴ)又可能变成了光生电子和空穴的复合中心,降低了光催化活性。
2) W的电荷比Ti4+的高,在TiO2的禁带中形成施主能级,该能级位于半导体导带底附近,这样电子受激发后,很容易转移到杂质能级上,光生电子的数目增加,提高光催化活性[34−36]。
3) 电荷比 Ti4+高的 W 原子会导致催化剂表面出现氧空穴,硫在焙烧去除过程中能导致次表层有氧缺陷产生,其均能够俘获光生电子,促进光生载流子分离,从而提高光催化活性[34−36]。
4) 催化剂表面的 SO42−也能捕获光生电子,实现空穴与电子的快速分离,生成 O·2−及·OH[37]。
5) 介孔 SO42−/0.002 5W-TiO2@SiO2光催化活性的提高可能还归结于和 W6+与 SO42−所产生的表面酸性,酸性表面对含未成对电子物质具有很强的亲和力,有利于对OH−、H2O及带有可极化官能团有机污染物的吸附[15,37]。此外,W 掺杂使得光催化剂具有较大的表面积与孔容、纯锐钛矿相及较长的可激发光波长均有利于提高光催化活性。

图9 不同样品的紫外光催化活性和可见光催化活性Fig. 9 Photocatalysis activity of samples under UV light (a)and visible light (b)
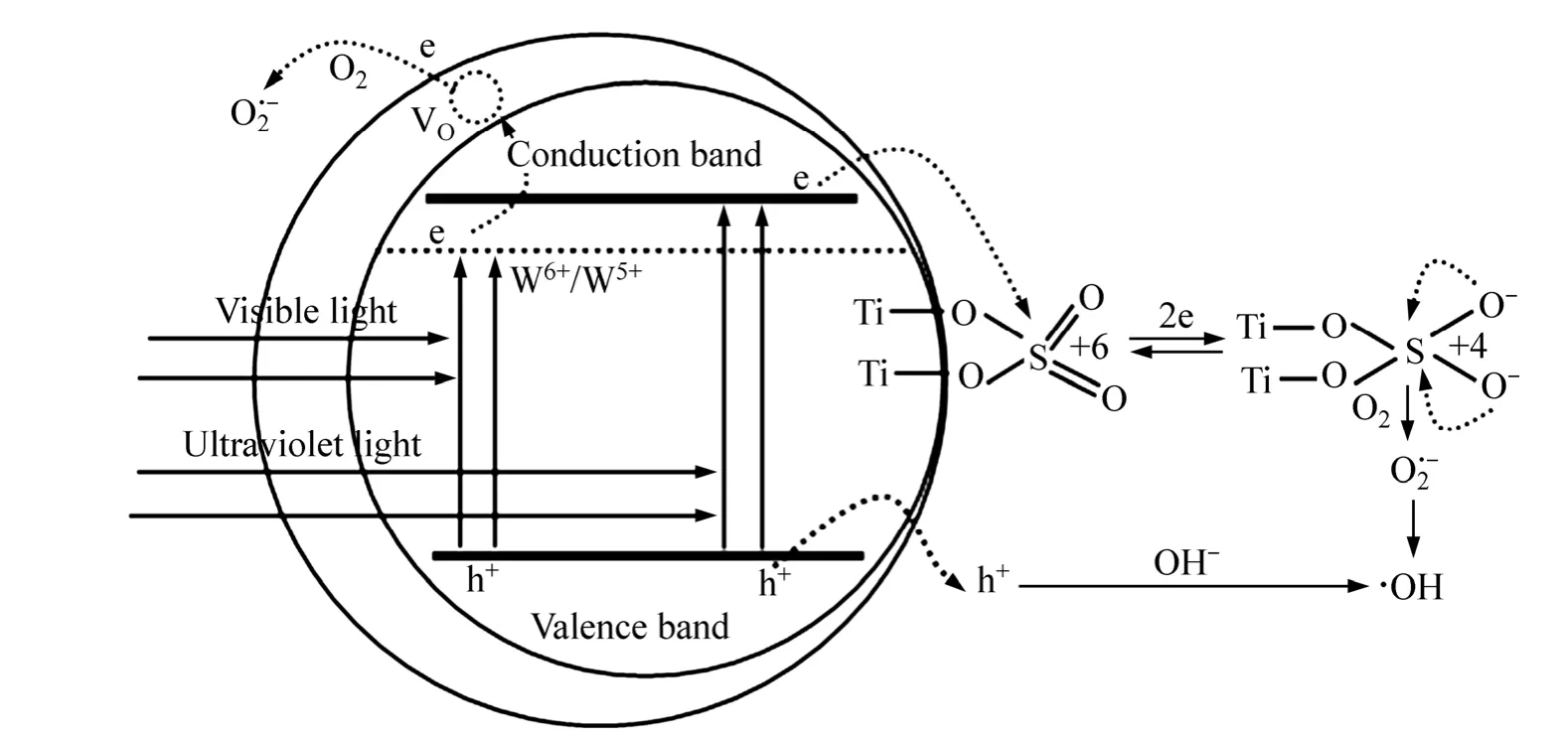
图10 SO42−/xW-TiO2@SiO2光催化机理Fig. 10 Photocatalytic mechanism of SO42−/xW-TiO2@SiO2
2.10 光催化剂的重复使用性能
光催化剂的稳定性也是衡量其光催化性能的重要指标。图 11所示为循环利用次数对介孔SO42−/0.002 5W-TiO2@SiO2紫外光催化剂性能的影响。由图11可以看出,经过几次重复使用后,紫外光催化性能没有明显的下降,使用5次后,光照60 min后甲基橙脱色率仍然保持在94.61%。这表明光催化剂具有较好的重复使用性能。
3 结论
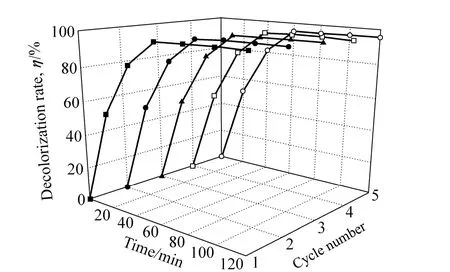
图11 循环次数对SO42−/0.002 5W-TiO2@SiO2紫外光催化性能的影响Fig. 11 Effect of cycle number on ultraviolet light photocatalytic activity of SO42−/0.002 5W-TiO2@SiO2
1) 以钛酸四丁酯为前驱体,以结构导向剂 P123为模板,通过溶胶凝胶法合成了可见光响应介孔SO42−/0.002 5W-TiO2@SiO2光催化剂。
2) 通过XRD、TEM、BET、XPS、UV-Vis和 FTIR表征后发现,W掺杂光催化剂不仅拓展光催化剂可激发光范围,还使之具有较大表面积及孔容、纯锐钛矿相、较高的光生电子空穴分离效率。
3) 介孔 SO42−/0.002 5W-TiO2@SiO2光催化剂的紫外与可见光催化活性均高于P25的,紫外光照射60 min后,甲基橙脱色率为98.89%;可见光照射40 h后,甲基橙脱色率为91.7%,且具有较好的重复使用性能。
[1]SHI Jian-Wen, CUI Hao-jie, ZONG Xu, CHEN Shao-hua,CHEN Jin-sheng, XU Bin, YANG Wei-ya, WANG Lian-zhou,FU Ming-lai. Facile one-pot synthesis of Eu, N-codoped mesoporous titania microspheres with yolk-shell structure and high visible-light induced photocatalytic performance[J].Applied Catalysis A: General, 2012, 435/436(5): 86−92.
[2]WANG Yong-zhong, ZHONG Ming-qiang, CHEN Fen, YANG Jin-tao. Visible light photocatalytic activity of TiO2/D-PVA for MO degradation[J]. Applied Catalysis B: Environmental, 2009,90(1/2): 249−254.
[3]许士洪, 赵松建, 谭东栋, 时鹏辉, 毕得福. 类蛋结构的可磁分离光催化剂纳米球的制备及催化性能[J]. 高等学校化学学报, 2012, 33(7): 1511−1516.XU Shi-hong, ZHAO Song-jian, TAN Dong-dong, SHI Peng-hui,BI De-fu. Preparation and photocatalytic properties of magnetically separable photocatalyst nanospheres with egg-like structure[J]. Chemical Journal of Chinese Universities, 2012,33(7): 1511−1516.
[4]WU Yong-mei, XING Ming-yang, ZHANG Jin-long, CHEN Fen.Effective visible light-active boron and carbon modified TiO2photocatalyst for degradation of organic pollutant[J]. Applied Catalysis B: Environmental, 2010, 97(1/2): 182−189.
[5]WU Yong-mei, ZHANG Jin-long, XIAO Ling, CHEN Fen.Properties of carbon and iron modified TiO2photocatalyst synthesized at low temperature and photodegradation of acid orange 7 under visible light[J]. Applied Surface Science, 2010,256(13): 4260−4268.
[6]MA Yun-fei, ZHANG Jin-long, TIAN Bao-zhu, CHEN Fen,WANG Ling-zhi. Synthesis and characterization of thermally stable Sm, N co-doped TiO2with highly visible light activity[J].Journal of Hazardous Materials, 2010, 182(1/3): 386−393.
[7]COUSELO N, GARCA EINSCHLAG F S G, CANDAL R J,JOBBGY M. Tungsten-doped TiO2vs pure TiO2photocatalysts: Effects on photobleaching kinetics and mechanism[J]. Journal of Physical Chemistry C, 2008, 112(4):1094−1100.
[8]CHOI E H, HONG S I, MOON D J. Preparation of thermally stable mesostructured nano-sized TiO2particles by modified sol-gel method using ionic liquid[J]. Catalysis Letter, 2008,123(1/2): 84−89.
[9]COLÓN G, HIDALGO M C, MUNUERA G, FARINA I,CUTRUFELLO M G, NAVÍO J A. Structural and surface approach to the enhanced photocatalytic activity of sulfated TiO2photocatalyst[J]. Applied Catalysis B: Environmental, 2006,63(1/2): 45−59.
[10]COLÓN G, HIDALGO M C, MACÍAS M, NAVÍO J A.Enhancement of TiO2/C photocatalytic activity by sulfate promotion[J]. Applied Catalysis A: General, 2004, 259(2):235−243.
[11]ANTONELLI D M, YING J Y. Synthesis of hexagonally packed mesoporous TiO2by a modified sol-gel method[J]. Angewandte Chemie International Edition in English, 1995, 34(18):2014−2017.
[12]FU Xian-zhi, CLARK L A, YANG Qing, ANDERSON M A.Enhanced photocatalytic performance of titania-based binary metal oxides: TiO2/SiO2and TiO2/ZrO2[J]. Environmental Science & Technology, 1996, 30(2): 647−653.
[13]张青红, 高 濂, 孙 静. 氧化硅对二氧化钛纳米晶相变和晶粒生长的抑制作用[J]. 无机材料学报, 2002, 17(3): 415−421.ZHANG Qing-hong, GAO Lian, SUN Jing. Retarding effect of silica on the growth and anatase to ruble transformation of TiO2nanocrystals[J]. Journal of Inorganic Materials, 2002, 17(3):415−421.
[14]LIU Song, GUO En-yan, YIN Long-wei. Tailored visible driven anatase TiO2photocatalysts based on controllable metal ion doping and ordered mesoporous structure[J]. Journal of Materials Chemistry, 2012, 22: 5031−5041.
[15]MUGGLI D S, DING Le-fei. Photocatalytic performance of sulfated TiO2and Degussa P-25 TiO2during oxidation of organics[J]. Applied Catalysis B: Environmental, 2001, 32(3):181−194.
[16]付贤智, 丁正新, 苏文悦, 李旦振. 二氧化钛基固体超强酸的结构及其光催化氧化性能[J]. 催化学报, 1999, 20(3): 321−324.FU Xian-zhi, DING Zheng-xin, SU Wen-yue, LI Dan-zhen.Structure of titania-based solid superacids and their properties for photocatalytic oxidation[J]. Chinese Journal Catalysis, 1999,20(3): 321−324.
[17]PERIYAT P, PILLAI S C, Mc CORMACK D E, COLREAVY J,HINDER S J. Improved high-temperature stability and sunlight-driven photocatalytic activity of sulfur-doped anatase TiO2[J]. Journal of Physical Chemistry C, 2008, 112(20):7644−7652.
[18]LEGHARI S A K, SAJJAD S, CHEN Fen, ZHANG Jin-long.WO3/TiO2composite with morphology change via hydro-thermal template-free route as an efficient visible light photocatalyst[J]. Chemical Engineering Journal, 2011, 166(3):906−915.
[19]SAJJAD A K L, SHAMAILA S, TIAN Bao-zhu, CHEN Fen,ZHANG Jin-long. One step activation of WOx/TiO2nano-composites with enhanced photocatalytic activity[J].Applied Catalysis B: Environmental, 2009, 91(1/2): 397−405.
[20]陈孝云, 陆东芳, 林淑芳. S掺杂S-TiO2/SiO2可见光响应光催化剂的制备及性能[J]. 催化学报, 2012, 33(6): 993−999.CHEN Xiao-yun, LU Dong-fang, LIN Shu-fang. Preparation and properties of sulfur doped visible light response S-TiO2/SiO2photocatalyst[J]. Chinese Journal Catalysis, 2012, 33(6):993−999.
[21]XIE Chao, YANG Qiu-jing, XU Zi-li, LIU Xing-juan, DU Yao-guo. New route to synthesize highly active nanocrystalline sulfated titania-silica: Synergetic effects between sulfate species and silica in enhancing the photocatalysis efficiency[J]. Journal of Physical Chemistry B, 2006, 110 (17): 8587−8592.
[22]GRÜLNERT W, BRÜLCKNER A, HOFMEISTER H, CLAUS P. Structural properties of Ag/TiO2catalysts for acrolein hydrogenation[J]. Journal of Physical Chemistry B, 2004,108(18): 5709−5717.
[23]KIM C S, SHIN J W, AN S H , JIANG H D, KIM T O.Photodegradation of volatile organic compounds using zirconium-doped TiO2/SiO2[J]. Chemical Engineering Journal,2012, 204/206: 40−47.
[24]CHENG P, DENG Chang-sheng, DAI Xia-ming, LI Bing, LIU Da-nian, XU Jing-ming. Enhanced energy conversion efficiency of TiO2electrode modified with WO3in dye-sensitized solar cells[J]. Journal of Photochemistry Photobiology A: Chemistry,2008, 195(1): 144−150.
[25]YU J C, HO W K, YU Jia-guo, YIP H, WONG P K, ZHAO Jin-cai. Efficient visible-light-induced photocatalytic disinfection on sulfur-doped nanocrystalline titania[J]. Environmental Science & Technology, 2005, 39(4): 1175−1179.
[26]WANG Ying, WANG Yan, MENG Yan-ling, DING Han-ming,SHAN Yong-kui. A highly efficient visible-light-activated photocatalyst based on bismuth- and sulfur-codoped TiO2[J].Journal of Physical Chemistry C, 2008, 112(17): 6620−6626.
[27]FERNANDEZ T, JOSE G , MATHEW S , REJIKUMAR P R,UNNIKRISHNAN N V. An ultra-low hydrolysis sol-gel route for titanosilicate xerogels and their characterization[J]. Journal of Sol-Gel Science and Technology, 2007, 41(2): 163−168.
[28]COLES M P, LUGMAIR C G, TERRY K W, TILLEY T D.Titania-silica materials from the molecular precursor Ti[OSi(OtBu)3]4: Selective epoxidation catalysts[J]. Chemistry of Materials, 2000, 12 (1): 122−131.
[29]MATINLINNA J P, AREVA S, LASSILA L V J, VALLITTU P K.Characterization of siloxane films on titanium substrate derived from three amino silanes[J]. Surface and Interface Analysis,2004, 36(9): 1314−1322.
[30]GOLÓN G, HIDALGO M C , NAVíO J A , KUBACKA A,FERNÁNDEZ-GARCÍA M. Influence of sulfur on the structural,surface properties and photocatalytic activity of sulfated TiO2[J].Applied Catalysis B: Environmental, 2009, 90(3/4): 633−641.
[31]YAMAGUCHI T. Recent progress in solid superacid[J]. Applied Catalysis, 1990, 61(1): 1−25.
[32]ZHAN Chang-chao, CHEN Fen, DAI Hong-hu, YANG Jin-tao,ZHONG Ming-qiang. Photocatalytic activity of sulfated Mo-doped TiO2@fumed SiO2composite: A mesoporous structure for methyl orange degradation[J]. Chemical Engineering Journal,2013, 225: 695−703.
[33]YANG Ying, TIAN Cong-xue. Effects of calcining temperature on photocatalytic activity of Fe-doped sulfated titania[J].Photochemistry Photobiology, 2012, 88(4): 816−823.
[34]吴道新, 陈启元, 李 洁, 尹周澜, 夏畅斌. 钨掺杂金红石型二氧化钛的光催化分解水析氧活性[J]. 中国有色金属学报,2010, 20(4): 730−735.WU Dao-xin, CHEN Qi-yuan, LI Jie, YIN Zhou-lan, XIA Chang-bin. Photocatalytic oxidation of water to O2over W-dopant of rutile TiO2[J]. The Chinese Journal of Nonferrous Materials, 2010, 20(4): 730−735.
[35]徐毓龙. 氧化物与化合物半导体基础[M]. 西安: 西安电子科技大学出版社, 1991: 212−222.XU Yu-long. Semiconductor basis on oxides and compounds[M].Xi’an: Xi’an University of Electronic Science and Technology Press, 1991: 212−222.
[36]李芳柏, 古国榜, 李新军, 万洪富. WO3/TiO2纳米材料的制备及光催化性能[J]. 物理化学学报, 2000, 16(11): 997−1002.LI Fang-bai, GU Guo-bang, LI Xin-jun, WAN Hong-fu.Preparation, characterization and photocatalytic behavior of WO3/TiO2nanopowder[J]. Acta Physico-Chimica Sinica, 2000,16(11): 997−1002.
[37]LI He-xing, LI Gui-sheng, ZHU Jian, WAN Ying. Preparation of an active SO42−/TiO2photocatalyst for phenol degradation under supercritical conditions[J]. Journal of Molecular Catalysis A:Chemical, 2005, 226(1): 93−100.

