JNK/MCP-1信号通路在姜黄素抗糖尿病神经病理性疼痛中的作用*
郑昌健, 胡 涵, 曹 红, 李 军
(温州医科大学附属第二医院麻醉科,疼痛医学研究所,浙江 温州 325027)
糖尿病是威胁人类健康的常见疾病,糖尿病神经病理性疼痛(diabetic neuropathic pain,DNP)是糖尿病最常见的慢性并发症之一,临床上以自发痛、诱发痛、痛觉过敏、痛觉超敏以及异常性疼痛为特征,严重影响患者生活质量[1]。c-Jun氨基末端激酶(C-Jun N-terminal kinase, JNK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)家族成员之一。趋化因子是一类能趋化细胞定向移动的小分子分泌蛋白,属于细胞因子中的最大家族,单核细胞趋化蛋白(monocyte chemoattractant protein 1,MCP-1)属于趋化因子CC亚家族,相关研究表明JNK/MCP-1信号通路是神经病理性疼痛的重要发生机制。姜黄素作为姜科植物中的一种酚性色素,具有抗炎、抗氧化等作用[2]。JNK/MCP-1信号通路在2型糖尿病神经病理性疼痛中的机制尚未见报道,本实验观察姜黄素对2型DNP痛阈的影响以及其减轻痛觉过敏的机制是否与JNK/MCP-1信号通路有关。
材 料 和 方 法
1 材料
姜黄素、玉米油和链脲佐菌素(streptozocin,STZ)购于Sigma;p-JNK多克隆抗体购于Cell Signaling Technology;兔抗MCP-1(H-190)购于Novus;2390型Electronic von Fery 触觉测痛仪及II Tc336型甩尾足底测试仪购自IITC;兔二步法试剂盒及DAB显色剂购自北京中杉金桥公司。
2 动物模型制备和实验分组
雄性SD大鼠,体重160~180 g,清洁级,由温州医学院实验动物中心提供,适应环境3 d后给予高脂高糖饲料(67%普通饲料+10%猪油+20%蔗糖+2%胆固醇+1%胆酸钠)。保持室温在20~25 ℃,湿度在40%~60%,于第0周、第8周分别测体重、血糖,并取尾静脉血测血清胰岛素和胰岛素敏感性。饲养8周后大鼠禁食12 h,再给予35 mg/kg 1% STZ溶液单次腹腔注射。3 d后测定大鼠尾静脉血糖,血糖稳定且≥16.7 mmol/L者入选,若血糖未达标,则再次追加STZ,3 d后测定大鼠尾静脉血糖。14 d后测大鼠痛阈,降低到基础值的85%以下者为2型糖尿病神经病理性痛大鼠模型组,否则剔除。采用随机数字表法,将2型糖尿病神经病理性痛大鼠随机分为(n=27):2型糖尿病神经病理性痛组(DNP组),不做任何处理;2型糖尿病神经病理性痛+姜黄素100 mg·kg-1·d-1组(Cur组);2型糖尿病神经病理性痛+溶剂玉米油4 mg·kg-1·d-1组(DSC组);2型糖尿病神经病理性痛+JNK抑制剂(10 μL/d、0.5 g/L)组(DJ组);2型糖尿病神经病理性痛+抑制剂溶剂(10% DMSO 10 μL/d)对照组(DJS组);2型糖尿病神经病理性痛+姜黄素(100 mg·kg-1·d-1)+MCP-1激动剂(10 μL/d、1 mg/L)组(DM组)。另取27只喂以普通饲料的大鼠作为正常对照组(C组)。各组连续给药14 d。
3 方法
3.1胰岛素敏感性指数(insulin sensitivity index,ISI)测定 在第8周时对照组和模型组大鼠,禁饮禁食12 h后测定其血糖值,同时通过尾静脉取血,利用胰岛素ELISA试剂盒测定其血清胰岛素水平。按照公式 1/空腹血糖×空腹计算胰岛素敏感性指数,此计算出的数值为非正态分布,故采用其自然对数进行计算。
3.2痛阈测定 在STZ注射前测定大鼠的机械缩足痛阈(mechanical withdrawal threshold, MWT)和热缩足潜伏期(thermal withdrawal latency, TWL)作为痛阈的基础值,在STZ注射2周后和各给药组的第3、7、14天测定机械缩足痛阈和热缩足潜伏期。
3.3机械缩足痛阈的测定 将大鼠置于底为金属筛网(1 cm×1 cm)的透明有机玻璃箱(22 cm×22 cm×22 cm)中,玻璃箱被架高于实验台面 50 cm。待大鼠在箱中适应15 min后,用IITC-2390 型Electronic von Fery触觉测痛仪垂直刺激大鼠双后趾,单次刺激时间≤ 1 s,刺激间隔10 s。记录测试时大鼠出现抬足或舔足行为时的刺激强度值,测5次取平均值即为其MWT。
3.4热缩足潜伏期测定 用IITC336甩尾足底测试仪于上述各时点测定TWL。将大鼠置于3 mm厚的玻璃板上,使用热辐射照射其后趾相应部位,记录从照射到缩爪回避的时间,每只大鼠双足各测5次,每次间隔5 min,取后3次的平均值即为其TWL。
3.5标本取材和处理 分别于注药后3 d、7 d、14 d随机选取3只各组的大鼠取其腰膨大和L4~6背根神经节(dorsal root gan-glion;DRG),并放入超低温冰箱中备用于Western blotting实验。另取3只各组大鼠麻醉后经心脏插管灌注4%多聚甲醛,取L4~6节段脊髓及DRG,固定后石蜡包埋,切片。
3.6Western blotting 利用BCA蛋白测试盒测出总蛋白。按照35 μg、15 μL每孔上样,10%聚丙烯凝胶电泳浓缩胶40 V,分离胶100 V分离,切胶后将相应分子量条带上的目的蛋白和内参照蛋白在300 mA条件下转到PVDF膜上,5%脱脂牛奶封闭2 h,再分别加入JNK抗体(1∶1 000)和GAPDH抗体(1∶1 000)中,4 ℃孵育过夜,次日取出条带用TBST洗膜3次,每次5 min,Ⅱ抗(1∶5 000)室温孵育2 h后用TBST洗膜(同前)、ECL曝光,采用AlphaEasefcTMSoftware进行分析,以目的蛋白/GAPDH的灰度比值作为目的蛋白表达的相对强度。
3.7ELISA测定目的蛋白 组织匀将用BCA试剂盒测定总蛋白,按照每孔200 mg的量与ddH2O配成100 μL总体积,稀释10倍后按照ELISA 说明书上的操作顺序进行操作。根据标准曲线计算实际浓度,以ng/L表示。所有A值都应减除空白值后再行计算。以标准品浓度为横坐标,A值为纵坐标,做出标准曲线。根据样品A值计算相应MCP-1含量,再乘以稀释倍数。
4 统计学处理
数据以均数±标准差(mean±SD)表示。2组间比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA),以最小显著差异法(LSD)行两两比较。用 SPSS 17.0统计软件处理,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠血糖、胰岛素敏感指数变化情况
与对照组比较,模型组大鼠的血糖在第8周后升高,但差异无统计学意义,未达到糖尿病诊断标准;空腹血糖浓度明显升高(P<0.05),但没达到糖尿病诊断标准;空腹胰岛素浓度明显升高(P<0.05)。胰岛素敏感性指数明显下降(P<0.05),见表1。

表1 对照组和模型组血糖、胰岛素和ISI的比较
2 各组MWT和TWL的变化
与基础值相比,DNP组、Cur组、DSC组、DJ组、DJS组和DM组在STZ注药的2周后MWT和TWL出现明显降低;与DNP组相比,Cur组和DJ组在分别给予姜黄素和JNK抑制剂7 d后MWT和TWL开始升高(P<0.05)。DM组在给予MCP-1激动剂后MWT和TWL明显下降(P<0.05),但与Cur组对比没有统计学意义。DSC组、DJS组与DNP组相比差异无显著,见表2。
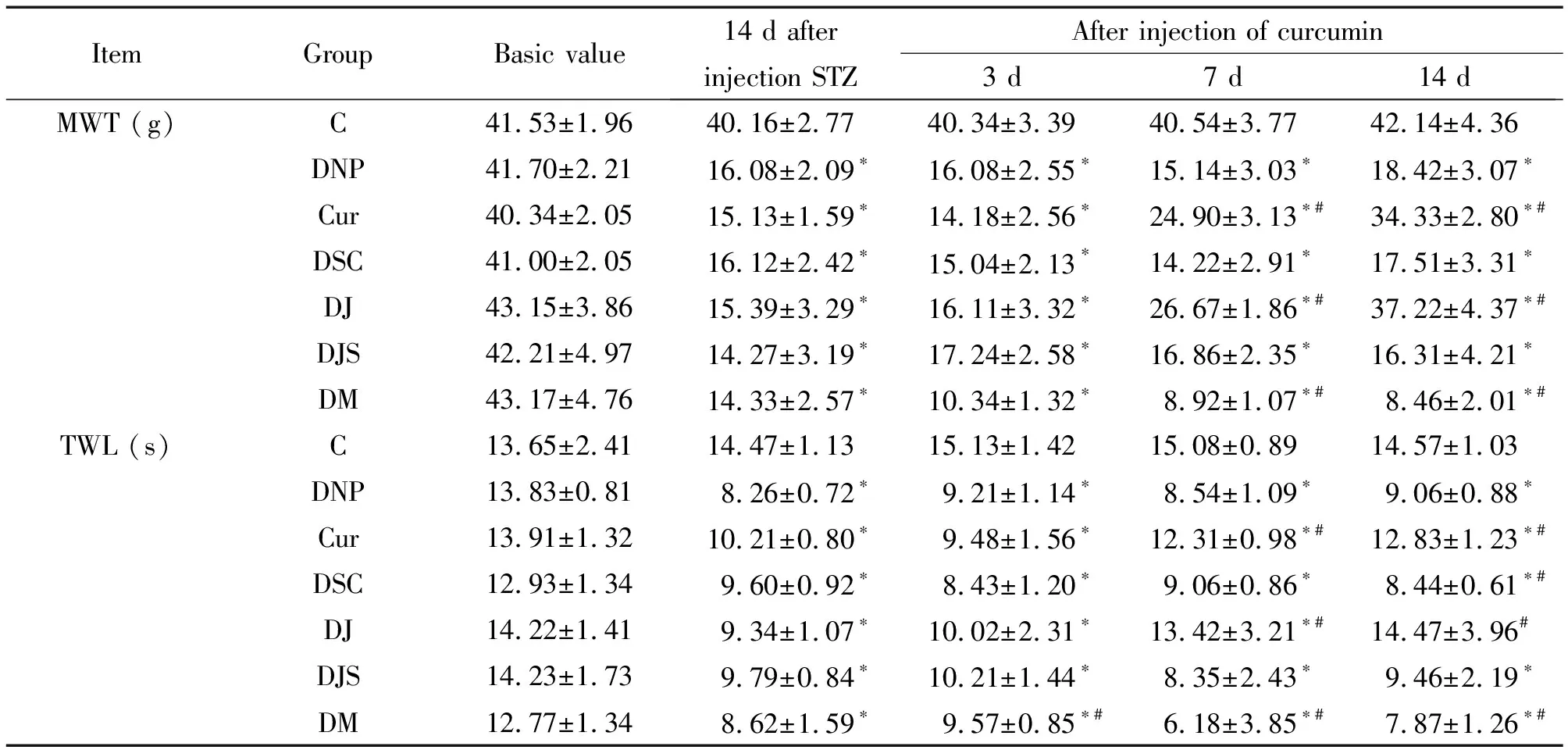
表2 各组大鼠不同时点TWL和MWT的变化
3 Western blotting检测脊髓背角和DRG中p-JNK的表达
与对照组相比,DNP组、Cur组、DSC组、DJ组、DJS组和DM组p-JNK表达升高(P<0.05);与DNP组相比,Cur组、DJ组、DM组在分别给予姜黄素和JNK抑制剂7 d、14 d时表达下降(P<0.05)。DSC组、DJS组与DNP组相比差异不显著,见图1、2。
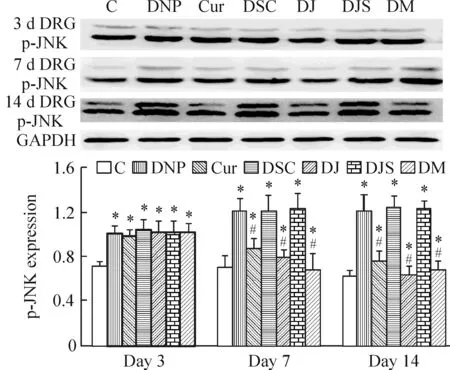
Figure 1. p-JNK expression in DRG detected by Western blotting.Mean±SD. n=6.*P<0.05 vs C group; #P<0.05 vs DNP group.
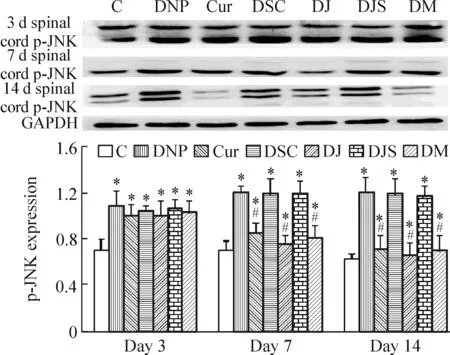
Figure 2. p-JNK expression in dorsal cord detected by Western blotting.Mean±SD. n=6.*P<0.05 vs C group; #P<0.05 vs DNP group.
4 ELISA法测定大鼠脊髓背角和DRG中MCP-1表达
与对照组相比,DNP组、Cur组、DSC组、DJ组、DJS组和DM组MCP-1表达升高(P<0.05);与DNP组相比,Cur组、DJ组在分别给予姜黄素和JNK抑制剂7 d、14 d时表达下降(P<0.05),DM组表达显著增高(P<0.05)。DSC组、DJS组与DNP组相比差异无显著,见图3、4。
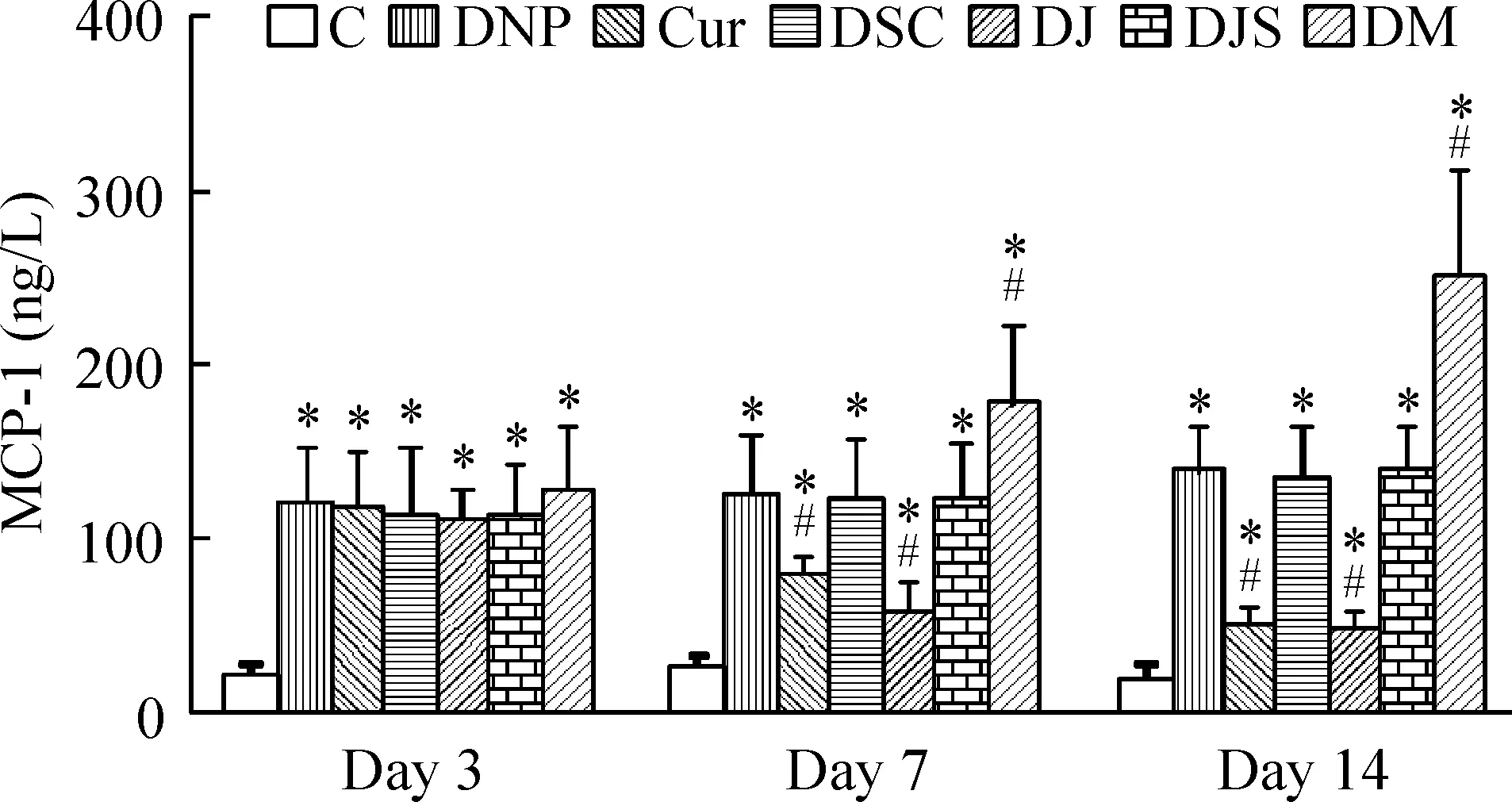
Figure 3. MCP-1 expression in DRG detected by ELISA.Mean±SD. n=6.*P<0.05 vs C group; #P<0.05 vs DNP group.
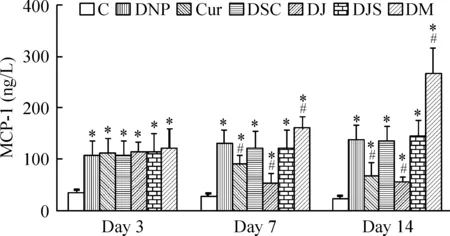
Figure 4. MCP-1 expression in dorsal cord detected by ELISA.Mean±SD. n=6.*P<0.05 vs C group; #P<0.05 vs DNP group.
讨 论
糖尿病神经病理性疼痛是糖尿病的一种常见并发症,主要表现为异常性疼痛、触诱发痛和痛觉过敏[3-4]。高糖、糖基化终末产物增加等因素所导致的氧化应激和线粒体功能损害,进而导致神经细胞和施旺细胞的凋亡[5-7],在DNP中起着重要作用。近年来对1型糖尿病所致的神经病变的研究已经取得一定进展,但2型糖尿病所致的神经病变的机制尚未明确。
JNK是MAPK家族成员。又称为“应激激活蛋白激酶”, 趋化因子是一类能趋化细胞定向移动的小分子分泌蛋白,属于细胞因子中的最大家族。MCP-1属于趋化因子CC亚家族。MCP-1主要通过受体CCR2实现其生物学效应,趋化因子受体可以激活不同的信号转导通路,例如MAPK途径、蛋白激酶C途径、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K))途径[8],从而导致不同的生物学效应。
神经损伤主要通过初级感觉神经元产生自发电位(异位冲动)和脊髓背角突触传递效率的持续性增强(LTP)导致病理性疼痛,研究表明TNF-α在神经病理性疼痛中起着重要作用,神经损伤可以激活JNK使转录因子c-Jun磷酸化从而促使细胞释放MCP-1、TNF-α等炎症介质,通过作用于脊髓背角及背根神经节上的趋化因子受体(CCR2)、肿瘤坏死因子受体(TNFR1、TNFR2),导致初级神经元上Na1.3和Na1.8过度表达引起异位冲动[9-11]。同时TNF-α还可以通过激活JNK从而激活瞬时受体电位香草酸亚型及兴奋性受体NAMD通道,引起胞内Ca2+升高,导致钙/钙调素依赖的蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinase Ⅱ, CaMKⅡ)自身磷酸化,从而使其发生自身激活,激活后的CaMKⅡ磷酸化突触后靶蛋白α-氨基羟甲恶唑丙酸、突触素Ⅰ、微管相关蛋白,使脊髓背角神经元敏感化和痛觉增强,参与LTP产生和维持[12],导致痛觉过敏。
这些都说明JNK/MCP-1信号通路在神经病理性疼痛的发病机制中发挥着重要作用。我们的研究显示正常情况下大鼠的脊髓和DRG中的p-JNK和MCP-1表达很少,但在STZ诱导后p-JNK、MCP-1表达明显升高,JNK抑制剂可以明显下调MCP-1的表达,但MCP-1激动剂不能使JNK表达升高,提示JNK/MCP-1的激活在糖尿病神经病理性疼痛的发生和发展中起着重要作用。姜黄素是从姜科姜黄属植物姜黄根茎中提取的一种酚性色素。姜黄素具有多方面药理作用,如抗炎、抗氧化、清除自由基、抗肿瘤及抗微生物等作用。近年来研究表明,姜黄素具有强大的抗氧化应激作用。相关研究表明,姜黄素可以抑制AP-1、NF-κB等核内因子的转位从而减少MCP-1的释放,从而起到缓解DNP的作用,同时姜黄素可以通过抑制TNF-α、IL-6等炎症物质的释放[2,13],来达到治疗DNP的目的。
本实验发现姜黄素可明显减轻2型糖尿病神经病理性痛大鼠痛觉过敏,且可使p-JNK和MCP-1表达相比糖尿病组发生明显下降,同时JNK抑制剂组中MCP-1出现下降,MCP-1激动剂组并没有出现JNK的增高,这些说明MCP-1可能是JNK的一个下游因子,故推测姜黄素治疗糖尿病神经病理性疼痛的机制可能与JNK/MCP-1信号通路有关系。抑制该通路可能成为治疗2型糖尿病神经病理性痛的一个新的研究方向。
[参 考 文 献]
[1] Van Acker K, Bouhassira D, De Bacquer D, et al. Prevalence and impact on quality of life peripheral neuropathy with or without neuropathic pain in type 1 and type 2 diabetic patients attending hospital outpatients clinics[J]. Diabetes Metab, 2009, 35(3):206-213.
[2] Sharma S, Kulkarni SK, Aqrewala JN, et al. Curcumin attenuates thermal hyperalgesia in a diabetic mouse model of neuropathic pain[J]. Eur J Pharmacol, 2006, 536(3):256-261.
[3] Boulton AJ, Malik RA, Arezzo JC, et al .Diabetic somatic neuropathies[J]. Diabetes Care, 2004, 27(6):1458-1486.
[4] Baron R. Peripheral neuropathic pain: From mechanism to symptom[J]. Clin J Pain, 2000, 16(4):S12-S20.
[5] Pop Busui R, Sima A, Stevens M. Diabetic neuropathy and oxidative stress[J]. Diabetes Metab Res Rev, 2006, 22(4):257-273.
[6] Kim JE, Kim AR, Chung HY, et al.Invitroperoxynitrite scavenging activity of diarylheptanodids fromCurcumalonga[J]. Phytotherap Res, 2003, 17(5):481-484.
[7] Yowtak J, Lee KY, Kim HY, et al. Reactive oxygen spcies contribute to neuropathic pain by reducing spinal GABA release[J]. Pain, 2011, 152(4):844-852.
[8] Tanaka T, Minami M, Nakagawa T. Enhanced production of monocyte chemoattractant protein-1 in the dorsal root ganglia in a rat model of neuropathic pain: possible involvement in the development of neuropathic pain[J]. Neurosci Res, 2004, 48(4):463-469.
[9] Wood JN, Boorman JP, Okuse K, et al. Voltage-gated sodium channels and pain pathways[J]. J Neurobiol, 2004, 61(1):55-71.
[10] Lai J, Glod MS, Kim CS, et al.Inhibition of neuropathic pain by decreased expression of the tetrodotoxin-resistant sodium channel NaV1.8[J]. Pain, 2002, 95(1-2):143-152.
[11] Gao YJ, Zhang L, Samad OA, et al. JNK-induced MCP-1 production in spinal cord astrocytes contributes to central sensitization and neuropathic pain[J]. J Neurosci, 2009, 29(13):4096-4108.
[12] Lin YL, Zhou LJ, Hu NW, et al. Tumor necrosis factor-alpha induces long-term potentiation of C-fiber evoked field potentials inspinal dorsal horn in rats with nerve injury[J]. Neuropharmacology, 2007, 52(3):708-715.
[13] 何伶俐,曹 红, 贺端端,等. 姜黄素对大鼠神经病理性痛的影响[J]. 中华麻醉学杂志, 2008, 28(9):790-793.

