五步蛇毒PCA改善脓毒症大鼠的血管低反应性*
包鹏举, 孙 瑶, 王海华, 张根葆, 胡钱国, 蒋佳珅
(皖南医学院 1生理学教研室, 2病理生理学教研室, 3蛇毒研究所,安徽 芜湖 241002; 4黄山市昌仁医院,安徽 黄山 245200)
脓毒症是由细菌和/或细菌产物感染和损伤引起的一种严重的临床综合征[1],病程中常引起高热、寒战、呼吸急促和意识改变等一系列临床症状,若不及时治疗可进一步恶化引起休克、弥散性血管内凝血(disseminatedintravascularcoagulation,DIC),进而诱发多系统功能衰竭综合症(multiplesystemandorganfailure,MSOF),致死率高,危害性大,严重影响人们的健康[2]。临床上现在除使用抗菌素及糖皮质激素作为常规治疗外,至今针对脓毒症的各种治疗手段尚未取得良好疗效[2-3],因此深入认识脓毒症的发病机制,并积极寻求相应的干预策略已成为研究的重要课题。皖南地区五步蛇(Agkistrodon acutus)的蛇毒蛋白C激活物(proteinCactivator,PCA)是从五步蛇毒粗毒中提纯的一种组分[4-6],具有防血栓、抑制血小板聚集、改善微循环等作用[7-8]。目前其对脓毒症大鼠血管张力的作用尚不清楚,机制亦不明了。为此,本实验通过复制实验性脓毒症大鼠模型,采用离体胸主动脉环灌流法,初步探讨五步蛇毒PCA对脓毒症大鼠血管张力的影响及作用机制,为临床治疗脓毒症提供新的理论依据。
材 料 和 方 法
1 主要试剂和仪器
五步蛇毒PCA冻干粉由皖南医学院蛇毒研究所提供;大肠杆菌脂多糖(lipopolysaccharide,LPS)、乙酰胆碱(acetylcholine,ACh)、硝普钠(sodium nitroprusside,SNP)、去氧肾上腺素(phenylephrine,Phe)、Nω-硝基-L-精氨酸甲酯(Nω-nitro-L-arginine methyl ester,L-NAME)和甲烯蓝(methylene blue,MB)均为Sigma产品;Krebs-Henseleit(K-H)液(mmol/L):NaCl 118、KCl 4.7、KH2PO41.2、MgSO4·7H2O 1.2、NaHCO325、CaCl22.25和glucose 5.5,均为国产分析纯。离体血管环灌流装置和Medlab-U/8c生物信号采集分析系统购自南京美易科技有限公司。
2 动物和分组
清洁级SD雄性大鼠36只,体重(220±30) g,由皖南医学院实验动物中心提供,动物合格证号为SCXK(苏)2009-0001,实验前于清洁级环境适应性喂养3 d。
大鼠随机分成假手术组(sham组)、模型组(LPS组)、PCA干预组(LPS +PCA组,分0.1 mg/kg、0.3 mg/kg、0.6 mg/kg剂量组)、阳性对照组使用多粘菌素B(polymyxin B,PMX-B) 0.2 mg/kg,(LPS+PMX-B组)。脓毒症模型复制成功后,LPS+PCA组、LPS+PMX-B组分别从尾静脉注入不同剂量同容量的PCA、PMX-B;LPS组则在复制脓毒症模型后从尾静脉注入同容量的生理盐水;sham组不复制脓毒症模型,仅从尾静脉注入同容量的生理盐水。
3 方法
3.1实验性脓毒症大鼠模型复制 SD雄性大鼠腹腔注射LPS(10 mg/kg,4 h)建立实验性脓毒症大鼠模型[8-9]。LPS处理2 h后,动物即表现出盘索成团、萎靡不振、腹泻、活动度低下并伴有发绀、震颤等症状;LPS处理4 h后,血压明显下降,但大鼠没有死亡,说明脓毒症的实验动物模型复制成功(不符合上述条件的大鼠不纳入实验组内,各实验组大鼠不足预订数额则通过随机抽样原则补齐)。
3.2大鼠血压和心脏血流动力学指标测定 20%乌拉坦生理盐水溶液(5 mL/kg)腹腔注射麻醉后,仰卧位固定,行右颈总动脉插管。经Medlab-U/8c生物信号处理系统描记颈总动脉平均动脉血压(mean arterial blood pressure,MABP);导管继续插入,至左心室,测定血流动力学相关指标:心率(heart rate,HR)、左室发展压(left ventricular developed pressure,LVDP)、心室内压最大上升/下降速率(maximal rise/fall velocity of ventricular pressure,±dp/dtmax)。监测各指标时先稳定30 min后,再记录20 min。
3.3离体主动脉环的制备与稳定[10]大鼠颈椎脱臼致死,迅速开胸,游离主动脉胸腹段,置于4 ℃氧饱和的K-H液平皿中,清除血污,仔细剔除周围结缔组织,剪成约3~4mm长的动脉环。避免过度牵拉,以防损伤血管。去除血管内皮时,用棉签磨擦血管环内表面以去除内皮细胞。主动脉环套入上下平行的两根不锈钢微型挂钩,水平悬挂于盛有10mLK-H液浴槽内,下方固定,上方以一细钢丝连于张力换能器,经Medlab-U/8c生物信号处理系统记录血管张力。主动脉环先以0g张力起步,平衡30min,逐步调节至最适初始张力1.5g并平衡1h。期间每15min换液1次,浴槽内持续通以 95%O2+5%CO2混和气体,并保持37 ℃恒温水浴。待稳定后,用60mmol/LKCl刺激收缩达峰值,然后用K-H液洗脱至基线,重复3次,以激发主动脉环最佳活性。待主动脉环重新稳定后浴槽内加入Phe(1×10-6mol/L),收缩达峰值稳定后,给予1×10-5mol/LACh,检验血管内皮完整性。若加ACh后可使Phe预收缩的血管舒张达60%~90%则可认为内皮完整;反之,则认为内皮被破坏[11]。
3.4主动脉环收缩与舒张功能的测定 分别观察:(1) 间隔5 min累积给予浓度为1×10-8~1×10-5mol/L Phe诱导主动脉环的收缩反应;(2) 间隔5 min累积给予Phe达1×10-8~1×10-5mol/L诱导去内皮主动脉环的收缩反应;(3) 用Phe(1×10-6mol/L)收缩主动脉环,待收缩稳定后间隔5 min累积加入浓度为1×10-8~1×10-4mol/L ACh诱导主动脉环内皮依赖性舒张反应;(4) 用Phe(1×10-6mol/L)收缩主动脉环,待稳定后观察间隔5 min累积加入浓度为1×10-9~1×10-6mol/L SNP诱导的主动脉环非内皮依赖性舒张反应;(5) 分别用1×10-4mol/L特异性一氧化氮合酶(nitric oxide synthase, NOS)抑制剂 L-NAME及1×10-5mol/L鸟苷酸环化酶(guanylate cyclase,GC)抑制剂MB预处理20 min后,观察间隔5 min累积加入浓度为1×10-8~1×10-5mol/L Phe诱导的主动脉环收缩反应。以上每一轮实验完成后用K-H液反复冲洗3~5次,直至主动脉环张力恢复到实验前的基础水平才开始下一轮实验[10]。记录主动脉环收缩幅度,并计算血管收缩率(vascular contraction rate,VCR)。VCR(%)=(累加Phe后的主动脉环收缩张力-最适初始张力)/空白组最大收缩张力平均值×100%。血管舒张率(%) = (加Phe后的主动脉环收缩张力-累加ACh 后的血管张力)/(加Phe后的血管最大收缩张力-基础血管张力)×100%[10]。
4 统计学处理
用SPSS 16.0统计软件处理数据,计量资料用均数±标准差(mean±SD)表示,多组均数比较使用单因素方差分析(One-way ANOVA),两两比较用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 MABP和血流动力学的变化
LPS组大鼠MABP与sham组比明显下降(P<0.01);PCA干预后大鼠MABP则显著升高(P<0.05)。同sham组比较,LPS组大鼠HR、LVDP、±dp/dtmax均明显下降(P<0.01)。LPS+PCA组左心室血流动力学各指标均有明显升高(P<0.05),心肌收缩力显著改善;但与sham组比较, 仍有明显差异(P<0.05),见表1。
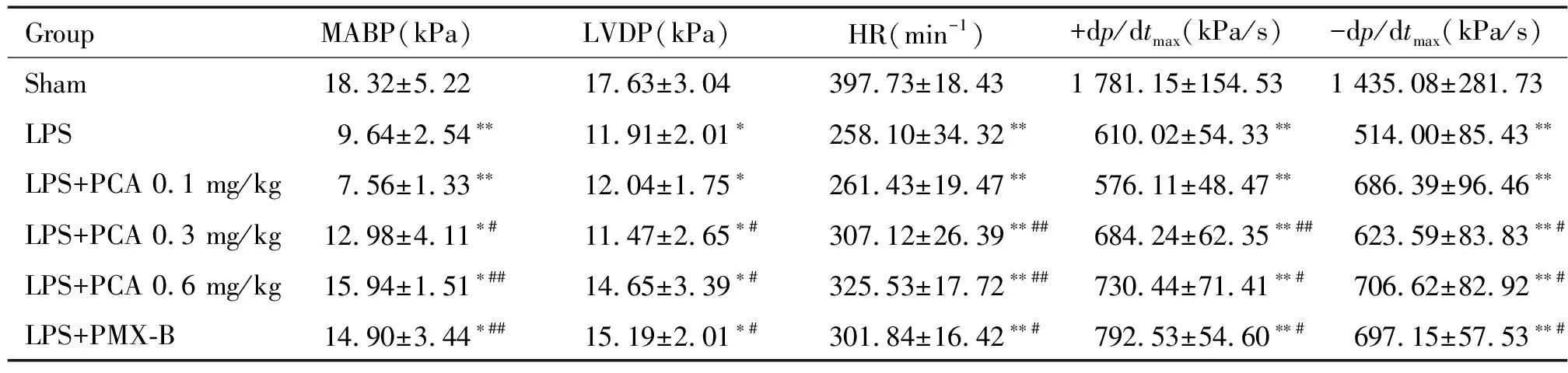
表1 各组大鼠MABP和血流动力学指标的改变
*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vsLPS group.
2 PCA对Phe引起主动脉环收缩反应的影响
LPS组主动脉环对Phe刺激的收缩反应量效曲线比sham组明显下降(P<0.01);PCA干预组(尤其是0.6 mg/kg剂量组)的主动脉环对Phe刺激的收缩量效曲线显著高于LPS组(P<0.01),见图1。
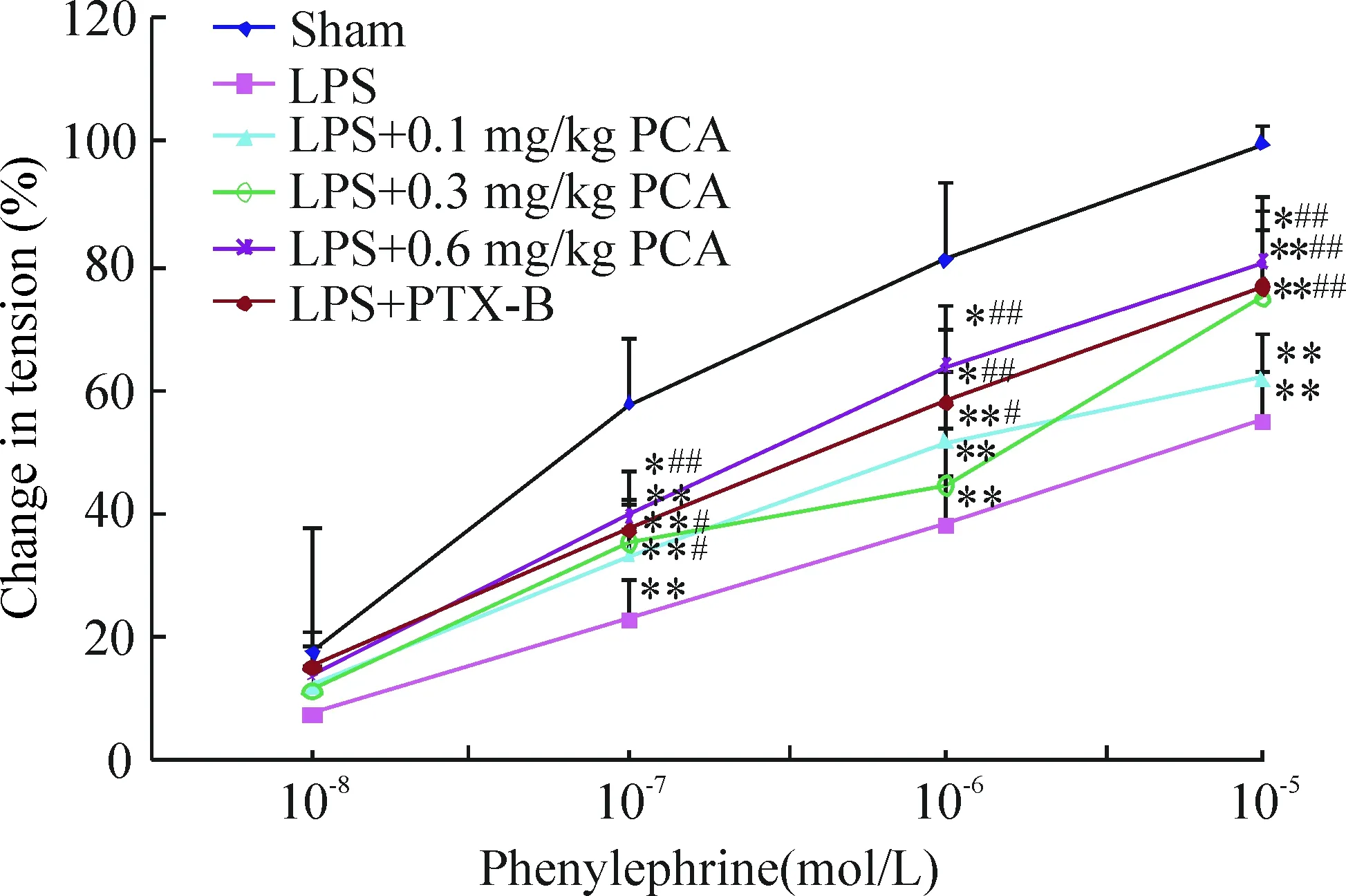
Figure 1. Effects of phenylephrine (1×10-8~1×10-5 mol/L) on the tension of the rat aorta rings. Mean±SD. n=6. *P<0.05, ** P<0.01 vs sham group; #P<0.05, ##P<0.01 vs LPS group.
3 PCA对Phe引起去内皮主动脉环收缩反应的影响
同sham组比较,LPS组去内皮主动脉环对Phe刺激的收缩反应量效曲线显著降低(P<0.01);而LPS+PCA组去内皮主动脉环对Phe的收缩反应与LPS组相比则无显著差异(P>0.05),见图2。
4 PCA对ACh引起主动脉环舒张反应的影响
LPS组主动脉环对ACh引起的内皮依赖性舒张反应较sham组明显降低(P<0.01),PCA干预组(尤其是0.6 mg/kg剂量组)对1×10-4mol/L ACh诱导的舒张反应较LPS组显著增加(P<0.01),见表2。
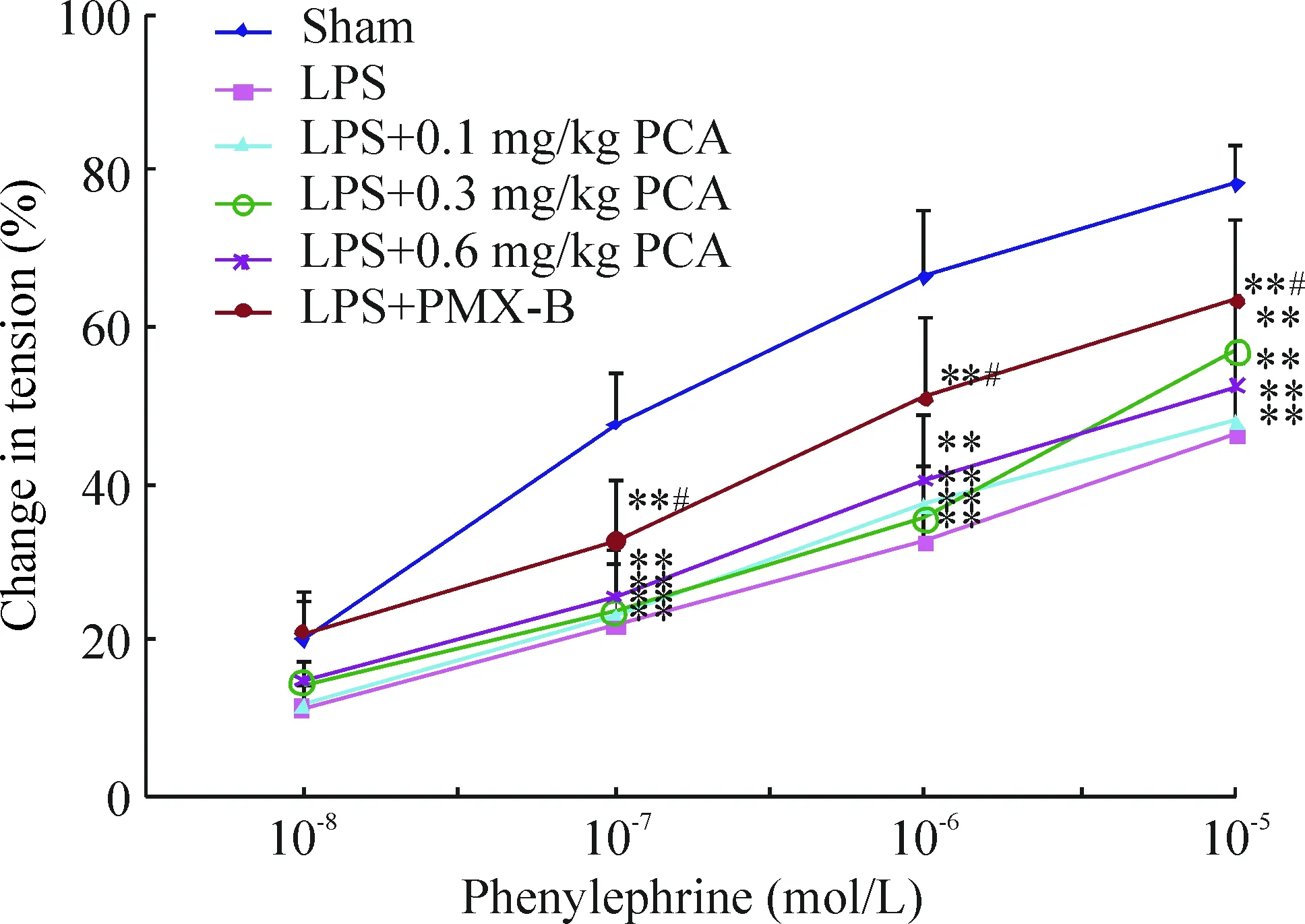
Figure 2. Effects of phenylephrine (1×10-8~1×10-5 mol/L) on the tension of the rat aorta rings with endothelium denudation. Mean±SD. n=6. *P<0.05, ** P<0.01 vs sham group; #P<0.05, ##P<0.01 vs LPS group.
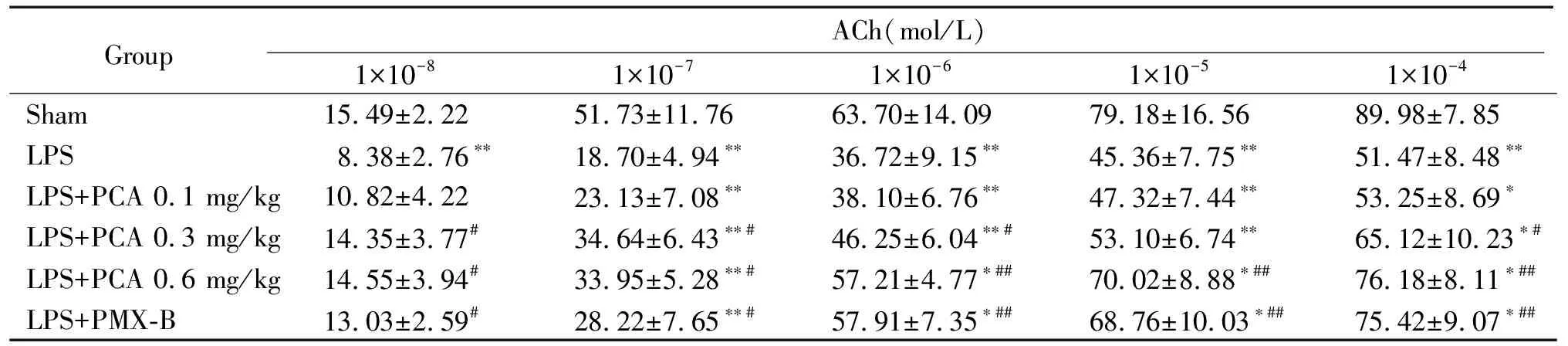
表2 各组大鼠主动脉环对ACh诱导的舒张反应
*P<0.05,**P<0.01vssham group;#P<0.05,##P<0.01vsLPS group.
5 PCA对SNP引起主动脉环舒张反应的影响
用1×10-6mol/L Phe收缩主动脉环,待稳定后观察间隔5 min累积加入浓度为1×10-9~1×10-6mol/L SNP诱导主动脉环非内皮依赖性舒张反应。各组主动脉环对SNP诱导的舒张反应无明显差异(P>0.05),见表3。
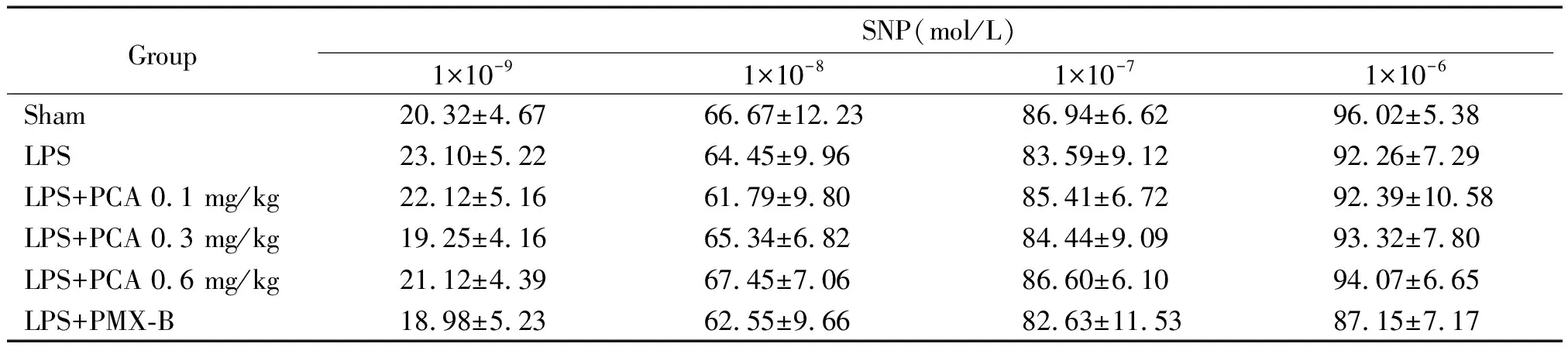
表3 各组大鼠主动脉环对SNP诱导的舒张反应
6 不同抑制剂预处理后主动脉环对Phe刺激的收缩反应
经L-NAME(1×10-4mol/L)和MB(1×10-5mol/L)预处理20 min后,各组主动脉环对Phe诱导的收缩幅度均有所升高。但L-NAME或MB预处理前后相比较,PCA干预组(0.6 mg/kg)对1×10-5mol/L Phe诱导的收缩幅度的差值同sham组相比无显著差异(P>0.05),却明显低于LPS组(P<0.05),见表4、5。

表4 主动脉环经L-NAME预处理后对Phe刺激的收缩反应
△△P<0.01vssham;□□P<0.01vsLPS;○P<0.05,○○P<0.01vsLPS+0.1 mg/kg PCA;▲P<0.05,▲▲P<0.01vsLPS+0.3 mg/kg PCA;■P<0.05,■■P<0.01vsLPS+0.6 mg/kg PCA;●●P<0.01vsLPS+PMX-B;*P<0.05,**P<0.01vssham+L-NAME;#P<0.05vsLPS+L-NAME.
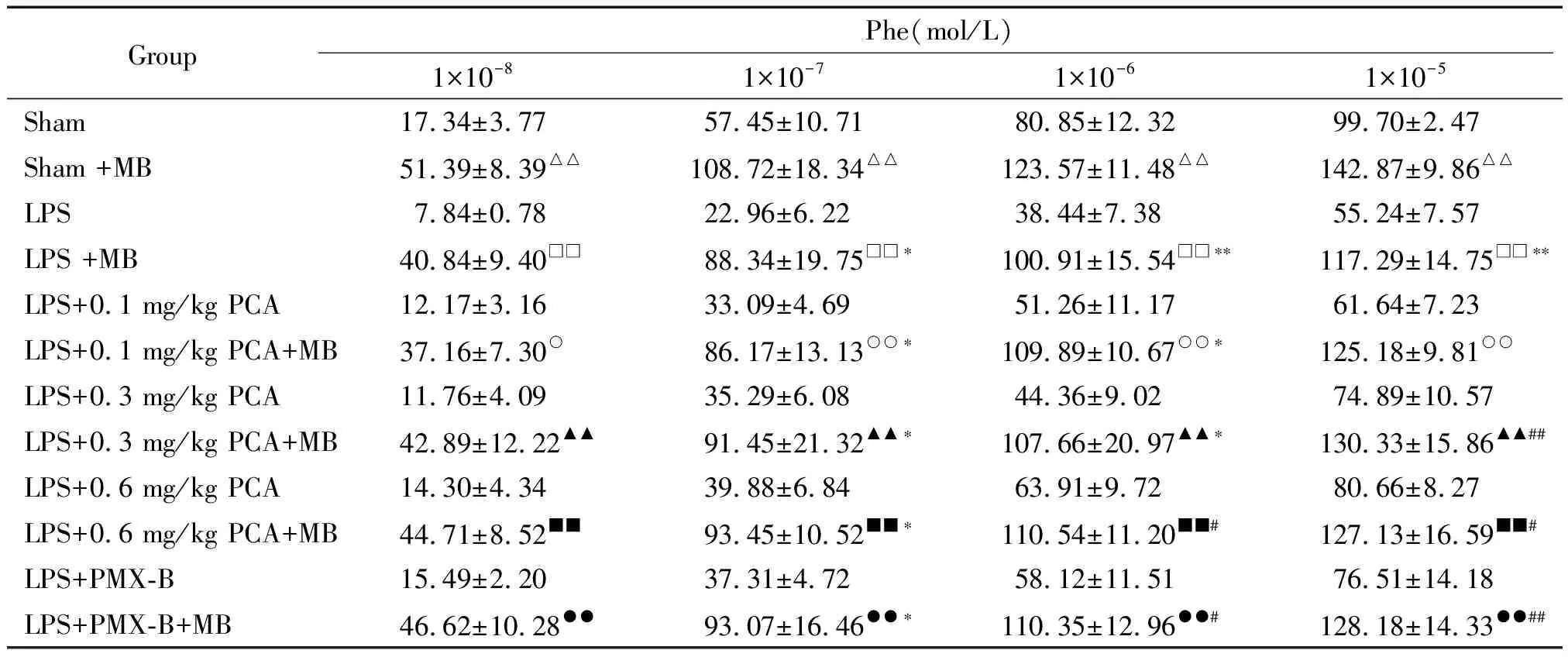
表5 主动脉环经MB预处理后对Phe刺激的收缩反应
△△P<0.01vssham;□□P<0.01vsLPS;○P<0.05,○○P<0.01vsLPS+0.1 mg/kg PCA;▲▲P<0.01vsLPS+0.3 mg/kg PCA;■■P<0.01vsLPS+0.6 mg/kg PCA;●●P<0.01vsLPS+PMX-B;*P<0.05,**P<0.01vssham+MB;#P<0.05,##P<0.01vsLPS+MB.
讨 论
脓毒症病情凶险,病死率高,临床治疗困难,已成为现代危重病医学面临的突出难题[12]。尽管现代医学对疾病的研究方法有了很大进步,但在对脓毒症的临床治疗上,仅是包括使用抗生素、清除感染等常规支持疗法[1],并未取得突破性的进展。
目前对脓毒症发病机制的研究归益于多种动物实验模型的建立,主要有直接注射外源毒素(LPS、zymogen等)、盲肠结扎穿孔法(ceacal ligation and puncture,CLP)、腹腔包埋污秽物等[9],而众方法中又以注射LPS最为常用,可以在短时间内使模型动物达到脓毒症晚期,且方法简单方便有效[13]。本实验通过腹腔注射LPS建立实验性脓毒症大鼠模型。实验证实,LPS处理4 h后,大鼠的MABP、HR、LVDP、±dp/dtmax等心功能指标较sham组均明显降低,这与临床脓毒症的发展特征十分吻合[14]。
脓毒症发生时的主要特征表现为全身血压不可逆性降低,而血管张力的调节无疑是参与血压调节的众多因素中主要因素之一。故本实验采用离体血管灌流法,初步探讨五步蛇毒PCA对脓毒症大鼠血管张力的影响及其可能机制。
既往研究[5-8]证实本实验室前期从五步蛇毒粗毒中已提纯出蛋白C 激活剂组分,具有抗血栓、改善微循环等效应,但目前其对血管作用机制研究尚未见相关报道。本研究中离体主动脉环灌流实验结果显示,LPS+PCA组主动脉环对Phe刺激的收缩反应量效曲线比LPS组明显升高,而在去除主动脉环内皮后则与LPS组无显著差别。通常情况下由血管内皮细胞上的M受体介导的血管舒张作用总是强于血管平滑肌细胞M受体介导的血管收缩作用,因此只要内皮存在时ACh总是引起血管舒张,血管内皮损伤时ACh的舒张作用就会减弱[15]。本实验发现,LPS组主动脉环对ACh内皮依赖性舒张反应明显降低,而经PCA干预(特别是0.6 mg/kg剂量组)主动脉环对ACh舒张反应较LPS组显著增加;另外,实验还观察到各组主动脉环对累积浓度的SNP非内皮依赖性舒张反应均无明显差异。由此可推测五步蛇毒PCA可通过保护血管内皮功能改善脓毒症大鼠血管低反应性。
为进一步阐明PCA改善脓毒症血管低反应性的作用机制,实验分别使用一氧化氮合酶抑制剂L-NAME、GC抑制剂MB预处理主动脉环。一般认为,血管内皮细胞通过NOS催化L-精氨酸与氧结合后释放NO,NO激活细胞GC,活化的GC使三磷酸鸟苷(guanosine triphosphate,GTP)转变为环磷酸鸟苷(cyclie guanosine monophosphate,cGMP),使细胞内cGMP水平升高,继而激活cGMP依赖性的蛋白激酶PKG,使细胞内Ca2+浓度降低,促使肌球蛋白轻链脱磷酸化,平滑肌松弛,血管舒张[15-16]。LPS及其诱导产生的细胞因子刺激NOS过量表达,继而生成高浓度NO,在体内发挥负性肌力作用,尤其是可通过NO-GC-cGMP通路降低平滑肌细胞游离钙的水平,介导血管的低反应性[15]。实验结果发现,各组大鼠主动脉环经L-NAME、MB预处理后对Phe刺激的收缩反应均有不同程度升高,尤其是LPS组主动脉环收缩明显增强。但L-NAME预处理组与未处理组比较,0.6 mg/kg PCA干预组主动脉环对1×10-5mol/L Phe引起的收缩幅度的差值显著低于LPS组,提示PCA可明显降低由LPS诱导的NOS过量表达,继而也相应减少NO过量生成。再者,MB预处理前后比较,LPS组主动脉环收缩反应升高幅度的差值同样也明显高于sham组,PCA干预组则和sham组无显著差异,这也说明LPS组主动脉环通过NO-GC-cGMP途径对NO的敏感性较sham组高,而PCA可经NO-GC-cGMP通路降低对NO的敏感性,增强主动脉平滑肌的收缩反应,继而逆转脓毒症发生时由血管低反应性引起的低血压。
综上所述,本实验认为五步蛇毒PCA对脓毒症大鼠血管内皮功能有保护作用,通过抑制NO-GC-cGMP信号通路,防止iNOS过度活化及NO的过量生成,从而改善脓毒症大鼠血管的低反应性,至于其确切机制尚需进一步研究。
[参 考 文 献]
[1] 莫 冰,刘占国,常 平.细胞外组蛋白对脓毒症的影响[J].中华危重病急救医学,2014,26(3):204-205.
[2] Shiramizo SC, Marra AR, Durão MS, et al. Decreasing mortality in severe sepsis and septic shock patients by implementing a sepsis bundle in a hospital setting[J]. PLoS One, 2011, 6(11):e26790.
[3]StevensJH,O’HanleyP,ShapiroJM,etal.Effectsofanti-C5aantibodiesontheadultspiratorydistresssyndromeinsepticprimates[J].JClinInvest, 1986, 77(6):1812-1816.
[4] 张根葆,张 毅,孔 岩,等.五步蛇毒蛋白C激活剂的纯化与活性分析[J].蛇志, 2008,20(4):249-251.
[5] 孙 瑶,张根葆,吴 娟.影响五步蛇毒蛋白C激活剂酰胺酶活性的实验因素[J].皖南医学院学报, 2010, 29(6):409-411.
[6] 孙 瑶,包鹏举,张根葆.毛细管区带电泳分析五步蛇毒蛋白C激活剂和蛋白C的相互作用[J].色谱, 2013, 33(1):59-63.
[7] 张根葆,陈冬云,周志泳,等.蝮蛇毒蛋白C激活物的纯化与抗血小板活性[J].皖南医学院学报,2005, 24(1):8-10.
[8] 王海华,许 敏,张 翠,等.蝮蛇毒蛋白C激活物对败血症大鼠心脏血流动力学的作用研究[J].皖南医学院学报, 2007, 26(4):247-249.
[9] 汤耀卿,李 磊.脓毒症动物模型制作方略及应用[J].中华实验外科志, 2011, 23(12):1433-1434.
[10] 王海华,闵志雪,戚仁斌,等.iNOS-GC-cGMP信号活化参与了内毒素血症大鼠血管低反应性的发生机制[J].中国病理生理杂志, 2012, 27(6):1076-1081.
[11] 包鹏举,戚仁斌,王海华,等.银杏达莫注射液对高钾血症大鼠离体血管张力的影响[J].中国病理生理杂志,2011, 22(1):52-55.
[12] 杨 睿,王东强,李志军.盲肠结扎穿刺大鼠脓毒症模型改良[J].中外医疗, 2014, 33(5):37-39.
[13]BarbeiroHV,BarbeiroDF,DebbasV,etal.Purinenucleotidesreducesuperoxideproductionbynitricoxidesynthaseinamurinesepsismodel[J].BrazJMedBiolRes, 2009, 42(11):1050-1057.
[14] Sessler CN, Perry JC, Varney KL. Management of severe sepsis and septic shock[J]. Curr Opni Crit Caer, 2004, 10(5):354-363.
[15] 韩启德,文允镒.血管生物学[M].第1版.北京:北京医科大学中国协和医科大学联合出版社,1997:74-79.
[16] Tanaka Y, Koike K, Toro L. MaxiK channel roles in blood vessel relaxations induced by endothelium-derived relaxing factors and their molecular mechanisms[J]. J Smooth Muscle Res, 2004, 40(45):125-153.

