抗-HCV ELISA试剂评估结果分析
范文成,涂林,张宁宁,朱容,谭寒玉,陈素琼(绵阳市红十字中心血站,绵阳 621000)
·论 著·
抗-HCV ELISA试剂评估结果分析
范文成,涂林*,张宁宁,朱容,谭寒玉,陈素琼
(绵阳市红十字中心血站,绵阳 621000)
目的 用酶联免疫吸附试验(ELISA)的双抗原夹心法和间接法检测抗-HCV,并对不同检测方法的试剂进行评估。方法 用1种双抗原夹心法和4种间接法检测抗-HCV血清盘和不同浓度的室内质控品,严格按试剂说明书在Xantus全自动加样仪和FAME全自动酶免分析仪中进行检测。结果 经用不同的ELISA法检测抗-HCV后,血清盘中阴性参考品符合率均为20/20,阳性参考品符合率均为20/20。双抗原夹心法灵敏度高,0.05 NCU/mL的室内质控品能完全检测出来,间接法最低检出为0.5 NCU/mL,间接法的10个单试剂阳性标本用双抗原夹心法和RIBA确认法检测全部为阴性。结论 双抗原夹心法的抗-HCV ELISA试剂灵敏度和特异性均优于间接法。
抗-HCV;ELISA;试剂评估
丙型肝炎是一种主要经过血液和性传播的传染病。1989年美国学者Choo等[1]首次从受感染的黑猩猩血液标本中分离出丙型肝炎病毒(HCV)。据报道[2],全球现有1.3亿~1.7亿人口感染了HCV。我国丙型肝炎感染高发时间在20世纪80年代末至90年代初。流行病学调查[3]显示,我国人群HCV抗体阳性率约3.2%。目前仍无有效疫苗预防丙型肝炎的感染,而主要通过增加检测试剂的敏感性和特异性,来减少丙型肝炎的血液传播。酶联免疫吸附试验(ELISA)法特异性强,灵敏度高,数据能自动储存,且便于标准化、自动化和网络化[4],因而广泛应用于血液筛查和临床检测。但ELISA法检测抗-HCV仍采用间接法进行,而间接法检测假阳性率高,尤其是在丙型肝炎低流行人群中,假阳性率达到30%,给个人和社会造成了不必要的疾病负担[5]。为此,建立一种不降低检测敏感性但可增加特异性的方法就显得尤为必要。本文旨在用ELISA双抗原夹心法和间接法检测抗-HCV,评估和比较其灵敏度和特异性,现将结果报道如下。
1 材料与方法
1.1 试剂
抗-HCV双抗原夹心法试剂1家,用A1表示;抗-HCV间接法试剂4家,分别用A2(进口试剂)、A3、A4、A5表示;RIBA确认法用A6表示。试剂均经中国药品生物制品检定所批检合格,并在有效期内使用。
1.2 标本
北京康彻思坦生物技术有限公司参考血清盘40支,批号201304004;北京康彻思坦生物技术有限公司室内质控品(含量4 NCU/mL、2 NCU/mL、1 NCU/mL、0.5 NCU/mL和0.05 NCU/mL)各10支;留取2013年1~12月抗-HCV单试剂阳性标本10份。
1.3 仪器设备
Xantus全自动加样仪,FAME2420全自动酶免分析系统,Liswell实验室软件。
1.4 方法
在Xantus全自动加样仪、FAME全自动酶免分析仪上按照抗-HCV双抗原夹心法检测规程和试剂说明书进行编程。在Xantus标本架上放置检测样品,分别放血清盘标本和康彻思坦不同浓度的室内质控品。经Xantus全自动加样处理后,移至FAME全自动酶免分析仪进行自动孵育、洗板、加试剂等处理。最后,Liswell实验室软件读取检测结果。抗-HCV单试剂阳性标本用不同试剂进行检测,用RIBA法确认。
2 结果
2.1 5种抗-HCV ELISA试剂血清盘检测情况
使用血清盘检测5种抗-HCV ELISA试剂,血清盘中有20个阴性,20个阳性,并且在NS4、NS5、NS3、C区有不同强度的阳性标本。结果显示:血清盘阴性、阳性符合率均为20/20;弱阳性标本检测,间接法的几种试剂OD值均为1.0以下,但双抗原夹心法的抗-HCV试剂OD值全部在2.5以上(见表1)。
2.2 室内质控品检测结果
用不同含量的室内质控品重复测定,根据S/CO均值选择弱阳性的室内质控。双抗原夹心法的抗-HCV试剂用0.05 NCU/mL含量质控品,S/CO均值在2~4之间;其他国产试剂间接法需用0.5 NCU/mL含量的质控品,S/CO均值在2~4之间;进口试剂需选用2 NCU/mL含量的质控品(见表2)。
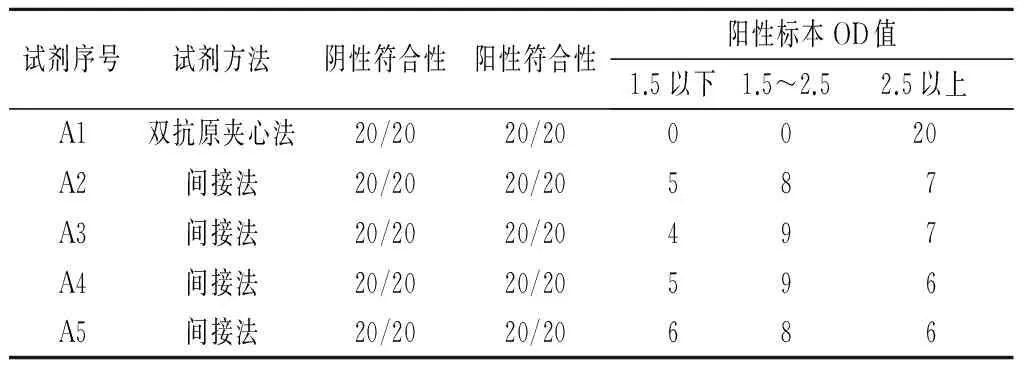
表1 5种抗-HCV ELISA试剂血清盘检测情况
2.3 10份抗-HCV单试剂阳性标本检测结果
用抗-HCV单试剂阳性标本10份,间接法试剂检测A2试剂有3个阳性,A3试剂有4个阳性,A4试剂有2个阳性,A5试剂有1个阳性;用双抗原夹心法与RIBA确认法检测全部为阴性(见表3)。
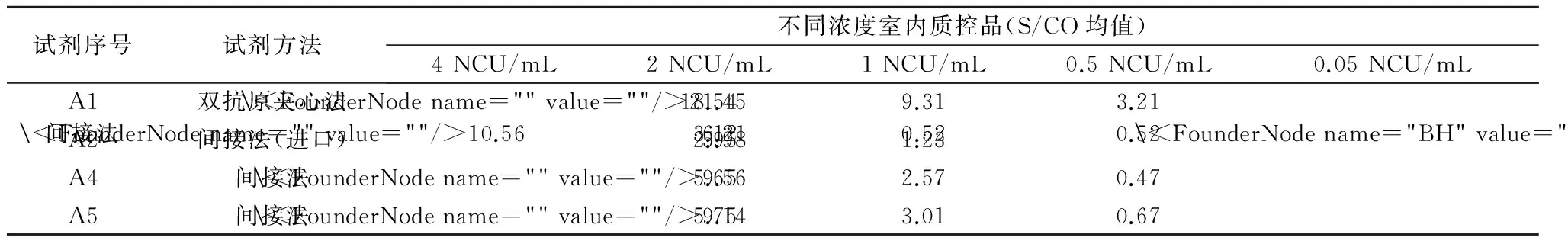
表2 室内质控品检测结果
表中的“”为:未检测
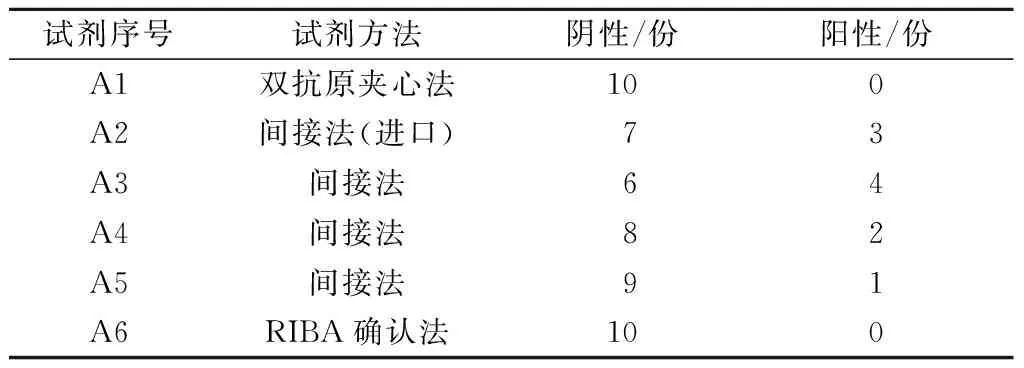
表3 10份抗-HCV单试剂阳性标本检测结果
3 讨论
表1血清盘的检测数据显示:本次评估确认的5种试剂中,参考血清盘的阴性符合率为100%,阳性符合率也为100%;参考血清盘中确认结果阳性中NS4、NS5、NS3显示为“±”;间接法的几种试剂OD值均为1.0以下,但双抗原夹心法的抗-HCV试剂OD值全部在2.5以上;参考血清盘中的弱阳性全部检测出来,且都为强阳性。因此,血站在选择酶免诊断试剂时,首先应以参考品试验为依据,注重试剂的灵敏度和特异性,以防止弱阳性标本漏检和阴性标本误判为阳性[6]。
表2室内质控品的检测结果显示:双抗原夹心法的抗-HCV试剂灵敏度较高,用0.05 NCU/mL含量质控品,S/CO均值在2~4之间,相当于其他国产试剂间接法0.5 NCU/mL含量的质控品,提示在选择试剂的室内质控品浓度时,不能只有1种室内质控品供所有试剂使用[7]。使用双抗原夹心法的抗-HCV试剂仅能选用0.05 NCU/mL含量质控品,如果选用1 NCU/mL、0.5 NCU/mL含量质控品,就起不到用弱阳性做室内质控的作用。进口试剂由于包被片段的原因,可选用2 NCU/mL含量质控品,其他国产间接法试剂可选用0.5 NCU/mL含量质控品。这对下一步开展常规检测时如何选择室内质控品具有重要指导意义。
表3显示:双抗原夹心法的特异性较高,用双抗原夹心法检测全部为阴性,RIBA法确认也全部为阴性,与王国华等[8]报道符合。由于双抗原夹心法检测存在两次与HCV抗体的特异性反应,可降低因酶标二抗引起的假阳性,从而提高特异性。
使用高质量的试剂,能有效保证血液的质量和临床用血安全。2010年10月国家食品药品监督管理局(SFDA)将用于血筛的ELISA试剂全部从一步法改为两步法,孵育时间延长,从而提高了试剂的灵敏度[9]。目前,双抗原夹心法的抗-HCV试剂上市使用,是ELISA检测抗-HCV又一大质的飞跃。其主要优势体现在以下方面:1)在间接法检测IgG的基础上,增加了IgM检测,因IgM是早于IgG出现的抗体,这样窗口期提前了7~30 d(不同病例有差异);另外,由于增加了IgM检测,也同时提高了灵敏度。2)基因工程重组表达的抗原作为原料取代了酶标二抗,原料纯度大幅度提高,从而提高了特异性;同时,双抗原夹心法的双特异性系统相比间接法的单特异性系统在特异性方面也有较大提升。3)使用生物素-亲和素级联放大系统,能大幅度提升试剂的灵敏度(显色信号放大程度是酶标二抗的4倍)。4)加样量由间接法的10 μL提高到50 μL,避免了挂针等造成的误差,结果重复性好、便于画质控图,同时也提升了灵敏度。5)最低检出线:间接法最低检出线为0.5 NCU/mL,而双抗原夹心法为0.05 NCU/mL。
综上所述,ELISA试剂的选择是保证血液检测质量的关键因素[10],建议有条件的医院或采供血系统使用双抗原夹心法的抗-HCV试剂。
[1] Choo QL, Kuo G, Weiner AJ,etal. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome[J]. Science, 1989, 244(4902): 359-362.
[2] Baldo V, Baldovin T, Trivello R,etal. Epidemiology of HCV infection[J]. Current Pharmaceutical Design, 2008, 14(17): 1646-1654.
[3] 中华医学会肝病学分会、传染病与寄生虫学分会.丙型肝炎防治指南[J].中华肝病杂志,2004,12(2):194-198.
[4] 赵秀英,陈俊梅,辛永梅,等. 不同方法检测乙型肝炎病毒血清标志物的差异[J]. 肝脏,2008,13(4):303-305.
[5] 王晓艳. 双抗原夹心法 ELISA 检测丙型肝炎病毒抗体[D]. 北京:中国疾病预防控制中心, 2011.
[6] 葛红卫,王鸿捷,常缨,等.血液检测实验室ELISA试剂的选择评价[J].中国输血杂志,2004,17(6):422-423.
[7] 袁学敏,舒群峰,崔萍,等.5种国产抗-HCV ELISA试剂血清盘考核结果分析[J].临床输血与检验,2012,14(2):179-181.
[8] 王国华,张贺秋,李少波,等.双抗原夹心法与间接ELISA法检测抗HCV对比研究[J].中国医学检验杂志,2005,6(4):318-319.
[9] 国家药典委员会.中华人民共和国药典:三部[M].北京:中国医药科技出版社,2010: 333-334.
[10] 胡维,陈红,刘春兰.乙肝表面抗原ELISA试剂2次评估结果分析[J]. 中国输血杂志,2013,26(12): 1268-1269.
Result Analysis and Evaluation of Anti-HCV ELISA Reagents
FANWen-cheng,TULin*,ZHANGNing-ning,ZHURong,TANHan-yu,CHENSu-qiong
(MianyangRedCrossBloodCenter,Mianyang621000,China)
Objective To detect anti-HCV by using the double antigen sandwich method and the indirect method, and to evaluate the reagents in different assay methods. Methods Use 1 double antigen sandwich method and 4 indirect methods to detect anti-HCV blood serum-plate and internal quality controls with different concentrations. The detection is conducted in Xantus Automatic sampling instrument and FAME Fully Automated Enzyme Immunoassay Analyzer according to the reagent instruction strictly. Results After using different ELISA methods to detect anti-HCV, the coincidence rate to negative reference panel (-/-) in all blood serum plates was 20/20 and the coincidence rate to positive reference panel (+/+) was 20/20. The double antigen sandwich method had a high sensitivity, and it can detect 0.05 NCU/mL of internal quality control completely. The indirect method can detect 0.5 NCU/mL at minimum. All 10 single reagent specimens that showed positive result in the indirect method were confirmed to be negative in the double antigen sandwich method and the confirmatory test RIBA. Conclusion The anti-HCV ELISA reagent in double antigen sandwich method has a higher sensitivity and specificity than those of the indirect methods.
Anti-HCV; ELISA; Reagent Evaluation
中国高校医学期刊临床专项资金(NO:11321501)
涂林,E-mail:2630618109@qq.com
http://www.cnki.net/kcms/detail/51.1705.R.20140415.1050.006.html
10.3969/j.issn.1674-2257.2014.02.012
R446.61
A

