非小细胞肺癌患者化疗前后血清肿瘤标志物、HIF-1α、VEGF的变化及相关性研究
奚蕾,沈伟生,曹向明(东南大学医学院附属江阴医院, 江阴 214400)
·论 著·
非小细胞肺癌患者化疗前后血清肿瘤标志物、HIF-1α、VEGF的变化及相关性研究
奚蕾,沈伟生,曹向明
(东南大学医学院附属江阴医院, 江阴 214400)
目的 探讨非小细胞肺癌(NSCLC)患者化疗前后血清肿瘤标志物、缺氧诱导因子-1α(HIF-1α)、血管内皮生长因子(VEGF)的变化及其相关性。方法 选择本院收治的40例NSCLC患者为观察组,来本院体检的40名健康正常人为对照组。检测两组血清中HIF-1α、VEGF水平;检测观察组血清中癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)、鳞状上皮细胞癌抗原(SCC)水平。评价观察组的临床疗效和生存质量改善情况。结果 观察组临床总有效率为30%,治疗后NSCLC患者生存质量改善率为32.5%。对照组血清HIF-1α、VEGF水平均明显低于观察组,经比较差异有显著统计学意义(P<0.01)。观察组治疗后血清HIF-1α、VEGF水平明显高于治疗前,经比较差异有显著统计学意义(P<0.01)。观察组治疗后血清CEA、NSE、SCC水平均显著低于治疗前,经比较差异有显著统计学意义(P<0.01)。观察组患者血清HIF-1α水平与VEGF水平呈显著正相关(P<0.01);与CEA、NSE、SCC水平均呈显著负相关(P<0.01)。结论 NSCLC患者化疗后血清HIF-1α、VEGF水平明显升高,血液学肿瘤标志物相关指标明显下降,且以上指标存在显著相关性。
化疗;非小细胞肺癌;血管内皮生长因子;缺氧诱导因子-1α;肿瘤标志物
目前肿瘤相关死因中,肺癌高居首位,以非小细胞肺癌(NSCLC)为主,占80%。NSCLC是一种实体肿瘤,可无限增殖和失控性生长,其最常见的现象是缺氧,由此所致的微环境是肿瘤发生发展的关键因素之一,不仅增加了肿瘤细胞对放疗和化疗的耐受性,还提高了肿瘤细胞的侵袭性和远处转移能力[1,2]。肿瘤的生长和转移主要依赖肿瘤内形成的新生血管,而参与肿瘤血管生成的血管生成因子中,作用最强的是血管内皮生长因子(VEGF);起核心调控作用的是缺氧诱导因子-l α(HIF-1α),调节包括血清肿瘤标志物和VEGF在内的多种靶基因表达[3,4]。本研究主要探讨了化疗前后NSCLC患者血清肿瘤标志物、VEGF、HIF-1α的变化和相关性,现报道如下。
1 资料与方法
1.1 临床资料
选择2010年7月~2012年8月本院收治的NSCLC患者40例为观察组,所有NSCLC患者治疗前均经病理或细胞学明确诊断。其中男15例,女25例;年龄45~78岁,平均(67.2±5.0)岁;其中鳞癌24例,腺癌16例。另选择同期来本院体检的40名健康正常人为对照组,其中男16例,女24例,年龄48~77岁,平均(66.2±5.5)岁。两组年龄、性别等一般资料比较,差异无统计学意义,具有可比性(P>0.05)。
1.2 化疗方法
观察组给予吉西他滨联合顺铂的化疗方案:吉西他滨1 000 mg/m2,静脉滴注30~60 min,d1,8,15;顺铂100 mg/m2,静脉滴注30~60 min,d1,每28 d重复。化疗期间给予常规水化和止吐治疗。每周期内白细胞降低至(1.0~2.0)×109/L和/或血小板降低至(50~75)×109/L时,将吉西他滨剂量减少25%。除恶心、呕吐外,不良反应未达到WHOⅢ级以上者不减少用药剂量。
1.3 检测方法及观察指标
对照组在体检当天,观察组在化疗前1~2 d、化疗治疗后2周期清晨,空腹采集肘静脉血5 mL,5 000 r/min 离心10 min后分离血清,-20 ℃冰箱冷冻保存。ELISA法检测血清中HIF-1α、VEGF水平。全自动生化分析仪检测观察组血清中癌胚抗原(CEA)、神经元特异性烯醇化酶(NSE)、鳞状上皮细胞癌抗原(SCC)等相关肿瘤标志物水平。
1.4 疗效评定标准
完全缓解(CR):肿瘤完全消失4 w以上;部分缓解(PR):肿瘤缩小>50%;稳定(NC):肿瘤缩小<50%;进展(PD):肿瘤增大>25%或出现新病灶。总有效率=[(CR+PR)/总例数]×100%。生存质量按照Karnofsky体力状况评分标准(KPS):治疗后KPS增加≥10者为改善;减少≥10者为降低;介于二者之间为稳定。
1.5 统计学方法

2 结果
2.1 观察组临床疗效
观察组40例患者,CR 0例,PR 12例,NC 15例,PD 13例,临床总有效率为30%(12/40)。NSCLC患者治疗后KPS评分有不同程度改善,改善率为32.5%(13/40)。
2.2 各组化疗前后血清HIF-1α、VEGF水平变化
对照组血清HIF-1α、VEGF水平分别为(37.1±4.3)ng/L、(596.5±60.4)pg/mL,均明显低于观察组(治疗前和治疗后),经比较差异有显著统计学意义(P<0.01)。观察组治疗后血清HIF-1α、VEGF水平明显高于治疗前,经比较差异有显著统计学意义(P<0.01)(见表1)。
与对照组比较,**P<0.01;与治疗前比较,##P<0.01
2.3 观察组化疗前后血清肿瘤标志物水平变化情况
观察组化疗治疗前检测的血清肿瘤标志物CEA、NSE、SCC水平分别为(40.3±4.1)、(33.8±4.6)、(38.5±4.6);化疗治疗后CEA、NSE、SCC水平分别为(28.4±3.4)、(19.6±2.4)、(22.7±2.6)。观察组治疗后血清CEA、NSE、SCC水平均显著低于治疗前,经比较差异有显著统计学意义(P<0.01)(见表2)。
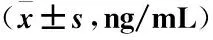
表2 观察组血清肿瘤标志物水平变化情况
与治疗前比较,**P<0.01
2.4 化疗前后观察组血清HIF-1α与VEGF、肿瘤标志物水平表达的相关性
NSCLC患者血清HIF-1α水平与VEGF呈显著正相关(P<0.01);与CEA、NSE、SCC水平均呈显著负相关(P<0.01)(见表3)。

表3 化疗前后观察组血清HIF-1α与VEGF、肿瘤标志物水平表达的相关性
3 讨论
肺癌为病死率较高的恶性肿瘤,其发生部位起源于肺部支气管黏膜上皮。近年来,随着生活环境的改变,城市工业化发展的加速,肺癌的发病率呈逐年上升趋势,日益受到学者们的关注[5,6]。研究[7]表明,癌细胞所处的环境与癌细胞的增殖、扩散密切相关,缺氧环境能导致癌细胞对药物的耐受性增加。另有研究[8]证实,肿瘤发生部位的新血管生成与癌细胞的扩散迁移密切相关,VEGF为参与血管新生的重要因子,在肿瘤细胞迁移扩散的过程中发挥重要作用,HIF-1α则在血管生成的过程中起到整体调控的作用。大量研究[9-11]报道,肺癌患者的血清VEGF水平明显高于健康对照组,且VEGF水平与肺癌TNM分期增加成正比,而不同性别、分化程度和病理类型的NSCLC患者之间血清VEGF水平差异无统计学意义。由于在肺癌的发生、发展和转移过程中VEGF具有重要作用,因此,肺癌患者血清中的VEGF水平变化可作为评估肺癌的早期诊断、疗效和预后的重要指标[12]。
HIF是一种转录因子,在缺氧环境下广泛存在于人体和哺乳动物中,具有维持氧稳态的重要生理功能。HIF主要成分为氧调节亚单位HIF-1α和结构亚单位HIF-1β的异二聚体[13],HIF-1α亚基具有调节HIF-1活性功能,下游靶基因有100多种,与其结合后均可促进肿瘤的生长和转移。研究[14,15]表明,HIF-1α参与了血管形成、恶性肿瘤进展、迁移等过程,HIF-1α的表达水平可有效评估恶性肿瘤预后。研究[16,17]表明,NSCLC患者组织中HIF-1α的高表达水平与有无远处转移和临床分期等有关,而在远离肿瘤组织15~20 cm处的正常肺组织中无表达,提示在NSCLC的发生发展、远处转移和局部浸润中HIF-1α起着重要的作用。本研究结果显示,NSCLC患者血清中HIF-1α、VEGF水平均明显高于正常人群,且经过化疗后二者水平明显增加,这与其他学者的研究相一致。
由于癌基因及其产物的异常表达,肿瘤组织和细胞产生的抗原和生物活性物质就是血液学肿瘤标志物,其在肺癌早发现和早诊断方面具有重要研究价值。肺癌常用标志物有CEA、VEGF、SCC和NSE,与肿瘤负荷紧密联系,在癌症晚期水平升高。有研究[18,19]表明,SCC水平在Ⅲ、Ⅳ期显著高于在I、Ⅱ期,提示SCC水平与肺癌TNM分期成正比,而CEA、NSE等的升高与SCC呈正相关。本研究中,NSCLC患者化疗后血清CEA、NSE、SCC水平均显著低于治疗前,且血清HIF-1α水平与VEGF、CEA、NSE、SCC水平均呈显著正相关。
综上所述,在预测肿瘤的发生发展、转移和预后方面,HIF-1α、VEGF及肿瘤标志物具有重要意义和相关性。联合检测NSCLC患者治疗前后血清HIF-1α 、VEGF及肿瘤标志物含量可反映肿瘤血管生成程度,对临床判断化疗反应、机体肿瘤负荷、预后及肿瘤生长转移有积极的指导作用。
[1] Deacon K, Onion D, Kumari R,etal. Elevated SP-1 transcription factor expression and activity drives basal and hypoxia-induced vascular endothelial growth factor (VEGF) expression in non-small cell lung cancer[J]. Journal of Biological Chemistry, 2012, 287(47): 39967-39981.
[2] Wouters A, Pauwels B, Lambrechts HA,etal. Retention of the in vitro radiosensitizing potential of gemcitabine under anoxic conditions, in p53 wild-type and p53-deficient non-small-cell lung carcinoma cells[J]. Int J Radiat Oncol Biol Phys, 2011, 80(2): 558-566.
[3] Furrukh M, Burney IA, Kumar S,etal. Improving Outcomes in Advanced Lung Cancer: Maintenance therapy in non-small-cell lung carcinoma[J]. Sultan Qaboos Univ Med J, 2013, 13(1): 3-18.
[4] Wang Y, Huang L, Yang Y,etal. Effects of autocrine vascular endothelial growth factor (VEGF) in non-small cell lung cancer cell line A549[J]. Mol Biol Rep, 2013,40(4): 3093-3099.
[5] Falchook GS, Naing A, Hong DS,etal. Dual EGFR inhibition in combination with anti-VEGF treatment: a phase I clinical trial in non-small cell lung cancer[J]. Oncotarget, 2013, 4(1): 118-127.
[6] Pallis AG, Syrigos KN. Targeting tumor neovasculature in non-small-cell lung cancer[J]. Crit Rev Oncol Hematol, 2013, 86(6): 130-142.
[7] Kim SJ, Rabbani ZN, Dewhirst MW,etal. Expression of HIF-1alpha, CA IX, VEGF, and MMP-9 in surgically resected non-small cell lung cancer[J]. Lung Cancer, 2005,49(3): 325-335.
[8] Nakajima T, Anayama T, Koike T,etal. Endobronchial ultrasound doppler image features correlate with mRNA expression of HIF1-α and VEGF-C in patients with non-small-cell lung cancer[J]. J Thorac Oncol, 2012, 7(11): 1661-1667.
[9] Ramlau R, Gorbunova V, Ciuleanu TE,etal. Aflibercept and Docetaxel versus Docetaxel alone after platinum failure in patients with advanced or metastatic non-small-cell lung cancer: a randomized, controlled phase III trial[J]. J Clin Oncol, 2012, 30(29): 3640-3647.
[10] Sandler A, Hirsh V, Reck M,etal. An evidence-based review of the incidence of CNS bleeding with anti-VEGF therapy in non-small cell lung cancer patients with brain metastases[J]. Lung Cancer, 2012, 78(1): 1-7.
[11] Siejka A, Barabutis N, Schally AV. GHRH antagonist inhibits focal adhesion kinase (FAK) and decreases expression of vascular endothelial growth factor (VEGF) in human lung cancer cells in vitro[J]. Peptides, 2012, 37(1): 63-68.
[12] Kausar H, Jeyabalan J, Aqil F,etal. Berry anthocyanidins synergistically suppress growth and invasive potential of human non-small-cell lung cancer cells. Cancer Lett[J]. 2012, 325(1): 54-62.
[13] Andersen S, Donnem T, Stenvold H,etal. Overexpression of the HIF hydroxylases PHD1, PHD2, PHD3 and FIH are individually and collectively unfavorable prognosticators for NSCLC survival[J]. PLoS One, 2011, 6(8): 23847.
[14] Singh-Gupta V, Joiner MC, Runyan L,etal. Soy isoflavones augment radiation effect by inhibiting APE1/Ref-1 DNA repair activity in non-small cell lung cancer[J]. J Thorac Oncol, 2011, 6(4): 688-698.
[15] Jackson AL, Zhou B, Kim WY. HIF, hypoxia and the role of angiogenesis in non-small cell lung cancer. Expert Opin Ther Targets[J]. 2010, 14(10): 1047-1057.
[16] Jacoby JJ, Erez B, Korshunova MV,etal. Treatment with HIF-1alpha antagonist PX-478 inhibits progression and spread of orthotopic human small cell lung cancer and lung adenocarcinoma in mice[J]. J Thorac Oncol, 2010, 5(7): 940-949.
[17] Choi YJ, Rho JK, Lee SJ,etal. HIF-1alpha modulation by topoisomerase inhibitors in non-small cell lung cancer cell lines[J]. J Cancer Res Clin Oncol, 2009, 135(8): 1047-1053.
[18] Ma S, Shen L, Qian N,etal. The prognostic values of CA125, CA19.9, NSE, AND SCC for stage I NSCLC are limited[J]. Cancer Biomark, 2011, 10(3-4): 155-162.
[19] Lazarev SM, Massard Zh, Reshetov AV,etal. Role of biological tumor markers CEA, Cyfra-21, NSE, TU M2-PK in diagnosis and treatment of lung cancer[J]. Vestn Khir Im II Grek, 2010, 169(1): 39-43.
Changes and Relevance Analysis of Serum Tumor Markers, HIF-1α and VEGF Before and After Chemotherapy in Patients with Non-small Cell Lung Cancer
XILei,SHENWei-sheng,CAOXiang-ming
(JiangyinHospitalAffiliatedtoMedicalSchoolofSoutheastUniversity,Jiangyin214400,China)
Objective To explore the changes and relevance analysis of serum tumor markers, hypoxia inducible factor-1α(HIF-1α) and vascular endothelial growth factor (VEGF) before and after chemotherapy in patients with non-small cell lung cancer (NSCLC). Methods A total of 40 NSCLC patients were selected as observation group while another 40 healthy people taking physical examination in our hospital served as control group. Serum HIF-1α and VEGF levels were detected, serum carcinoembryonic antigen (CEA), neuron-specific enolase (NSE) and squamous cell carcinoma antigen (SCC) levels in observation group were examined, and clinical efficacy and quality of life (QOL) in observation group were evaluated before and after treatments. Results The total clinical efficacy of observation group was 30%, and the improvement rate of QOL was 32.5%. Serum HIF-1α and VEGF levels were evidently lower in control group than in observation group (P<0.01) and were apparently higher after treatment than before (P<0.01). Serum CEA, NSE and SCC levels in observation were markedly lower after treatment than before treatment (P<0.01). Serum HIF-1α was in positive relation with VEGF level (P<0.01), and in reverse correlation with CEA, NSE and SCC levels (P<0.01). Conclusion After chemotherapy, serum HIF-1α and VEGF levels increase whereas haematological tumor markers decrease obviously in NSCLC patients. These parameters are in significant association.
Chemotherapy; Non-Small Cell Lung Cancer; Vascular Endothelial Growth Factor; Hypoxia Inducible Factor-1α; Tumor Marker
中国高校医学期刊临床专项资金(NO:11321679)
http://www.cnki.net/kcms/detail/51.1705.R.20140424.0407.007.html
10.3969/j.issn.1674-2257.2014.02.008
R734.2
A

