膀胱尿路上皮癌中Fascin和Ezrin的表达及相关性
孟淑娟,陈小君,尹 丰,于永利,王玉华,郑素琴
(1. 唐山钢铁集团有限责任公司医院,河北 唐山 063000;2. 河北省唐山市曹妃甸区工人医院,河北 唐山 063120;3. 河北联合大学,河北 唐山 063000)
膀胱尿路上皮癌中Fascin和Ezrin的表达及相关性
孟淑娟1,陈小君2,尹 丰1,于永利1,王玉华1,郑素琴3
(1. 唐山钢铁集团有限责任公司医院,河北 唐山 063000;2. 河北省唐山市曹妃甸区工人医院,河北 唐山 063120;3. 河北联合大学,河北 唐山 063000)

目的 对Fascin和Ezrin在膀胱尿路上皮癌的表达及二者的表达的相关性进行研究。方法 采用免疫组化S-P法检测Fascin和Ezrin在10例膀胱癌旁黏膜及109例膀胱尿路上皮癌中的表达情况,探讨二者与膀胱尿路上皮癌的组织学分级及临床分期等临床病理特征的关系,统计分析二者在膀胱尿路上皮癌的表达的相关性。结果 Fascin在10例癌旁黏膜组织中均不表达,Ezrin在10例癌旁黏膜组织的表达阳性率为10%,二者在109例膀胱尿路上皮癌中的表达阳性率分别为84%,77%。二者的表达均与膀胱尿路上皮癌的组织学分级、临床分期及淋巴结转移有关(P均<0.05),与患者的性别及肿瘤是否多发无关(P均>0.05)。二者在膀胱尿路上皮癌的表达具有相关性,为正相关(r=0.912 4,P<0.05)。结论推测在膀胱尿路上皮癌中Fascin与Ezrin具有协同作用,联合检测Fascin和Ezrin有助于判断膀胱尿路上皮癌的侵袭转移及预后。
膀胱尿路上皮癌;Fascin;Ezrin;免疫组化
膀胱癌是泌尿系统常见的恶性肿瘤,其中绝大多数为尿路上皮癌,以浸润的方式生长,复发率为50%~70%,超过30%的复发病例伴有恶性程度增高或浸润能力增强[1]。复发和浸润能力增强是膀胱癌治疗失败的主要原因。肿瘤细胞侵袭能力的增高是实现浸润和转移的前提。侵袭的肿瘤细胞常表现出特殊的形态特征,如出现细胞膜突起、细胞间黏着及连接丧失[2]。这些变化被认为是几种actin交联蛋白导致细胞骨架重排的结果。Fascin蛋白、Ezrin蛋白同为细胞骨架蛋白,在肿瘤的这一过程中扮演了重要的角色,与肿瘤的侵袭、转移密切相关[3]。本研究探讨了膀胱尿路上皮癌中Fascin和Ezrin的表达及二者的相关性,现报道如下。
1 临床资料
1.1 一般资料 收集2009年9月—2012年10月在唐钢医院泌尿外科手术切除并保存完好的膀胱尿路上皮癌石蜡标本109例,患者均为初发病例,术前均未接受放、化疗;其中男78例,女31例;年龄55~85岁,中位年龄68岁。根据1973年WHO公布的膀胱恶性肿瘤病理分级方法:G1 28例,G2 45例,G3 36例;临床分期根据UICC-TNM标准:浅表型(Tis~T1)63例,浸润型(T2~T4)46例;肿瘤单发35例,多发74例;术后证实18例伴有淋巴结转移,91例无淋巴结转移。另取癌旁黏膜组织标本10例,均取自开放性手术断端,距肿瘤边缘>5 cm,经病理确诊无癌组织浸润。所有病例的临床病理资料完整,经高年资病理医师复查HE切片,证实病理诊断,并确定组织学分级及临床分期。
1.2 实验试剂 鼠抗人Fascin单克隆抗体(工作液,克隆号FCN01),鼠抗人Ezrin单克隆抗体(工作液,克隆号3C12),S-P通用二抗试剂盒,DAB显色剂均购自上海太阳生物科技有限公司。
1.3 试验方法
1.3.1 免疫组化S-P法染色 组织经10%中性甲醛固定,石蜡包埋,切成厚度4 μm组织切片;将组织切片贴附于经多聚赖氨酸处理的载玻片上,并经60 ℃烤2 h。实验步骤严格按试剂说明书进行。阳性对照Fascin用脾组织切片,Ezrin用结肠癌组织切片,BPS代替一抗作阴性对照。
1.3.2 免疫组化结果判定 所有组织切片的评分由2名病理医师在不知情的前提下各自独立进行,遇到结果不一致时,2名医师讨论,得出综合分析意见。Fascin和Ezrin表达阳性信号为棕黄色至棕褐色颗粒,均定位于细胞胞浆和/或胞膜,依据染色强度和阳性细胞计数得分相乘评分。①染色强度计分标准:用以确定为阳性的乳腺癌标本的反应强度作为对照,无色为0分,表达强度弱于它为1分,与其相同为2分,比之强为3分。②阳性细胞计数:普通光镜相同放大倍数下计数阳性细胞数,少于25%为1分,25%~50%为2分,51%~75%为3分,75%以上为4分。两项得分相乘分为4个级别:0分(-),1~4分(+,弱阳性),5~8分(,中度阳性),9~12分(,强阳性)。统计学分析时,(+)以上视为阳性。
1.4 统计学方法 运用SPSS 11.5统计软件,数据处理采用2检验和Spearman相关性检验,小样本资料采用Fisher精确概率检验法,P<0.05为差异有统计学意义。
2 结 果
2.1 Fascin的表达 Fascin在109例膀胱尿路上皮癌中的阳性表达率为83.5%(91/109),癌旁黏膜中无表达。癌旁黏膜组与膀胱尿路上皮癌组Fascin阳性率比较差异有统计学意义(P<0.05)。Fascin的表达随着膀胱尿路上皮癌的临床分期及组织学分级的升高而增强(P<0.05),并与淋巴结有无转移有关(P<0.05)。Fascin在膀胱尿路上皮癌中的表达与患者的性别及肿瘤数目无关(P>0.05)。见表1、图1及图2。
2.2 Ezrin的表达 Ezrin表达阳性率在109例膀胱尿路上皮癌中为77.1%(84/109)、在10例癌旁黏膜中为20%(2/10);癌旁黏膜组与膀胱尿路上皮癌组Ezrin阳性率比较差异有统计学意义(P<0.05)。Ezrin的表达随着膀胱尿路上皮癌临床分期及组织学分级的升高而增强(P<0.05),并与淋巴结有无转移有关(P<0.05)。Ezrin在膀胱尿路上皮癌中的表达与患者的性别及肿瘤数目无关(P>0.05)。见表1、图3和图4。
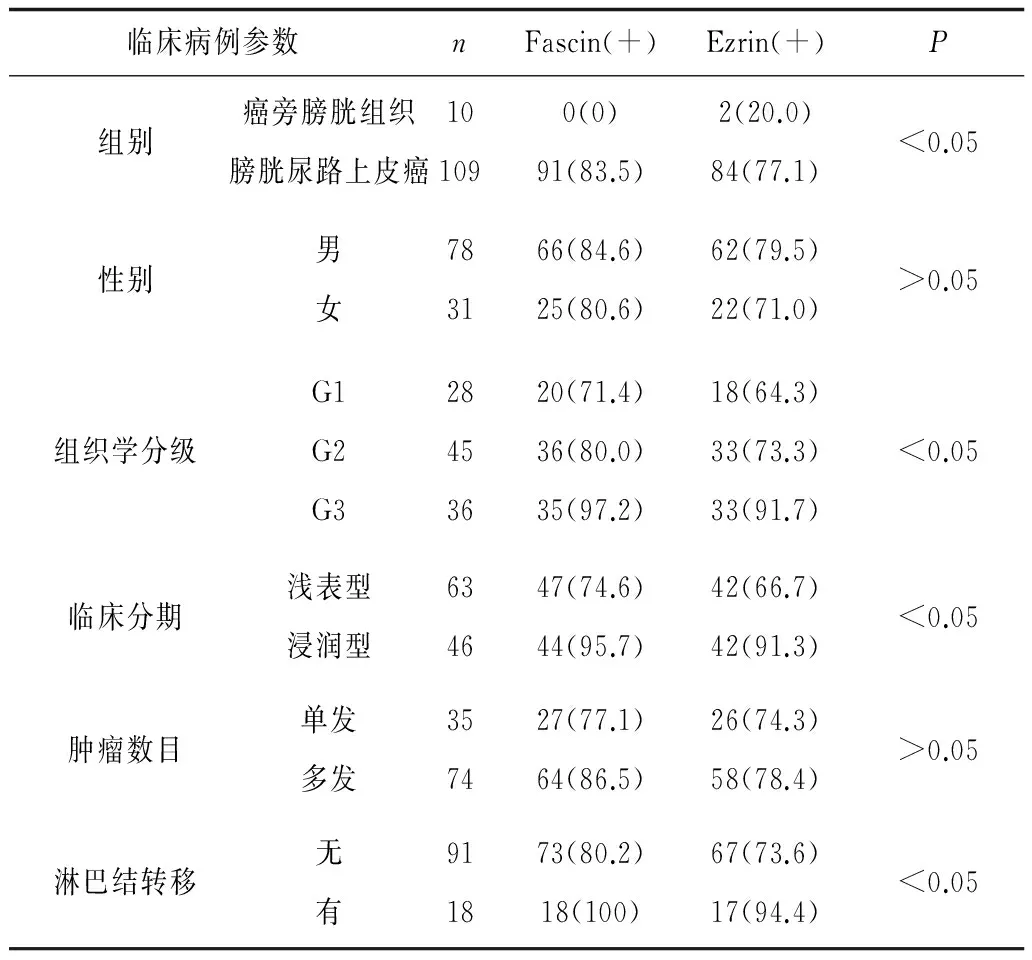
表1 Fascin和Ezrin的表达及与膀胱尿路上皮癌临床病理特征的关系 例(%)

图1 Fascin在浸润性尿路上皮癌中阳性表达(IHC SP法)
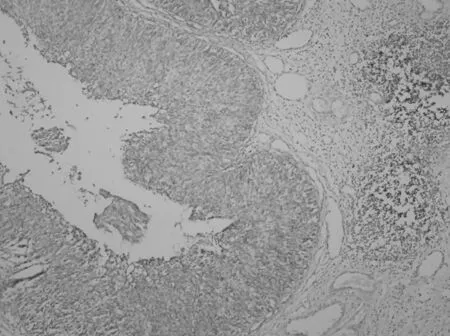
图2 Fascin在非浸润性尿路上皮癌中阳性表达(IHC SP法)
2.3 Fascin和Ezrin在膀胱尿路上皮癌中表达的相关性 Fascin与Ezrin在膀胱尿路上皮癌中的表达均呈正相关,二者的高表达代表高级别和高临床分期的膀胱尿路上皮癌,有淋巴结转移的表达强于无淋巴结转移的。见表2。
3 讨 论
细胞骨架及其附属结构是细胞活动和转移的基础。正常细胞在向恶性肿瘤细胞转变的过程中,会丧失细胞极性,其异型性和运动性增加,同时细胞膜流动性及黏附性也会随之下降,并出现生长调控机制的丧失[3]。肿瘤细胞的运动能力增强,突破基底膜侵入周围组织,发生局部浸润,是恶性肿瘤转移播散的前提。细胞形态、极性、黏附性和运动能力是由细胞骨架排列所决定的。通常细胞侵袭性增强时会发生一些特殊变化,主要表现为细胞突触增多、细胞间黏附减弱以及通讯连接丧失等[4-5]。这是由于一些肌动蛋白结合蛋白及相关的连接蛋白导致细胞骨架重组所致。

表2 Fascin、Ezrin在膀胱尿路上皮癌表达的相关性 例
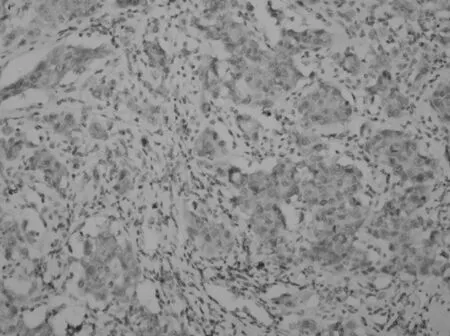
图3 Ezrin在浸润性尿路上皮癌中阳性表达(IHC SP法)

图4 Ezrin在非浸润性尿路上皮癌中阳性表达(IHC SP法)
Fascin蛋白即聚束蛋白,是细胞骨架蛋白的一种,因其可以和F-肌动蛋白结合成束状结构得名,属于β三叶草家族,分子量为55 kD,定位于细胞质张力纤维、细胞膜的丝状伪足及微棘的核心肌动蛋白束中[6]。实验证实Fascin作为细胞膜突起具有重要作用的结合蛋白,参与细胞运动能力以及细胞膜突起,协助细胞完成细胞附着、细胞间相互作用和细胞移动[7]。已有研究表明,在多种上皮性来源的肿瘤中Fascin蛋白高表达,并与肿瘤的高病理分级及高临床分期和侵袭转移相关。研究证实Fascin的过表达会导致肿瘤细胞增殖周期变短,细胞膜突起增多,细胞间连接消失,黏附力下降,细胞运动能力增强[8]。本实验中可以看出Fascin在癌旁黏膜中没有表达,但在膀胱尿路上皮癌中表达明显升高,与癌旁黏膜组比较差异有统计学意义(P<0.05)。另外本研究结果也显示,Fascin的表达与患者的性别、肿瘤数目无关,但是与膀胱尿路上皮癌的临床分期、组织学分级呈正相关,随着膀胱尿路上皮癌临床分期和组织学分级的升高,肿瘤细胞中Fascin蛋白表达增强,有淋巴结转移的表达阳性率明显高于无淋巴结转移的。说明Fascin的表达可能对膀胱癌的侵袭和淋巴结转移具有一定的促进作用,Fascin的高表达使患者更易出现淋巴结转移,膀胱癌分级越高,患者预后越差。这与以往Fascin蛋白在上皮性肿瘤组织中的研究结果一致[9-11]。
Ezrin蛋白是细胞骨架结合蛋白,具有结合细胞骨架到细胞膜蛋白的能力,属于Ezrin/Radix/Moesin紧密连接蛋白家族(ERM)中重要成员之一。Ezrin蛋白分子量为81kD,编码基因为villin2,由585个氨基酸组成[12]。Ezrin主要分布于肌动蛋白集中的微绒毛、细胞皱褶、丝足等膜表面结构中[13]。在细胞中Ezrin有休眠和激活2种状态,当自身的N端和C端发生作用,使蛋白形成头尾相连的折叠状态,造成Ezrin失活,即Ezrin的休眠状态;当N端和C端分离,使蛋白展开而同胞膜和细胞骨架发生作用,即Ezrin的激活状态[14]。
Ezrin蛋白在体内的表达和分布因组织器官不同而不同,在肺、胃、小肠、肾脏及胰腺等组织器官中高表达,胸腺、骨髓、脾脏和淋巴结等处中度表达,而脑、肌肉、睾丸和心脏等表达较弱[15]。研究发现Ezrin蛋白的表达与多种肿瘤有关。Ohtani等[16]发现在子宫内膜癌和不典型增生子宫内膜组织中Ezrin蛋白的表达显著高于良性子宫内膜病变和正常子宫内膜组织,转移灶的表达比原发灶亦有增强。Kobel等[17]发现在卵巢癌中也存在Ezrin蛋白的高表达,并与卵巢癌患者的低生存率相关。在对食管癌[18]、胰腺癌等[19]的研究也表明Ezrin存在高表达。本实验结果发现Ezrin在癌旁黏膜组织有表达,但是阳性率较低且表达较弱,但在膀胱尿路上皮癌中表达增强,阳性率比癌旁黏膜明显增加,差异有统计学意义(P<0.05),提示Ezrin高表达可能参与膀胱尿路上皮癌的发生过程。同时Ezrin与膀胱尿路上皮癌的临床分期、组织学分级及淋巴结转移呈正相关,差异有统计学意义(P<0.05),但与患者的性别及肿瘤的数目无关。说明Ezrin蛋白表达与膀胱尿路上皮癌发生、发展和预后及淋巴结转移有关,其高表达的患者更容易出现淋巴结的转移,预后差。
细胞骨架的排列与细胞的形态密切相关,而细胞形态的改变将影响肿瘤的侵袭和转移。Fascin蛋白是一种捆绑细胞骨架肌动蛋白微丝的细胞骨架蛋白,而Ezrin蛋白是一种连接细胞骨架肌动蛋白微丝与细胞膜的细胞骨架结合蛋白,二者在维持细胞形态中发挥着重要作用。目前的研究证实,Fascin、Ezrin均与多种肿瘤的发生发展相关[17-18]。一项对血管瘤的研究发现Fascin蛋白与Ezrin蛋白在增生期血管瘤组织中呈高表达,研究者认为Fascin蛋白与Ezrin蛋白的表达破坏了细胞信号的平衡,促使血管内皮细胞过度增生导致血管瘤的形成,可见Fascin与Ezrin在血管瘤的发生发展中具有协同效应[20]。李恩民[21]在食管癌的研究中,运用免疫组化、免疫荧光、组织芯片、cDNA基因表达谱芯片、Westernblotting、RT-PCR、RNA干扰和真核基因表达等系列实验技术检测Fascin与Ezrin在食管癌中的表达,证实Ezrin与Fascin在食管癌中的表达均显著异常,且与患者的预后相关。其机制可能是Fascin与Ezrin在食管癌中的过表达激活了TGF-β等细胞信号转导通路,影响靶基因CTGF、CYR61和ATF3等的表达,使食管癌细胞的生物学行为发生改变。本研究也显示Fascin蛋白与Ezrin蛋白作为细胞骨架蛋白,在膀胱尿路上皮癌中表达均显著增强,并与膀胱尿路上皮癌的病理分级、临床分期以及淋巴结转移情况有关,二者在膀胱尿路上皮癌中具有相关性(P<0.05,r=0.912 4)。提示二者在膀胱癌的发生、发展及浸润过程中具有相互协同作用。联合检测Fascin及Ezrin可能有助于判断膀胱尿路上皮癌的侵袭转移及预后。
[1] 冯晓莉,何群,陆敏,等译. 泌尿系统及男性生殖器官肿瘤病理学和遗传学[M]. 北京:人民卫生出版社,2006:96-98
[2] Parkin MD,Bray F,Ferlay J,et al. Global Cancer Statistics,2002[J]. CA Cancer J Clin,2005,55(2):74-108
[3] Liotta LA,Clair T. Cancer,checkpoint for invasion[J]. Nature,2000,405(6784):287-288
[4] Liotta LA,Kohn EC. The microenvironment of the tumour-host interface[J]. Nature,2001,411(6835):375-379
[5] Aznavoorian S,Murphy AN,Stetler-Stevenson WG,et al. Molecular aspects of tumor cell invasion and metastasis[J]. Cancer,1993,71(4):1369-1383
[6] Jayo A,Parsons M. Fascin: a key regulator of cytoskeletal dynamics[J]. Int J Biochem Cell Biol,2010,33(2):422-429
[7] Adams JC,Schwartz MA. Stimulation of fascin spikes by thromb-ospondin-1 is mediated by the GTPases Rac and Cdc42[J]. Cell Biol,2000,150(4):807-822
[8] Yoder BJ,Tso E,Skacel M,et al. The expression of fascin,an action-bunding motility protein,correlates with hormone receptor-negative breast cancer and a more aggressive clinical course[J]. Clin Cancer Res,2005,11(1):186-192
[9] Chiyomaru T,Enokida H,Tatarano S,et al. miR-145 and miR-133a function as tumour suppressors and directly regulate FSCN1 expression in bladder cancer[J]. Br J Cancer,2010,102(5):883-891
[10] Tong GX,Yee H,Chiriboga L,et al. Fascin-1 expression in papillary and inrasive urothelial carcinomas of the urinary bladder[J]. Hum Pathol,2005,36(7):741-746
[11] 阿布德,杨为民. Fascin蛋白在膀胱癌中的表达及临床意义[J]. 临床泌尿外科杂志,2010,25(8):626-632
[12] Kivela T,Jaskelainen J,Valeri A,et al. Ezrin, a membrane-organizing protein,as a polarization marker of the retinal pigment epithelium in vertebrates[J]. Cell Tissue Res,2003,301(2):217-223
[13] Kaul SC,Mitsui Y,Komatsu Y,et al. A highly expressed 81 KDa protein in immortalized mouse fibroblast: its proliferative function and identity with ezrin[J]. Oncogene,1996,13(6):1231-1237
[14] Akisawa N,Nishimori I,Iwaura T,et al. High levels of ezrin expressed by human pancreatic adenocarcinoma cell lines with high metastatic potential[J]. Biophys Res Commun,1999,258(20):395-400
[15] Polesello C,Payre F. Small is beautiful:what flies tell us about ERM protein function in development[J]. Trends Cell Biol,2004,14(6):294-302
[16] Ohtani K,Sakamoto H,Rutherford T,et al. Ezrin, a membrance-cytoskeletal linking protein, is highly expressed in atypical endometrial hyperplasia and uterine endometrioid adenocarcinoma[J]. Cancer Lett,2002,179(1):79-86
[17] Kobel M,Ga'adhand E,Zeng K,et al. Ezrin promotes ovarian carcinoma cell invasion and its retained expression predicts poor prognosis in ovarian carcinoma[J]. Int J Gyneeol Pathol,2006,25(2):121-130
[18] Shen ZY,Xu LY,Chen MH,et al. Upregulated expression of Ezrin and invasive phenotype in malignantly transformed esophageal epithelial cells[J]. World J Gastroenterol,2003,9(6):l182-1186
[19] Yeh TS. Significance of cellular distribution of Ezrin in pancreatic cystic neoplasms and ductal adenocarcinoma[J]. Arch Surg,2005,140(12):1184-1190
[20] 唐甜,宋启斌,张瑞莲. Ezrin和Fascin蛋白在血管瘤中异常表达研究[J]. 中国组织化学与细胞化学杂志,2010,19(5):428-433
[21] 李恩民. 细胞骨架结合蛋白Ezrin和Fascin在食管癌中的异常表达与功能及其相关细胞信号转导通路[J]. 中国肺癌杂志,2009,12(6):C54-C55
Expressions of Fascin and Ezrin in bladder urothelial carcinoma and correlations between them
Meng Shujuan1, Chen Xiaojun2, Yin Feng1, Yu Yongli1, Wang Yuhua1, Zheng Suqin3
(1. Hospital of Tangshan Iron and Steel Group, Tangshan 063000, Hebei, China; 2. Work’s Hospital of Caofeidian District, Tangshan 063120, Hebei, China; 3. Hebei United University, Tangshan 063000, Hebei, China)
Objective It is to study the expressions of Fascin and Ezrin in bladder urothelial carcinoma and the correlations between them. Methods The expression of Fascin and Ezrin in 10 cases of mucous membrane beside bladder cancer and 109 cases of bladder urothelial carcinoma was detected by immunohistochemical S-P method, to explore their relationship with clinical pathological characteristics such as histological grading and clinical staging of bladder urothelial carcinoma, and statistical analysis about the correlation of the expression in bladder urothelial carcinoma was performed. Results Fascin was not expressed in 10 case of mucosa tissue adjacent to carcinoma, positive rate about the expression of Ezrin in 10 cases of mucosa tissue adjacent to carcinoma was 10%, the expression positive rates about Fascin and Ezrin in 109 cases of bladder urothelial carcinoma were respectively 84%, 77%. The expressions of the two were related with histological grading, clinical stage and lymph node metastasis of bladder urothelial carcinoma (P<0.05), but had nothing to do with patients’ gender and whether the tumor was multiple or not (P>0.05). Both Fascin and Ezrin had some correlation expressed in bladder urothelial carcinoma, and the correlation was positive(r=0.912 4,P<0.05). Conclusion Fascin and Ezrin in bladder urothelial carcinoma have synergy, detection both Fascin and Ezrin is helpful for the diagnosis of invasion, metastasis and prognosis of bladder urothelial carcinoma.
bladder urothelial carcinoma;Fascin;Ezrin;immunohistochemical
孟淑娟,女,硕士,主治医师,主要从事病理诊断工作。
郑素琴,E-mail:suqinzheng@163.com
10.3969/j.issn.1008-8849.2014.35.008
R737.1
A
1008-8849(2014)35-3901-04
2014-04-20

