肾性高血压患者血浆网膜素-1水平及与颈动脉粥样硬化的关系
邬元平,陈白生,韦有欣
(江苏省南京市溧水区人民医院,江苏 南京 211200)
肾性高血压患者血浆网膜素-1水平及与颈动脉粥样硬化的关系
邬元平,陈白生,韦有欣
(江苏省南京市溧水区人民医院,江苏 南京 211200)

目的 探讨肾性高血压患者血浆网膜素-1水平与血压、胰岛素抵抗和颈动脉粥样硬化(AS)的关系。方法 选择肾性高血压患者83例(非斑块组35例,斑块组45例)作为患者组,健康体检者35例作为对照组,应用ELISA方法测定受检者血浆网膜素-1水平及相关生化指标,使用超声诊断仪测量颈动脉内膜中层厚度(IMT)。结果 血浆网膜素-1水平斑块组和非斑块组均低于对照组(P均<0.05);斑块组血浆网膜素-1水平显著低于非斑块组(P<0.05)。 Pearson相关分析显示:血浆网膜素-1水平与收缩压、舒张压、高敏C反应蛋白、肌酐、视黄醇结合蛋白、颈动脉IMT和胰岛素抵抗指数均呈负相关(r=-0.355,-0.388,-0.125,-0.491,-0.166,-0.721和-0.539,P均<0.05);多元逐步Logistic回归分析结果显示颈动脉IMT、胰岛素抵抗指数、收缩压和低密度脂蛋白是网膜素-1的独立影响因素。结论 血浆网膜素-1水平随血压升高而降低,胰岛素抵抗和颈动脉IMT与网膜素-1变化关系密切,低血浆网膜素-1导致肾性高血压的发生发展及颈动脉IMT增厚,为防止肾性高血压及预防心血管危险因素找到有效药物作用途径。
肾性高血压;网膜素-1;胰岛素抵抗;高敏C反应蛋白;颈动脉内膜中层厚度
肾性高血压患者临床上常表现为血压偏高,持续时间长,常规联合降压药物治疗疗效不明显,易发展至难治性高血压和高血压危象,导致严重心脑血管并发症。且持续性高血压可加重肾脏疾病,导致患者肾功能不可逆损害。肾脏疾病反过来也加重高血压进展,形成恶性循环。因此防止高血压,保护肾功能尤为重要。本研究探讨了肾性高血压患者血浆网膜素-1水平变化与血压、胰岛素抵抗和颈动脉粥样硬化的相关关系,现报道如下。
1 临床资料
1.1 一般资料 随机选择2013年3月—2014年1月在南京市溧水区人民医院肾内科住院患者83例作为患者组,均按照《中国高血压防治指南2010》[1]中肾实质性高血压诊断标准确诊为肾性高血压。排除近期严重感染、原发性高血压者,慢性肾脏病血液透析者,1型和2型糖尿病者,严重心力衰竭、心肌梗死者,心瓣膜疾病者,脑梗死和脑出血者。入组前患者均未服用ARB、ACEI、降血脂、激素和免疫抑制类药物。患者组男45例,女38例;年龄34~72(52.09±11.25)岁;体质量指数(BMI)(23.40±1.97)kg/m2;原发病为IgA肾病54例,局灶节段性硬化5例,膜性肾病8例,肾淀粉样变2例,新月体肾炎2例,多囊肾5例,孤立肾2例,狼疮性肾炎5例。其中颈动脉内膜中层厚度(IMT)>1.2 mm(为斑块形成[2])45例作为斑块组,IMT<1.2 mm 35例作为非斑块组。另随机选择年龄、性别和BMI相匹配的健康体检者35例作为对照组,男19例,女16例;年龄32~62(49.25±11.83)岁;体质量指数(23.18±1.88)kg/m2。2组性别、年龄和体质质量指数比较差异无统计学意义(P均>0.05)。研究入组者均签署知情同意书,并经医院伦理委员会同意。
1.2 研究方法 所有参与者均进行常规病史采集及体格检查,测患者的左侧肘动脉收缩压,舒张压,BMI。采集空腹静脉血,大型全自动生化仪检测血清BUN、SCr、HS-CRP、CHO、TG、LDL、HDL、空腹血糖(FBG)、空腹糖化血红蛋白、脂蛋白(A)、载脂蛋白A、载脂蛋白B、胱抑素和视黄醇结合蛋白生化指标。血清胰岛素水平(FINS)检测,试剂盒由上海起福生物科技有限公司提供,严格按照说明书操作。胰岛素抵抗指数(HOMA-IR)=FBG×FINS/22.5。免疫荧光定量仪检测高敏C反应蛋白(hs-CRP)浓度。血浆网膜素-1水平检测采用酶联免疫吸附试验,试剂盒由Abcam香港有限公司提供,批号:ab136953,批内变异系数(CV)< 5%,批间CV<10%。严格按照说明书进行操作。采用PHILIPS 彩色多普勒超声显像仪测量颈动脉IMT,使用血管探头横纵向观察颈动脉,颈动脉后壁纵向超声显像可表现为由相对较低回声分隔的两条平行亮线,内线为内膜与管腔的分界线,外线为中外膜分界线,其间距离为颈动脉IMT。

2 结 果
2.1 患者组和对照组各检测指标比较 患者组各项指标与对照组比较差异均有统计学意义(P均<0.05)。见表1。
2.2 斑块组、非斑块组与对照组网膜素-1水平比较 血浆网膜素-1水平非斑块组为(87.18±16.17)ng/mL,斑块组为(68.06±87.18)ng/mL,对照组为(112.43±13.61)ng/mL,斑块组和非斑块组与对照组比较差异均有统计学意义(t=11.55,7.185,P均<0.05),斑块组与非斑块组比较差异有统计学意义(t=-8.42,P<0.05)。
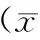
表1 患者组和对照组各检测指标比较±s)
2.3 相关分析 Pearson相关分析显示,血浆网膜素-1水平与收缩压、舒张压、hs-CRP、SCr、视黄醇结合蛋白、颈动脉IMT、HOMA-IR均呈负相关,见表2。多元逐步Logistic回归分析回归方程:Y(网膜素-1)=-0.537颈动脉IMT-0.344 HOMA-IR-0.189收缩压-0.170LDL。颈动脉IMT、HOMA-IR、收缩压和LDL是网膜素-1的独立影响因素,见表3。
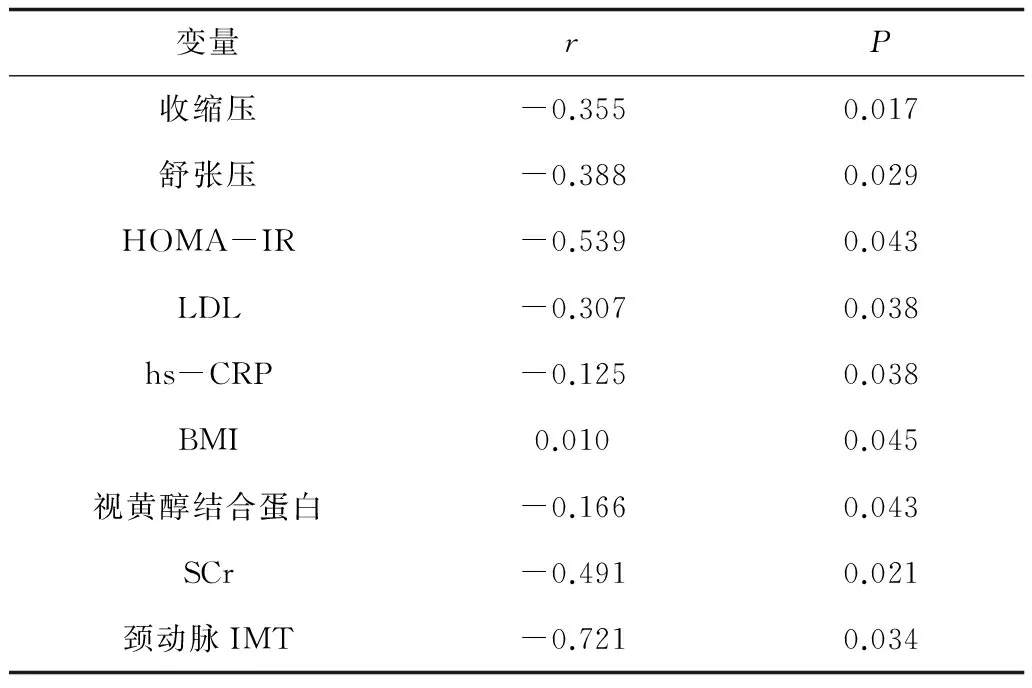
表2 网膜素-1与各观察指标Pearson相关分析
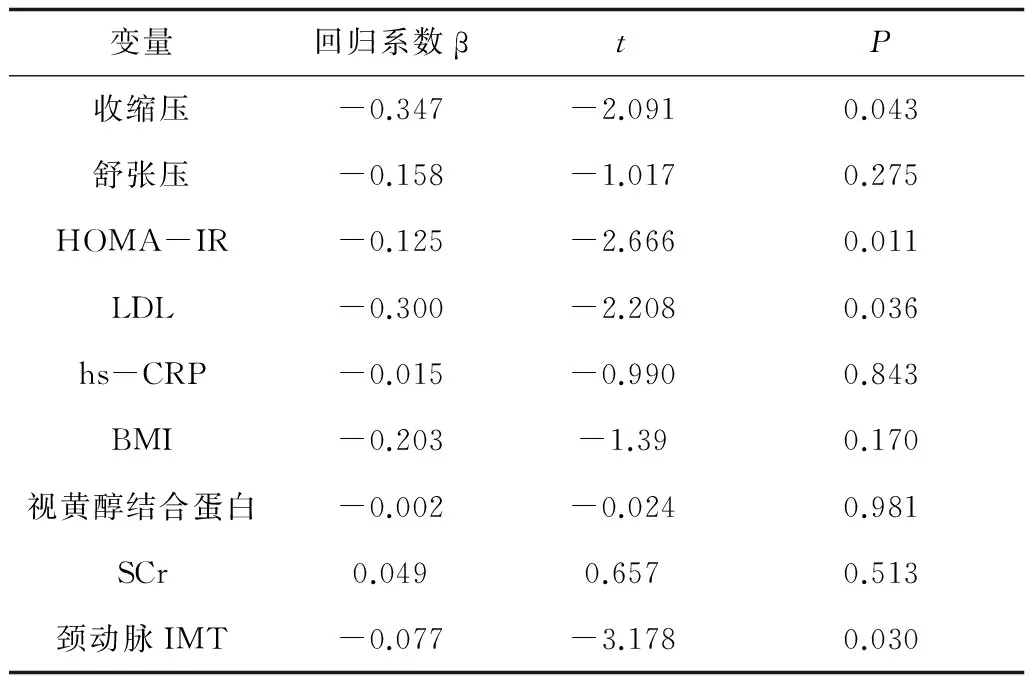
表3 网膜素-1与临床观察指标多元逐步回归分析
3 讨 论
肾性高血压分为肾实质性高血压和肾血管性高血压,为继发性高血压的常见严重类型。肾实质性高血压的发病机制分肾素依赖型和容量依赖型,临床上按照以上机制治疗肾性高血压患者,仍有部分患者的血压不能控制到理想水平,可能还存在其他机制发挥作用。目前研究发现脂肪组织不单纯是储能器官,它通过产生各种脂肪因子,作用于远程器官,参与细胞基质代谢。网膜素-1是美国马里兰大学Yang等2003年发现的特异性表达于网膜脂肪组织的细胞因子,相对分子量约为35 000,由313个氨基酸组成,网膜素-1基因主要表达于网膜脂肪组织的血管基质细胞中,是循环中的主要亚型,可以反映基因的表达水平[3]。网膜素-1血浆浓度在肥胖及肥胖相关性疾病如脂代谢紊乱、冠心病、2型糖尿病及动脉粥样硬化中较健康者明显下降[4]。
目前研究发现网膜素-1有以下作用:①扩张血管、降血压。网膜素-1可抑制由肾素、AngⅡ、地莫拉明引起的血压升高。网膜素-1使血压降低后再给予一氧化氮抑制剂,血压又升高,提示网膜素-1的降血压作用与一氧化氮的参与有关[5]。另外网膜素-1可诱导大鼠血管内皮细胞内NOS第1117位丝氨酸的磷酸化,从而激活NOS,产生一氧化氮,使血管舒张[6]。②抑制微炎症。微炎症状态是指一种非微生物感染引起,表现为全身循环中TNF-α和IL-6等单核细胞衍生的细胞因子和C反应蛋白(CRP)等正向急性时相反应物轻度持续增高,导致患者各种并发症的低强度、慢性进展的非显性炎症状态。网膜素-1能激活蛋白激酶(AMPK)直接抑制p38介导的E-选择素的诱生和最终淋巴细胞黏附于血管内皮细胞,提示网膜素-1可抑制微炎症和血管舒张[7]。CRP能诱导血管内皮细胞分泌表面黏附因子,证实CRP对加剧动脉粥样硬化炎症反应有直接作用,与动脉粥样硬化的存在及心血管并发症有明显的相关性[8]。而hs-CRP作为反映动脉粥样硬化炎症反应的标志,在预测斑块的稳定性上有较高的敏感性和精确性[9]。网膜素-1通过脂肪黏连蛋白激活足突细胞上脂肪细胞受体,再激活AMPK通路,抑制肾小球系膜细胞微炎症达到保护肾的作用[10]。改善血管内皮细胞功能。网膜素-1通过内皮细胞ERK/NF-B途径抑制TNF-α诱导的黏附分子(ICAM-1、VCAM-1)的表达,抑制血管内皮细胞中白细胞黏附和移行,减轻肾细胞损伤、肾小管间质损害及纤维化。网膜素-1能增强Akt-eNOS信号通路,提高内皮细胞功能,增加血流恢复和缺血组织毛细血管的密度,从而增加缺血组织的血管再生,改善血管内皮细胞NO功能[11]。抑制胰岛素抵抗。胰岛素抵抗是指机体对于胰岛素的敏感性下降,常规剂量的内源性或外源性胰岛素无法产生正常生物效应的一种状态,即胰岛素敏感细胞对于胰岛素所介导的葡萄糖摄取及利用能力下降伴高胰岛素血症存在,非糖尿病慢性肾脏病患者存在胰岛素抵抗。胰岛素抵抗是高血压的又一发病机制,大约40%的原发性高血压存在胰岛素抵抗[12]。脂肪因子通过自分泌及旁分泌途径可改变胰岛素的敏感性。网膜素-1基因位于1q22-q23染色体上,网膜素基因缺失、突变可增加糖尿病的易患性。网膜素-1抑制胰岛素抵抗。⑤抑制动脉粥样硬化。炎性因子在胰岛素抵抗及糖尿病的进展中起着重要作用。Banerjee等[13]针对慢性肾病非糖尿病患者及慢性肾病非糖尿病非透析患者分别进行研究,发现胰岛素抵抗与炎症水平密切相关,CRP水平、HOMA-IR均与血管内皮功能失调及动脉硬化独立相关。网膜素-1通过促进Akt信号通路的激活,转而调节内皮细胞内的NO合成酶,从而对内皮细胞功能紊乱产生影响,而内皮细胞功能紊乱是动脉粥样硬化发病过程的关键步骤[14]。网膜素-1对钙化血管平滑肌细胞(CVSMCs)的成骨细胞的分化是通过增强P13K/Akt信号传导通路而发挥作用。网膜素-1抑制碱性磷酸酶(ALP)和骨钙素Mrnade表达,还抑制ALP活性和骨钙素的产生以及基质蛋白的钙化,网膜素-1在抵抗动脉钙化上起保护作用[15]。体内研究表明网膜素-1通过NF-B受体活化因子(RANK)途径减轻动脉的硬化[16]。
本研究结果显示肾性高血压患者组网膜素-1水平较对照组显著降低,HOMA-IR及hs-CRP水平较对照组显著升高,且网膜素-1水平非斑块组、斑块组明显低于对照组,斑块组低于非斑块组。网膜素-1与收缩压、舒张压、hs-CRP、SCr、视黄醇结合蛋白、颈动脉IMT和HOMA-IR呈负相关,多元逐步Logistic回归分析显示影响网膜素-1的独立因素有颈动脉IMT、HOMA-IR、收缩压和LDL。表明血浆网膜素-1水平与血压、微炎症、胰岛素抵抗和动脉粥样硬化互为因果,构成互相联系、相互影响的网络。低网膜素-1血症可导致肾性高血压患者血压升高,炎症反应加剧,胰岛素抵抗增加,颈动脉粥样硬化和斑块形成。其机制是网膜素-1通过血管内皮细胞来发挥作用。增加脂肪细胞分泌网膜素-1,可降低肾性高血压患者血压,减轻微炎症状态,降低胰岛素抵抗,减少颈动脉粥样硬化和斑块形成,为有效治疗肾性高血压可能找到新的药物作用靶点。
[1] 刘力生. 中国高血压防治指南2010[J]. 中国高血压杂志,2011,19(8):701-743
[2] 高金梅,王绪增,朱丽丽,等. 视网膜中央动脉阻塞与颈动脉粥样硬化斑块及其相关性因素研究[J]. 中国中医眼科杂志,2013,23(5):366-368
[3] Pan HY,Guo L,Li Q. Changes of serum omentin-1 levels in normol subjects and in patients with impaired glucose regulation and with newly diagnosed and with newly diagnosed and untreated type 2 diabetes[J]. Diabetes Res Clin Pract,2010,88(1):29-33
[4] 矫磊,刘金波,凌明英,等. 网膜素-1,内脂素与新诊断2型糖尿病患者动脉粥样硬化的相关性[J]. 山东大学学报,2010,48(1):8-16
[5] Kazama K,Okada M,Hara Y,et al. A novel adipocytokine,omentin,inhibits agonists-induced increases of blood pressure in rats[J]. J Vet Med Sci,2013,73(8):1029-1034
[6] Yamawaki H,Tsubaki N,Mukohda M,et al. Omentin,a novel adipokine,induces vasodilation in rat isolated blood vessels[J]. Biochem Biophys Res Commun,2010,393(4):668-672
[7] Yamawaki H. Vascular effects of novel adipocytokines:focus on vascular contractility and inflammatory response[J]. Biol Pharm Bull,2011,34(3):307-310
[8] ErmaS,KuliszewskiMA,LiSH,etal.C-reactiveproteinattenuatesendothelialprogenitorcellsurvival,different-iation,andfunction;furtherevidenceofamechanisticlinkbetweenC-reactiveproteinandcardiovasculardisease[J].Circulation,2004,109(17):2058-2067
[9] Obinson JG,Ballantyne CM,Hsueh W,et al. Achievement of specified low-density lipoprotein cholesterol,non-high-density lipoprotein cholesterol apolipoprotein B,and high-sensitivity C-reactive protein levels with in metabolic syndrome patients[J]. J Clin Lipidol,2011,5(6):474-482
[10] Satoshi M,Kumar S. Adipokines protecting CKD[J]. Nephrol Dial Transplant,2013,28(Suppl 4):15-22
[11] Zhong X,Li X,Liu F,et al. Omentin inhibits TNF-α-induced expression of adhesion molecules in endothelial cell via ERK/NF-B pathway[J]. Biochem Biophys Res Commun,2012,425(5):401-406
[12] Lind L,Berne C,Lithell H. Prevalence of insulin resistance in essential hypertention[J]. J Hypertens,1995,13(12/1):1457-1462
[13] Banerjee D,Recio-Mayoral A,Chitalia N,et al. Insulin resistance,inflammation,and vascular disease in nondiabetic predialysis chronic kidney disease patients[J]. Clin Cardiol,2011,34(6):360-365
[14] Yamawaki H,Kuramoto J,Kameshim S,et al. Omentin,a novel adipocytokine inhibits TNF-induced vascular inflammation in human endothelial cell[J]. Biochem Biophys Res Commun,2011,408(2):339-343
[15] Duan XY,Xie PL,Ma YL. Omentin inhibits osteoblastic differentiation of calcifying vascular smooth muscle cell throung the P13K/Akt pathway[J]. Amino Acids,2010,41(5):1223-1231
[16] Xie H,Xie PL,Wu XP,et al. Omentin-1 attenuates arteriral calcification and boner loss in osteoprotegerin-deficient mice by inhibition of RANKL expression[J]. Cardiovasc Res,2011,92(2):296-306
Relationship between plasma omentin-1 level and carotid artery atherosclerosis in patients with renal hypertention
Wu Yuanping,Chen Baisheng, Wei Youxin
(LiShui District People's Hospital of Nanjing, Nanjing 211200,Jiangsu,China)
Objective It is to investigate the relationship between plasma omentin-1 level and blood pressure, insulin resistance and carotid artery atherosclerosis (AS)in patients with renal hypertention. Methods 83 cases of renal hypertensive patients (45 cases of plaques, 35 cases of no plaques) as patient group and 35 healthy subjects as control group were enrolled into this study, Plama omentin-1 level and correlated biochemical indicators were measured by ELISA,carotid intima-media thickness(IMT) was estimated by ultrasonic diagnostic equipment. Results The plasma levels of omentin-1 of the plaques group and no plaques group were lower than that of control group(P<0.05); Plasma omentin-1 level in the plaques group was significantly lower than that of the no plaques group(P<0.05). Pearson correlation analysis revealed that omentin-1 was negative correlated with systolic blood pressure(SBP),diastolic pressure(DBP),high sensitive C-reactive protein,creatinine,retinol binding protein,carotid IMT and insulin resistance index (r=-0.355,-0.388,-0.125,-0.491,-0.166,-0.721 and -0.539,P<0.05); Multiple stepwise logistic regression analysis indicated that carotid artery IMT, insulin resistance index,SBP and low density lipoprotein(LDL) were independent factors associated with plasma omentin-1 level(P<0.05). Conclusion The level of omentin-1 decreased in the patients with renal hypertention with increased blood pressure, insulin resistance and carotid IMT closely associated with changes in omentin-1, low plasma omentin-1 could lead to the development of the occurrence of renal hypertension and the formation of carotid IMT, in order to prevent renal hypertensive cardiovascular risk factors for finding a way to effective drugs.
renal hypertension; omentin-1; insulin resistance;hs-CRP; carotid intima-media thickness
邬元平,男,硕士,主任医师,主要从事肾内科疾病的临床研究工作。
江苏大学医学临床科技发展基金项目(JLY20120111)
10.3969/j.issn.1008-8849.2014.35.003
R0544.14
A
1008-8849(2014)35-3883-04
2014-05-06

