不同土壤湿度条件下绿色木霉对尖孢镰刀菌数量的影响
梁昌聪, 刘 磊, 张建华, 郭立佳, 汪 军, 黄俊生
(中国热带农业科学院环境与植物保护研究所/农业部热带作物有害生物综合治理重点实验室/海南省热带农业有害生物检测与控制重点实验室, 海口 571101)
不同土壤湿度条件下绿色木霉对尖孢镰刀菌数量的影响
梁昌聪, 刘 磊, 张建华, 郭立佳, 汪 军, 黄俊生*
(中国热带农业科学院环境与植物保护研究所/农业部热带作物有害生物综合治理重点实验室/海南省热带农业有害生物检测与控制重点实验室, 海口 571101)
采用平板菌落计数法研究在不同土壤湿度条件下绿色木霉在土壤中的定殖动态及对尖孢镰刀菌数量的影响。结果显示:在3个土壤湿度条件下,接种木霉后前4周均能显著降低镰刀菌的数量;与对照2(CK-H06)相比,处理(B2-H06)中木霉的孢子含量没有显著性变化。第1、2周,对照1(CK-B2)与处理(B2-H06)的镰刀菌含量与土壤湿度呈显著性正相关;在第5周,处理(B2-H06)的镰刀菌和木霉菌含量与土壤湿度呈显著性负相关。
绿色木霉; 土壤湿度; 尖孢镰刀菌
香蕉枯萎病是由尖孢镰刀菌 (FusariumoxysporumSchl.)引起的一种毁灭性的土传病害,已严重危害到香蕉的生产及香蕉产业[1]。目前单纯采用化学药剂防治香蕉枯萎病的效果并不理想[1], 并且随着大量使用化学农药产生了环境污染、农药残留及土壤微生物群落结构失衡等令人担忧的问题[2];因此很多学者把注意力转移到生物防治上。木霉(Trichodermaspp.)作为一种重要的植病生防菌一直受到普遍关注。绿色木霉(T.viride)广泛分布于自然界,可在多种营养基质上快速生长, 对多种植物病原菌有重寄生作用,能有效地竞争营养和生存空间,还可以产生抗生素和攻击多种病原所需要的酶,所以被认为是一种很有开发潜力的生防菌[3]。
近年来,国内外学者对木霉防治香蕉枯萎病进行了大量的研究[4-7],包括拮抗菌株的分离筛选、室内盆栽试验及小区试验等,但是很少研究关注土壤理化性质对木霉防治香蕉枯萎病的影响。各种研究表明, 土壤的理化性质(包括土壤的含水量、土壤颗粒的大小、土壤的温度、土壤中金属离子的含量等) 及其微生态特性对土壤中的镰刀菌都具有较大的影响[8-10]。本试验初步研究了木霉在不同土壤湿度条件下自身数量变化及对尖孢镰刀菌数量的影响,为木霉田间防控香蕉枯萎病提供理论依据。
1 材料与方法
1.1 试验材料
供试尖孢镰刀菌为香蕉枯萎病病原菌(FOC4-B2)以及绿色木霉(H06)菌株均为中国热带农业科学院环境与植物保护研究所微生物资源研究与利用课题组分离筛选保存菌株。供试土壤为从健康香蕉园中挖取的耕层土壤,土壤性状:pH 6.2,有机质含量为16.5 g/kg,全氮(N)784.6 mg/kg, 全磷(P)315.1 mg/kg,全钾(K)19 637.9 mg/kg, 121 ℃灭菌30 min。
1.2 试验方法
1.2.1 病原菌
从培养7 d的FOC4-B2菌株平板上挑一块菌饼接种于PDB (土豆葡萄糖培养液)培养液中,置于180 r/min 转速的摇床中28 ℃振荡培养4 d,过滤收集孢子悬浮液,加到试验土壤中,搅拌均匀,土壤中最终的FOC4-B2孢子含量为1.95×106个/g。
1.2.2 木霉
将分离纯化的绿色木霉菌种接种于PDA培养基平板,放入28 ℃培养箱,培养4~5 d,待菌丝长满平板并产孢时,配制孢子悬浮液,在病原菌加到土壤的第3天,加到土壤中,土壤中的木霉含量约为107个/g。
1.2.3 土壤湿度设置
供试土壤均设定3个土壤湿度,即:30%、50%和70%的土壤绝对含水量,每个土壤湿度设1个处理(同时接种病原菌B2和绿色木霉H06)、1个对照1(只接种病原菌B2)和1个对照2(只接种绿色木霉H06),每个处理3个重复(每个重复的土样400 g装盆,直径×高=7.8 cm×10 cm)。温室大棚室温自然培养,每天喷水称重,保持土壤含水量,每隔7 d取土样检测。
1.2.4 菌量检测
用平板菌落计数法[11],木霉H06用孟加拉红培养基检测,尖孢镰刀菌用特异性培养基检测[12]。
1.3 统计分析
采用Microsoft Excel 2003处理数据, SPSS 11.5软件进行差异显著性分析。
2 结果与分析
2.1 不同土壤湿度条件接种木霉对土壤中镰刀菌的影响
在土壤湿度30%条件下,接种木霉后前3周能显著降低土壤中镰刀菌的含量(图1a);在土壤湿度50%和70%条件下,接种木霉后前4周均能显著降低镰刀菌的含量(图1b,c)。
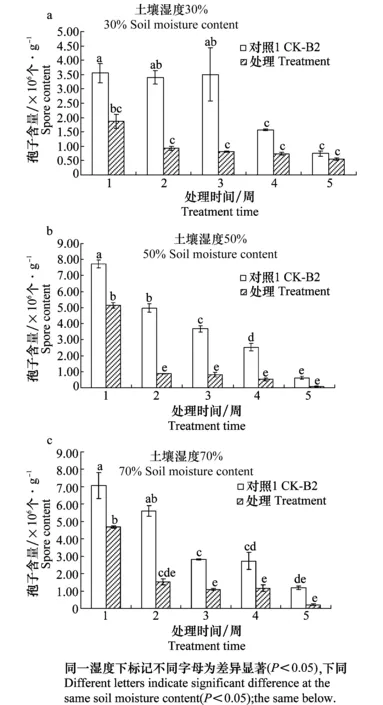
图1 不同土壤湿度条件接种木霉对土壤中镰刀菌含量的影响
2.2 不同土壤湿度对木霉含量的影响
在不同土壤湿度条件下,与对照2(CK-H06)相比,处理(B2-H06)中木霉的含量没有显著性变化(图2),除了在土壤湿度30%条件下,第5周处理(B2-H06)中木霉的孢子含量显著低于对照(图2a)。前3周,3个湿度条件下,不管是对照2(CK-H06)还是处理(B2-H06)中木霉数量没有明显变化,在第4、5周,孢子数量下降。
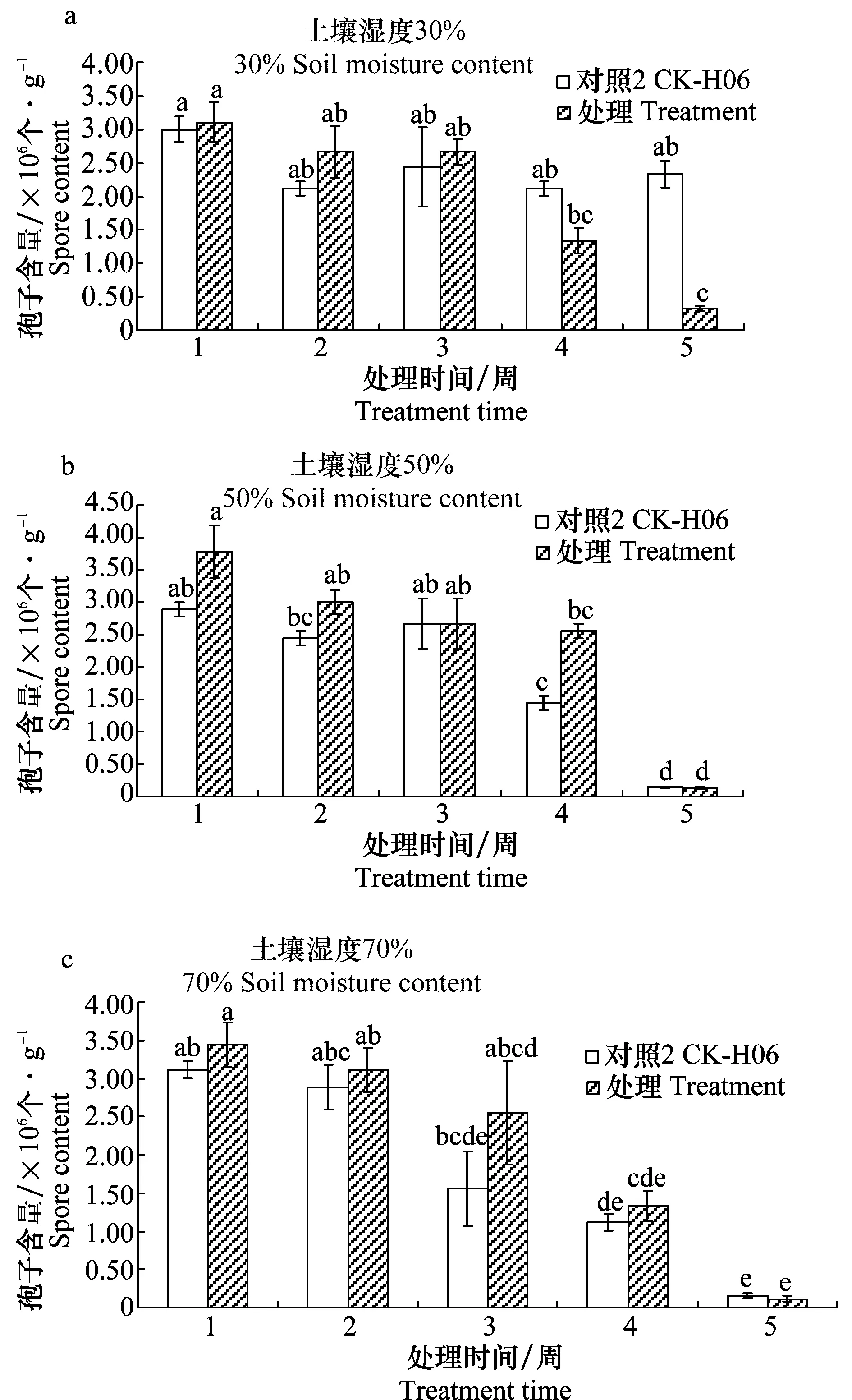
图2 不同土壤湿度条件对木霉孢子含量的影响1)
表1不同处理时间镰刀菌和木霉含量与土壤湿度的Pearson’s相关系数1)
Table1Pearson’scorrelationcoefficientsbetweentheamountofTrichodermavirideandFusariumoxysporumandsoilmoisturecontentsunderdifferentprocessingtimes
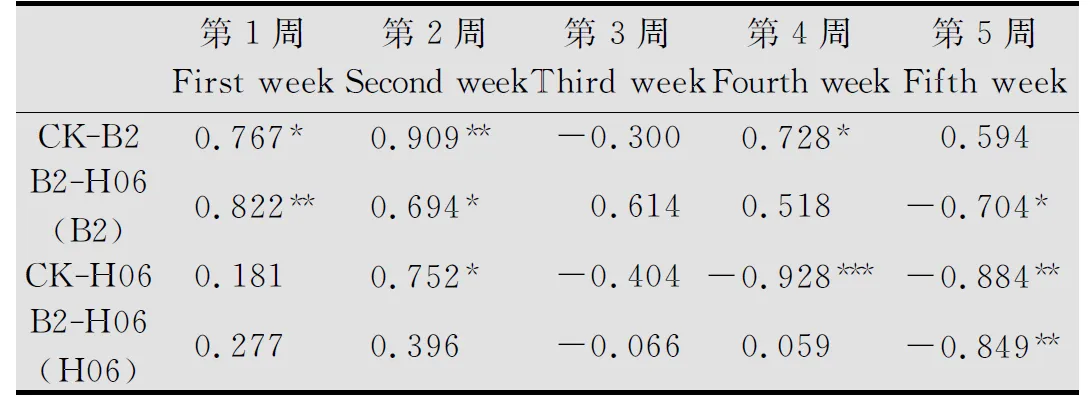
第1周Firstweek第2周Secondweek第3周Thirdweek第4周Fourthweek第5周FifthweekCK⁃B20.767∗0.909∗∗-0.3000.728∗0.594B2⁃H06(B2)0.822∗∗0.694∗0.6140.518-0.704∗CK⁃H060.1810.752∗-0.404-0.928∗∗∗-0.884∗∗B2⁃H06(H06)0.2770.396-0.0660.059-0.849∗∗
1)*P< 0.05,**P<0.01,***P< 0.001。
2.3 不同处理时间镰刀菌和木霉含量与土壤湿度的相关性
由表1可知,第1、2周,对照1(CK-B2)与处理(B2-H06)的镰刀菌含量与土壤湿度呈显著正相关;在第5周,处理(B2-H06)的镰刀菌和木霉含量与土壤湿度呈显著负相关。
2.4 不同土壤湿度条件镰刀菌和木霉含量与处理时间的相关性
由表2可知,在不同土壤湿度条件下,对照1(CK-B2)与处理(B2-H06)的镰刀菌含量与处理时间呈极显著负相关。除30%土壤湿度的对照2(CK-H06)的木霉含量外,其余处理的木霉含量都与处理时间呈极显著负相关。
表2不同土壤湿度镰刀菌和木霉孢子含量与处理时间的Pearson’s相关系数1)
Table2Pearson’scorrelationcoefficientsbetweentheamountofTrichodermavirideandFusariumoxysporumandprocessingtimeunderdifferentsoilmoisturecontents
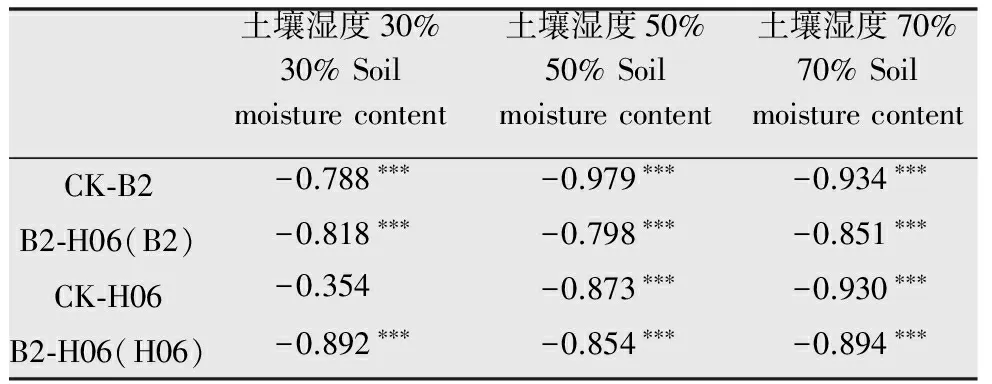
土壤湿度30%30%Soilmoisturecontent土壤湿度50%50%Soilmoisturecontent土壤湿度70%70%SoilmoisturecontentCK⁃B2-0.788∗∗∗-0.979∗∗∗-0.934∗∗∗B2⁃H06(B2)-0.818∗∗∗-0.798∗∗∗-0.851∗∗∗CK⁃H06-0.354-0.873∗∗∗-0.930∗∗∗B2⁃H06(H06)-0.892∗∗∗-0.854∗∗∗-0.894∗∗∗
1)*P< 0.05,**P<0.01,***P< 0.001。
3 讨论
本研究对绿色木霉在不同土壤湿度条件下对尖孢镰刀菌的影响进行了探讨。结果表明,在不同土壤湿度条件下,木霉对尖孢镰刀菌的影响是一致的;即前4周,在试验的3种不同土壤湿度条件下,接种木霉均能有效降低尖孢镰刀菌的含量,这与吴石平[13]关于木霉降低辣椒根际尖孢镰刀菌数量的结果一致,其机理在于木霉生命力极强、繁殖速度快, 对生存空间和营养资源竞争能力极高, 可排斥和抑制尖孢镰刀菌[14]。第5周,3种不同土壤湿度条件下,接种木霉均不能显著降低尖孢镰刀菌数量,这可能是由于后期木霉自身数量的下降而导致的。
有关土壤湿度对镰刀菌及木霉数量的影响,几乎未见研究报道。本试验第1、2周,处理(B2-H06)的镰刀菌含量随着土壤湿度的增加而增加,这可能与早期尖孢镰刀菌分生孢子萌发时湿度越高,萌发率越高有关[16]。第3、4周,土壤湿度对处理(B2-H06)的镰刀菌含量影响不大;第5周,处理(B2-H06)的镰刀菌含量随着土壤湿度的增加而降低。土壤湿度对木霉数量的影响趋势为:第1~4周,土壤湿度对处理(B2-H06)的木霉含量影响不大;第5周,随着土壤湿度的增加处理(B2-H06)的木霉含量降低。
在同一湿度条件下,不同处理时间,木霉自身数量前3周没有明显波动,后两周数量下降。这和杜婵娟[7]关于木霉在土壤中的存活数量呈先上升后下降的趋势的结果部分不一致,这可能与本研究木霉在土壤里的初始数量(107个/g)相对高;而杜婵娟的木霉在土壤的初始数量(106个/g)相对低有关系。
土壤是一个复杂的生态环境,木霉在田间防控香蕉枯萎病时,容易受到土壤 pH、温度、水分、有机质等诸多环境因素的影响,因此相关环境因子对木霉菌应用效果的影响仍需进一步研究和探讨。
[1]王振中. 香蕉枯萎病及其防治研究进展[J]. 植物检疫, 2006, 20(3):198-200.
[2]杨永华, 姚健, 华晓梅. 农药污染对土壤微生物群落功能多样性的影响[J].微生物学杂志,2000,20(2): 23-25, 47.
[3]郭润芳, 刘晓光, 高克祥,等. 拮抗木霉菌在生物防治中的应用与研究进展[J]. 中国生物防治, 2002,18(4):180-184.
[4]吴琳,黄华平,杨腊英,等.拮抗香蕉枯萎病镰刀菌木霉菌株的分离筛选[J].热带作物学报,2010,31(1):106-110.
[5]钟小燕,梁妙芬,甄锡壮,等.木霉菌对香蕉枯萎病菌的抑制作用[J].果树学报,2009, 26(2):186-189.
[6]Thangavelu R, Palaniswami A, Velazhahan R. Mass production ofTrichodermaharzianumfor managing fusarium wilt of banana[J]. Agriculture, Ecosystems and Environment, 2004, 103:259-263.
[7]杜婵娟,付岗,潘连富,等. 木霉制剂对土壤微生物数量和香蕉枯萎病的影响[J].西南农业学报,2013, 26(3):1030-1033.
[8]Penga H X, Sivasithamparama K, Turner D W. Chlamydospore germination andFusariumwilt of banana plantlets in suppressive and conducive soils are affected by physical and chemical factors[J]. Soil Biology and Biochemistry, 1999,31:1363-1374.
[9]Dominguez J, Negrin M A, Rodriguez C M. Aggregate water-stability, particle-size and soil solution properties in conducive and suppressive soils toFusariumwilt of banana from Canary Islands (Spain)[J]. Soil Biology & Biochemistry, 2001, 33: 449-455.
[10]Domínguez J, Negrín M A, Rodríguez C M. Evaluating soil sodium indices in soils of volcanic nature conducive or suppressive toFusariumwilt of banana[J]. Soil Biology & Biochemistry, 2003,35:565-575.
[11]沈萍,范秀容,李广武. 微生物学实验[M]. 北京:高等教育出版社,1998:92-95.
[12]景晓辉, 吴伦英, 区小玲,等. 一种简便分离香蕉枯萎病菌的选择性培养基[J]. 热带作物学报, 2009, 30(11):1671-1673.
[13]吴石平,燕嗣皇,陈小均,等.木霉生防菌尖孢镰刀菌和青枯假单胞菌在辣椒根际的互作[J].西南农业学报,2005, 18(3):269-273.
[14]田连生, 李书生, 史延茂. 利用玉米秸秆制备生物杀菌剂的研究[J]. 中国生态农业学报, 2005,13(2):59-61.
[15]张彩玲,陆宗芳,王永全.环境因素对尖孢镰刀菌分生孢子萌发的影响[J].甘肃农业科技,2008(2):5-8.
EffectofTrichodermavirideonamountofFusariumoxysporumunderdifferentsoilmoisturecontents
Liang Changcong, Liu Lei, Zhang Jianhua, Guo Lijia, Wang Jun, Huang Junsheng
(InstituteofEnvironmentalandPlantProtection,CATAS/KeyLaboratoryofIntegratedPestManagementonTropicalCrops,MinistryofAgriculture/HainanKeyLaboratoryforMonitoringandControlofTropicalAgriculturalPests,Haikou571101,China)
The colonization ofTrichodermaviridein the soil and the effect ofT.virideon the amount ofFusariumoxysporumwere studied by plate culture count method. The results showed that the amount ofF.oxysporumdecreased significantly by the inoculation ofT.virideunder three soil moisture contents during the first four weeks. The amount ofT.viridein the treatment group was not significantly changed compared to control group 2 during the first five weeks. There was no positive correlation between the soil moisture content and the amount ofF.oxysporumin the control group 1 and treatment group during the 1st and 2nd weeks. The amount ofF.oxysporumandT.viridein the treatment group were negatively correlated with the soil moisture in the 5th week.
Trichodermaviride; soil moisture content;Fusariumoxysporum
2013-10-10
:2014-01-24
公益性行业(农业)科研项目(200903049)
S 476
:ADOI:10.3969/j.issn.0529-1542.2014.05.016
* 通信作者 E-mail: h888111@126.com

