甘肃省马铃薯束梗褐腐病病原鉴定及其生物学特性研究
陈泰祥, 陈秀蓉, 杨成德, 朱海波, 王涵琦, 卞 静
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,兰州 730070)
甘肃省马铃薯束梗褐腐病病原鉴定及其生物学特性研究
陈泰祥, 陈秀蓉*, 杨成德, 朱海波, 王涵琦, 卞 静
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,兰州 730070)
对甘肃省马铃薯(SolanumtuberosumL.)束梗褐腐病病原进行了分离鉴定和生物学特性研究。经形态特征观察与rDNA-ITS序列分析,将病原菌鉴定为细基束梗霉[Doratomycesstemonitis(Pers.exFr.) F.J. Morton & G. Smith]。生物学特性研究结果表明,病菌菌丝生长最适温度为25~30 ℃,最适pH为6, 病菌能利用多种碳源,但以蔗糖最好,氮源以甘氨酸最适,光照对菌丝生长没有影响。分生孢子在5~40 ℃范围内均能萌发,最适25 ℃,最适pH为7,分生孢子萌发需液态水,湿度低于99%几乎不萌发,马铃薯汁液和葡萄糖液对孢子萌发有较好的促进作用。本研究为马铃薯束梗褐腐病的防治提供了理论依据。
马铃薯; 细基束梗霉; 病原分离鉴定; 生物学特性
马铃薯(SolanumtuberosumL.)是甘肃省最具优势的地方特色粮食作物,全省87个县(市、区)中有60多个县种植马铃薯,特别是定西有着“中国马铃薯之乡”的美称[1]。近年来,随着农业生产水平的提高,马铃薯种植规模不断扩大,马铃薯储藏期病害的发生和危害程度也愈加广泛和严重。甘肃省已报道的马铃薯储藏期病害有13种,主要有晚疫病、干腐病、炭疽病、丝核病、坏疽病、软腐病、疮痂病和病毒病等[2-6],病害发生造成大量烂薯,严重影响马铃薯产量和商品价值,所以有效地控制马铃薯储藏期病害成为生产上亟待解决的问题。自2009年以来,甘肃省储藏期马铃薯发生一种不常见病害,发病薯块组织变褐腐烂,并形成扁平的不规则腔室,严重影响薯块的品质。据调查,部分地区发病率高达20%~30%,而且病情逐年加重,发生面积不断扩大,给生产上马铃薯的储藏和供应带来了较严重影响,已逐渐成为甘肃省马铃薯储藏期的主要病害之一。关于此病害的研究,李金花[6]从采自张掖的病薯中分离到了该病菌,并对其病原进行了描述,认为是具柄细基束梗孢 (Cephalotrichumstemonitis),有文献记载该病原菌能侵染储藏期的马铃薯引起褐腐病,还能够从水稻、玉米种子中分离到,并且曾从中华绣线梅和土壤中也分离到了该菌[7]。而该病害的病原生物学特性未见研究报道,因此,笔者对马铃薯褐腐病的病原以及生物学特性进行了较系统的研究,旨在为有效防治此病害提供依据。
1 材料和方法
1.1 材料
1.1.1 病薯来源
分别于2012年10月和2013年3月采自定西市安定区、张掖市肃南县、山丹县、民乐县,武威市天祝县等地的马铃薯储藏库中。采后置于封口塑料袋中,保持新鲜状态,带回实验室,观察症状,描述并拍照。
1.1.2 供试仪器
NIKON光学显微镜,NIKON图像分析系统,PHS-3 c精密数显酸度计,Bioneer水平凝胶电泳装置,Bioneer PCR热循环仪,Bioneer凝胶成像系统,Biometra高速冷冻离心机等。
1.1.3 供试试剂
Rnase, Proteinase K,PCR Master Mix, Marker购于上海生工生物技术公司,通用引物ITS1(5′-TCC GTA GGT GAA CCT GCG G-3′)ITS4(5′-TCC TCC GCT TAT TGA TAT GC-3′)由上海生工生物技术公司合成,其他化学试剂均采用国产分析纯。
1.1.4 供试培养基
PDA、Czapek培养基[8]。
1.2 方法
1.2.1 病原分离
采用组织分离法在PDA上进行病原菌的分离。
1.2.2 病原菌致病性测定
根据柯赫氏法则[8],用病菌分生孢子悬浮液分别以有伤(针刺伤)和无伤方式接种于健康的马铃薯薯块上,并保湿。每处理3个重复,以接清水为对照。发病后从病健交界处再次分离病原菌。
1.2.3 病原菌鉴定
1.2.3.1病原菌形态学鉴定
将病菌接种于PDA平板,置25 ℃培养箱培养,观察菌落颜色、形状、气生菌丝疏密程度。在显微镜下观察分生孢子、产孢细胞、孢梗束形态并显微拍照,测量50个分生孢子的大小。根据病原形态,参照相关文献[7-9]进行病原鉴定,确定病原属种。
1.2.3.2病原菌rDNA-ITS序列分析及系统发育地位
(1)DNA的提取
将病原菌接种于PDA培养液中,于25 ℃、150 r/min条件下振荡培养4~5 d后收集菌丝,采用SDS和氯化苄结合法[10]提取基因组总DNA。
(2)rDNA-ITS扩增与序列测定
采用通用引物ITS1和ITS4扩增病菌rDNA-ITS片段。PCR反应体系为50 μL:即DreamTaqGreen PCR MasterMix(2×)25 μL,ITS1(10 mmol/L)1.0 μL,ITS4(10 mmol/L)1.0 μL,DNA模板1.0 μL,ddH2O 22 μL,以不加DNA模板而加等量ddH2O为阴性对照。根据预试验结果优化组合而得出以下PCR扩增反应程序:94 ℃预变性3 min,以下共30个循环(94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min),最后72 ℃延伸8 min。PCR产物经0.8%琼脂糖凝胶电泳检测后,送上海生工生物技术公司进行测序。
(3)序列比对和系统发育树的构建
将病原菌rDNA-ITS序列在NCBI上用BALST进行同源性比较后,下载同源序列,用Clustal(version 1.81)进行多重序列匹配排列(multiple alignments)分析,形成一个多序列匹配排列阵,然后用Mega(version 4.0) 通过邻接法(neighbor-joining)构建系统发育树[11]。
1.2.4 病原菌生物学特性测定
1.2.4.1病原菌菌丝生长测定
(1)温度对病原菌菌丝生长的影响
用直径为0.5 cm的打孔器在菌落边缘打取菌饼,接种于PDA平板中央,分别置于5、10、15、20、25、30、35 ℃和40 ℃的恒温培养箱培养,每处理3次重复,15 d后十字交叉法测量菌落直径。
(2)pH对病原菌菌丝生长的影响
用HCl和NaOH将PDA的pH分别调成4、5、6、6.5、7、8、9、10、11,每处理3次重复,25 ℃恒温培养,接种、菌丝生长测量方法同1.2.4.1(1),(下同)。
(3)碳源对病原菌菌丝生长的影响
以Czapek培养基为基础培养基,分别以乳糖、D-甘露糖、D-半乳糖、D-果糖、D-木糖、葡萄糖、麦芽糖、L-山梨糖、可溶性淀粉等量替换(添加量均为3%)蔗糖配制成含不同碳源的培养基。以不加碳源为对照,每处理3次重复 ,25 ℃恒温培养15 d。
(4)氮源对病原菌菌丝生长的影响
以Czapek培养基为基础培养基,分别以硝酸钾、酵母膏、蛋白胨、硫酸铵、天门冬酰胺、甘氨酸、L-组氨酸、L-色氨酸、L-亮氨酸、L-精氨酸、DL-苏氨酸、L-酪氨酸、牛肉膏等量替换(添加量均为0.2%)硝酸钠配制成含不同氮源的培养基,以不加氮源为对照,每处理3次重复,25 ℃恒温培养15 d。
(5)光照对病原菌菌丝生长的影响
将直径为0.5 cm菌饼接种于PDA平板中央,分别置于24h/d光照、光暗自然交替、24 h/d黑暗条件下25 ℃恒温培养15 d,每处理3次重复。
1.2.4.2病原菌分生孢子萌发的测定
(1)温度对病原菌分生孢子萌发的影响
采用悬滴法,将适当浓度的孢子悬浮液滴在盖玻片上,盖至孢子萌发器上。分别置于5、10、15、20、25、30、35和40 ℃的恒温条件下培养,于18 h后镜检孢子萌发率。每处理3次重复,每次镜检不少于200个孢子(下同)。
(2)湿度对病原菌分生孢子萌发的影响
在干燥器内用硫酸法控制湿度[8],将孢子粉撒于载玻片上,置于相对湿度为99%、95%、 90%和85%条件下室温(20~22 ℃)培养。以蒸馏水中孢子萌发率为对照,于18 h后挑取各处理孢子,无菌水制片,检查萌发率。
(3)pH对病原菌分生孢子萌发的影响
用磷酸二氢钾和磷酸氢二钠缓冲液将孢子悬浮液pH配制为3、4、5、6、7、8、9、10、11。25 ℃恒温培养,于18 h后镜检孢子萌发率。
(4)营养液对病原菌分生孢子萌发的影响
以浓度为1∶5,1∶10,1∶20的马铃薯汁液、葡萄糖液和土壤浸渍液配制孢子悬浮液,置于25 ℃条件下恒温培养,于18 h后镜检孢子萌发率[12]。
1.2.5 数据处理
以上各试验所得数据,采用IBM SPSS Statistics 19.0软件进行差异显著性分析(DMRT法)。
(四)在国内产能过剩的情况下,中国光伏“走出去”的步伐将进一步加快,以产融结合、厂商租赁等模式将产能向西方国家以及“一带一路”沿线国家转移,将成为中国未来光伏产业持续健康发展的现实选择。
2 结果与分析
2.1 病害症状
根据调查,此病害主要发生在储藏期的薯块上,据观察,从各地采集的病薯症状基本一致,多在芽眼处产生中小型灰褐色凹陷斑,斑上有开裂小孔,病菌向薯块内部扩展,组织变褐腐烂,并形成扁平的不规则腔室。向外靠健康组织的部分变为褐色似木栓化,靠腔室一边为较厚的黑色菌丝层,其上产生灰黑色菌丝,菌丝上产生直立的暗褐色粗壮束梗,梗的上部膨大成长椭圆体,基部较细,成丛产生,状如毛刷,肉眼可见(图1)。
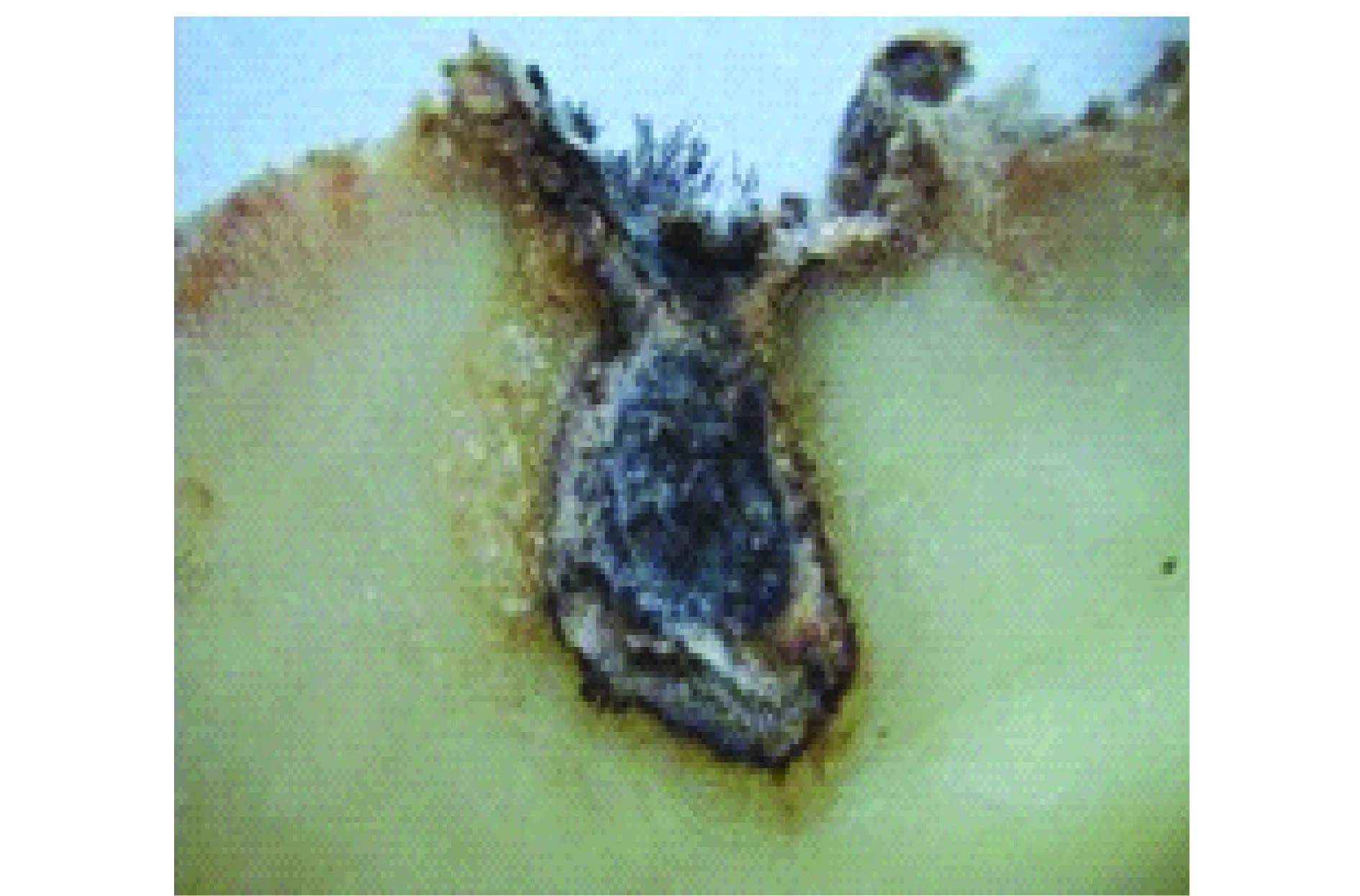
图1 马铃薯褐腐病症状
2.2 致病性测定结果
接种15 d后接菌部位症状较明显,与自然发病的症状相似,病部边缘凹陷,菌丝体从边缘生长而出,菌丝体褐色,绒状,对照表面边缘凹陷但没有任何病状;薯块接菌部位内部褐色发黑,向内扩展(图2a),对照无此症状(图2b),再次分离,从接种的薯块上获得了与原接种菌相同的病原菌,证明该菌为马铃薯褐腐病的病原菌。

图2 病原菌对马铃薯致病性测定
2.3 病原菌鉴定
2.3.1 病原菌培养特性及形态特征
据观察,该菌在PDA上培养15 d后菌落背面灰褐色,呈细绒状,菌落呈放射状生长(图3 b),菌落正面灰褐色,外圈有白色的绒状生长圈,菌落表面绒状,深浅不匀(图3a)。
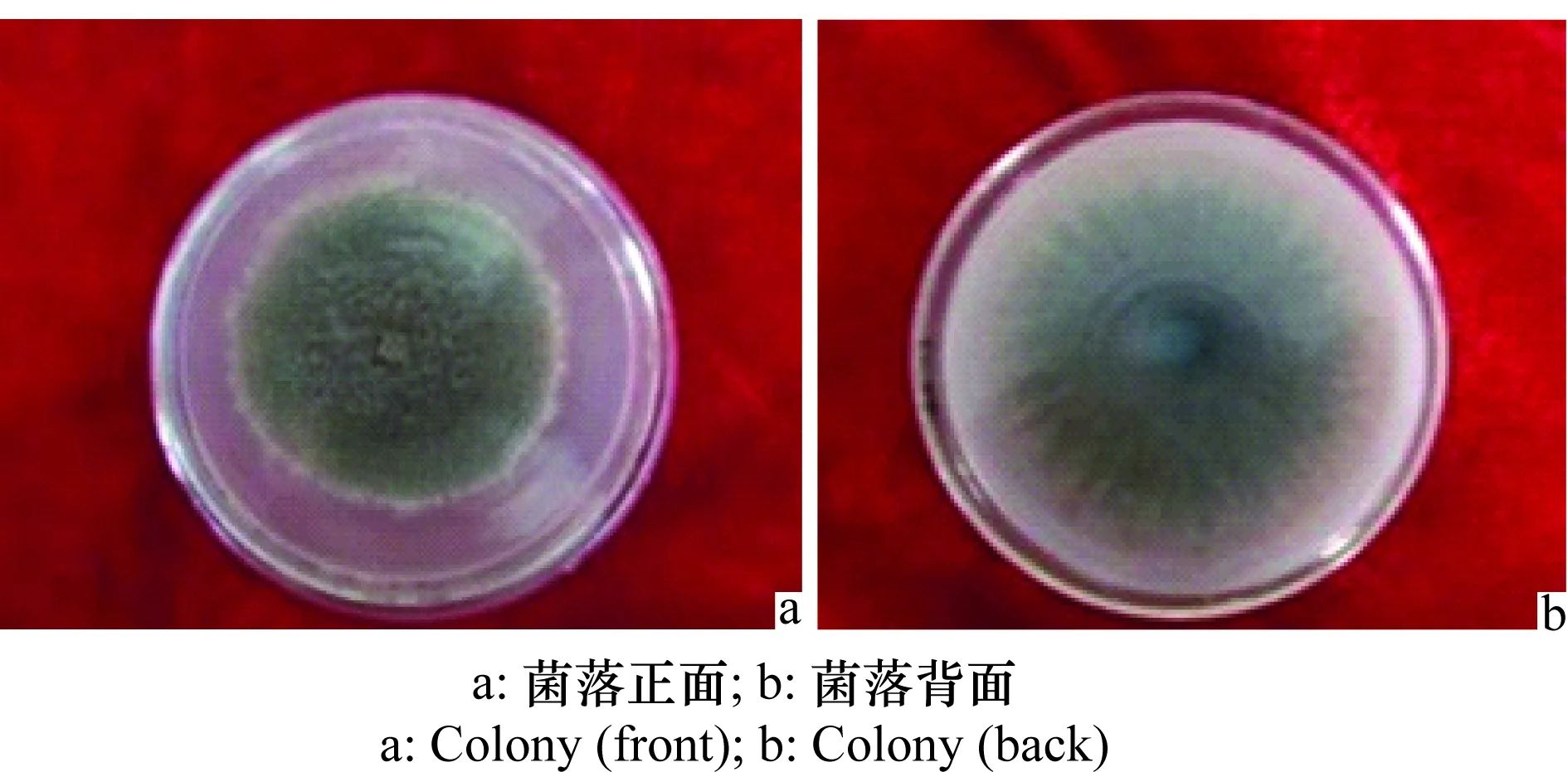
图3 马铃薯褐腐病病菌菌落形态
病原菌菌丝体初无色,后变淡褐至褐色,有隔。分生孢子梗束状簇生(见图4 a,b),最多有7根;束梗基部有假根(棒状体短于束梗)。梗的中上部有3~5个分枝,分枝顶部膨大呈棒状或长椭圆体(图4 d)。
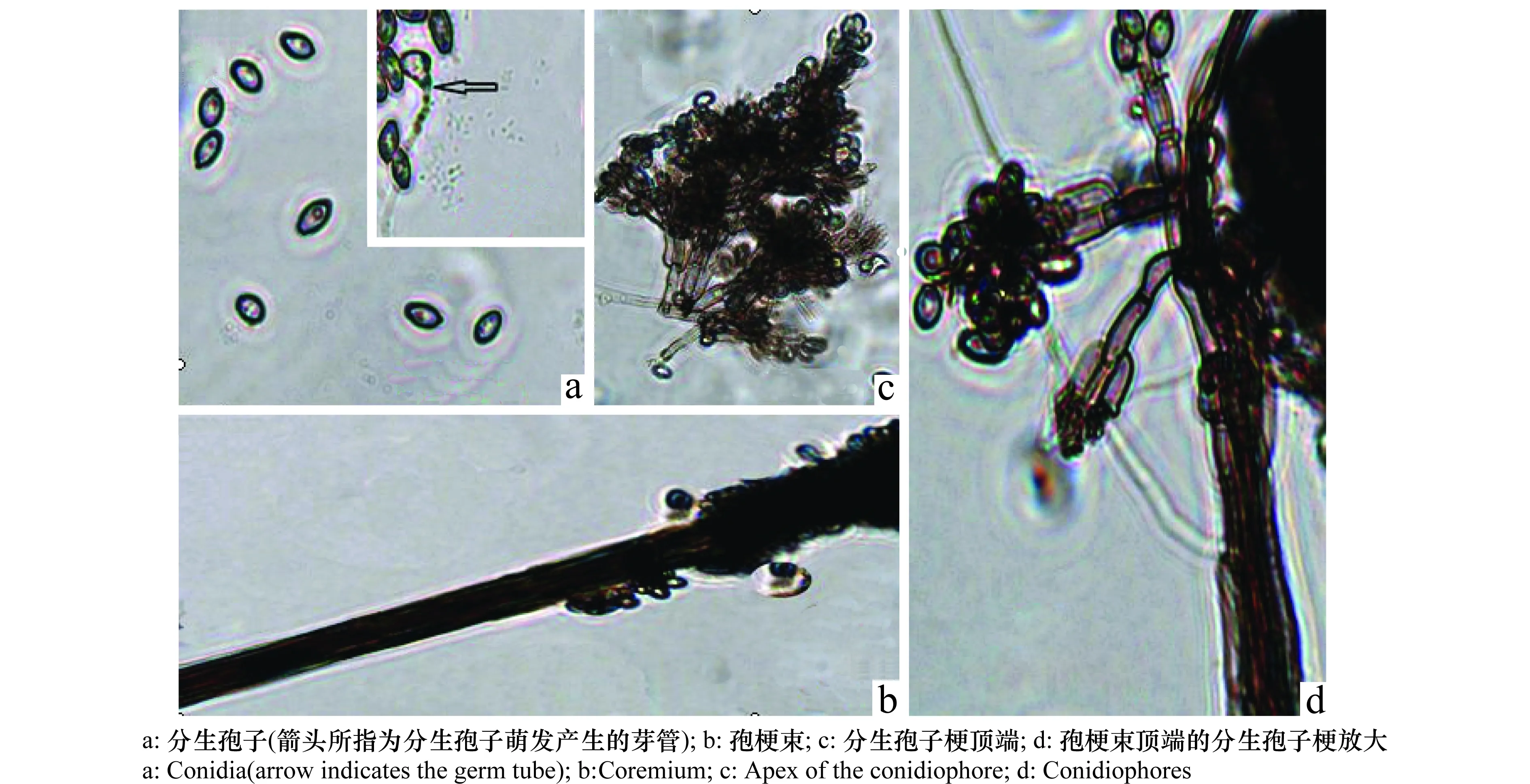
图4 马铃薯褐腐束梗霉(Doratomyces stemonitis)显微形态
2.3.2 病菌rDNA-ITS序列分析
测序结果表明,该病菌(S1)序列长度为586 bp(图5),经BLAST分析,与病菌测定序列同源性达97%~99%的菌株均为Doratomycesspp.下载相似性最高的序列,进一步用Clustal(version 1.81)和Mega(version 4.0) 通过邻接法(neighbor-joining)构建系统发育树。该病菌在系统发育树中与Doratomycesstemonitis(登录号FJ914696.1)聚在一起(图6),说明其亲缘关系最近,从分子水平上进一步鉴定该病原菌为Doratomycesstemonitis。
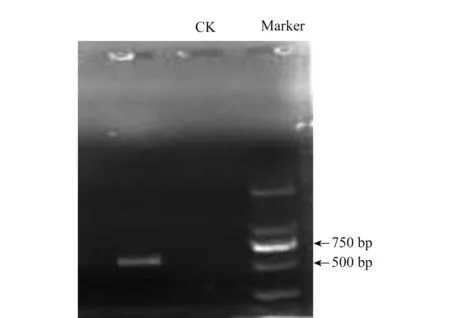
图5 马铃薯褐腐病病菌rDNA-ITS PCR电泳图

图6 马铃薯褐腐病病菌系统发育树
2.4 病原菌菌丝生长测定结果
2.4.1 温度对病原菌菌丝生长的影响
测定结果(图7)表明,在5~35 ℃范围内均能生长,以25~30 ℃条件下生长最快,30 ℃菌落直径达67 mm,低于5 ℃和超过35 ℃停止生长。表明该菌适宜生长温度为25~30 ℃。
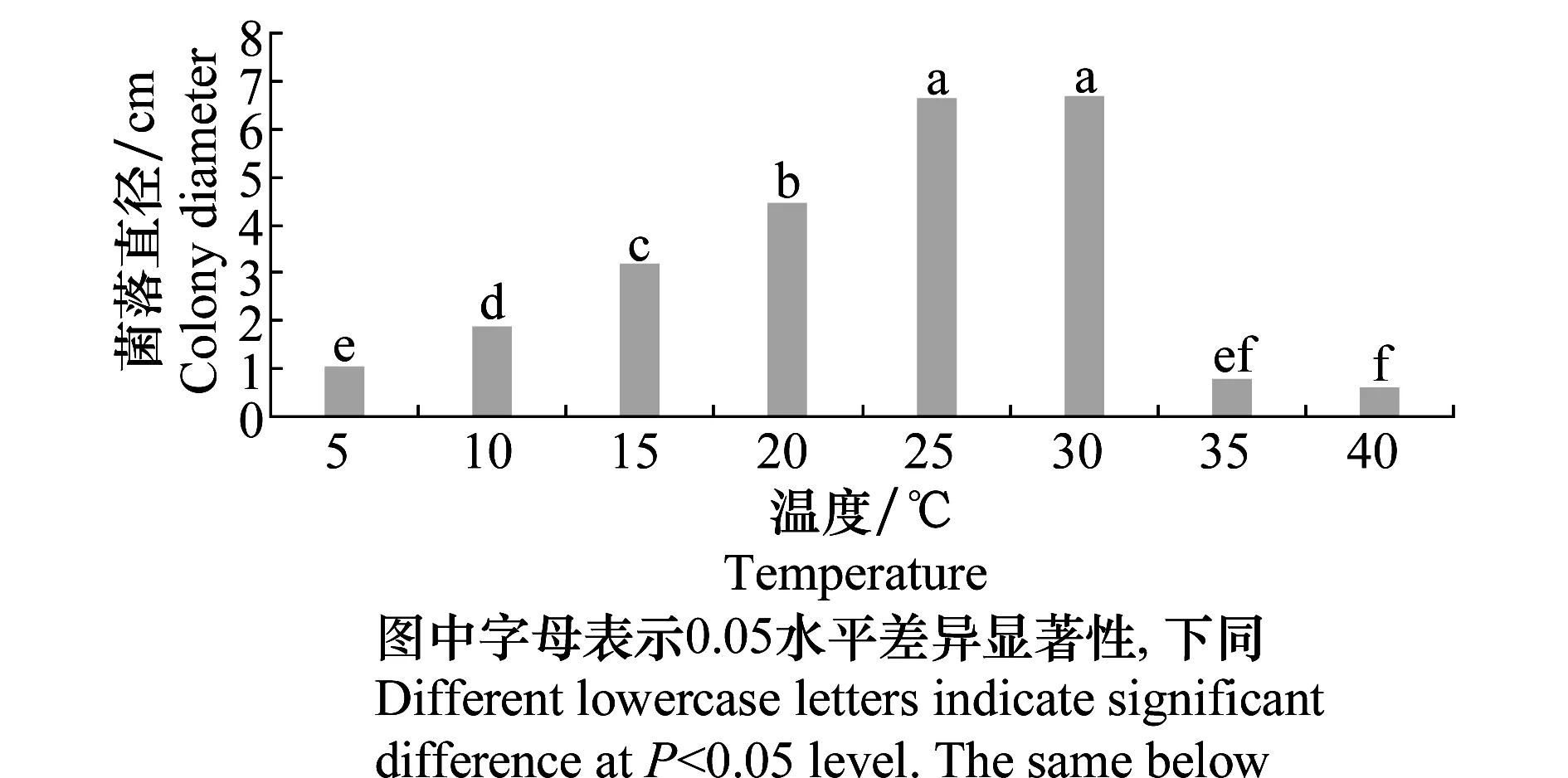
图7 温度对马铃薯褐腐病菌菌丝生长的影响
2.4.2 pH对病原菌菌丝生长的影响
不同pH对菌丝生长影响(图8)有明显差异,菌丝在4~11范围内均能生长,最适pH为6。pH 4~5和pH 9~11菌丝虽能生长成正常菌落,但生长缓慢。此菌对酸度的适应范围广并偏好略带酸性的培养条件,而马铃薯汁液呈中性偏酸性,可见该病菌侵染马铃薯后在适宜的温湿度条件下可迅速蔓延。
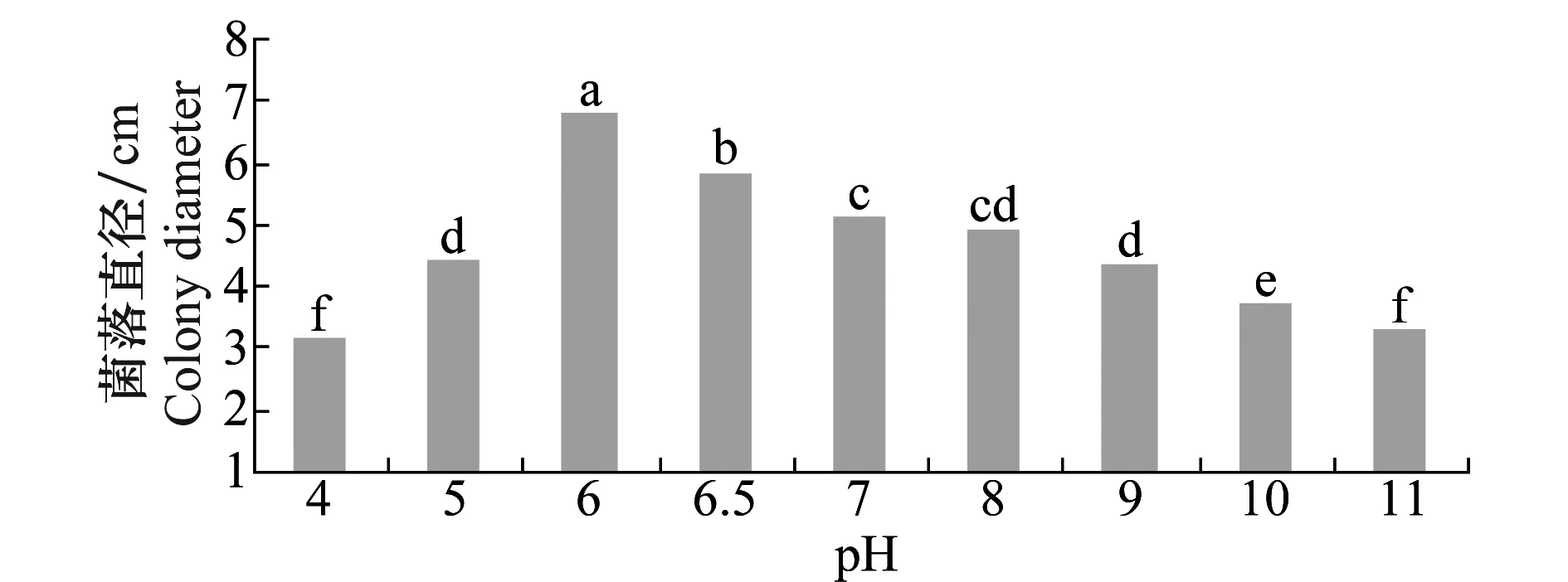
图8 pH对马铃薯褐腐病菌菌丝生长的影响
2.4.3 碳源对病原菌菌丝生长的影响
从测定结果(图9)可见,该病菌对单糖、双糖多糖等碳源都能利用,各供试碳源除L-山梨糖外菌落直径均大于对照菌落直径,且方差分析差异显著, L-山梨糖抑制该病原菌的生长。可见该菌对碳源的需求不严格。
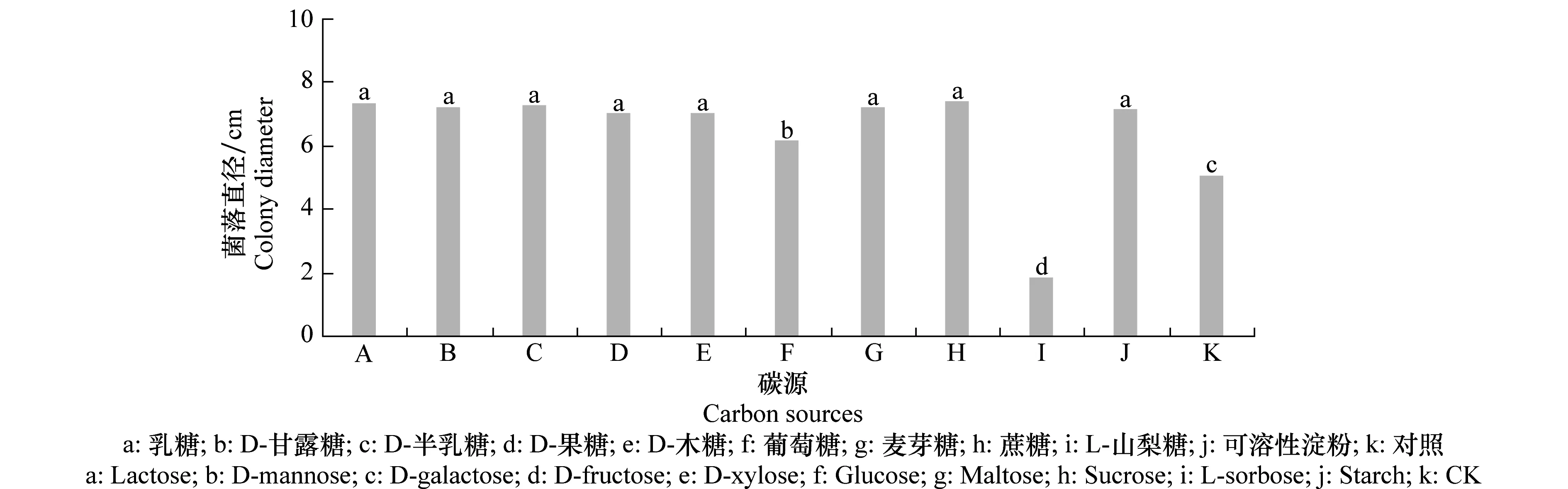
图9 不同碳源对马铃薯褐腐病菌菌丝生长的影响
2.4.4 氮源对病原菌菌丝生长的影响
从测定结果(图10)可见,病菌对氮源的利用表现明显差异。其中甘氨酸、硫酸铵、天门冬酰胺最适合菌丝生长,在以硝酸钾、酵母膏和DL-苏氨酸为氮源的培养基上生长良好,而L-组氨酸、L-色氨酸和L-精氨酸等几种氮源抑制菌丝的生长。

图10 不同氮源对马铃薯褐腐病菌菌丝生长的影响
2.4.5 光照对病原菌菌丝生长的影响
测定结果(表1)表明,不同光照条件下病菌菌丝生长速度基本一致,菌落直径均在63~70 mm之间,方差分析差异不显著。说明该病原对光照不敏感,在光照和黑暗条件下均可正常生长。
表1光照对马铃薯褐腐病菌菌丝生长的影响
Table1EffectsofilluminationonmycelialgrowthofDoratomycesstemonitis

处理Treatment菌落直径/mmAveragegrowthofcolony暗、光自然交替Dark,lightalternation(66.0±2.00)a24h/d黑暗24h/ddark(65.3±4.04)a24h/d光照24h/dlight(61.7±5.69)a
2.5 病原菌分生孢子萌发测定结果
2.5.1 温度对病原菌分生孢子萌发的影响
试验结果(图11)表明,病菌分生孢子在5~40 ℃范围内均能萌发,20~30 ℃内萌发率保持在较高的水平。最适萌发温度为25 ℃,18 h萌发率达90%以上,在5 ℃和40 ℃条件下有20%左右分生孢子可以萌发,表明此菌对温度的要求不严格,这种特性有利于其种群的生存和繁衍。
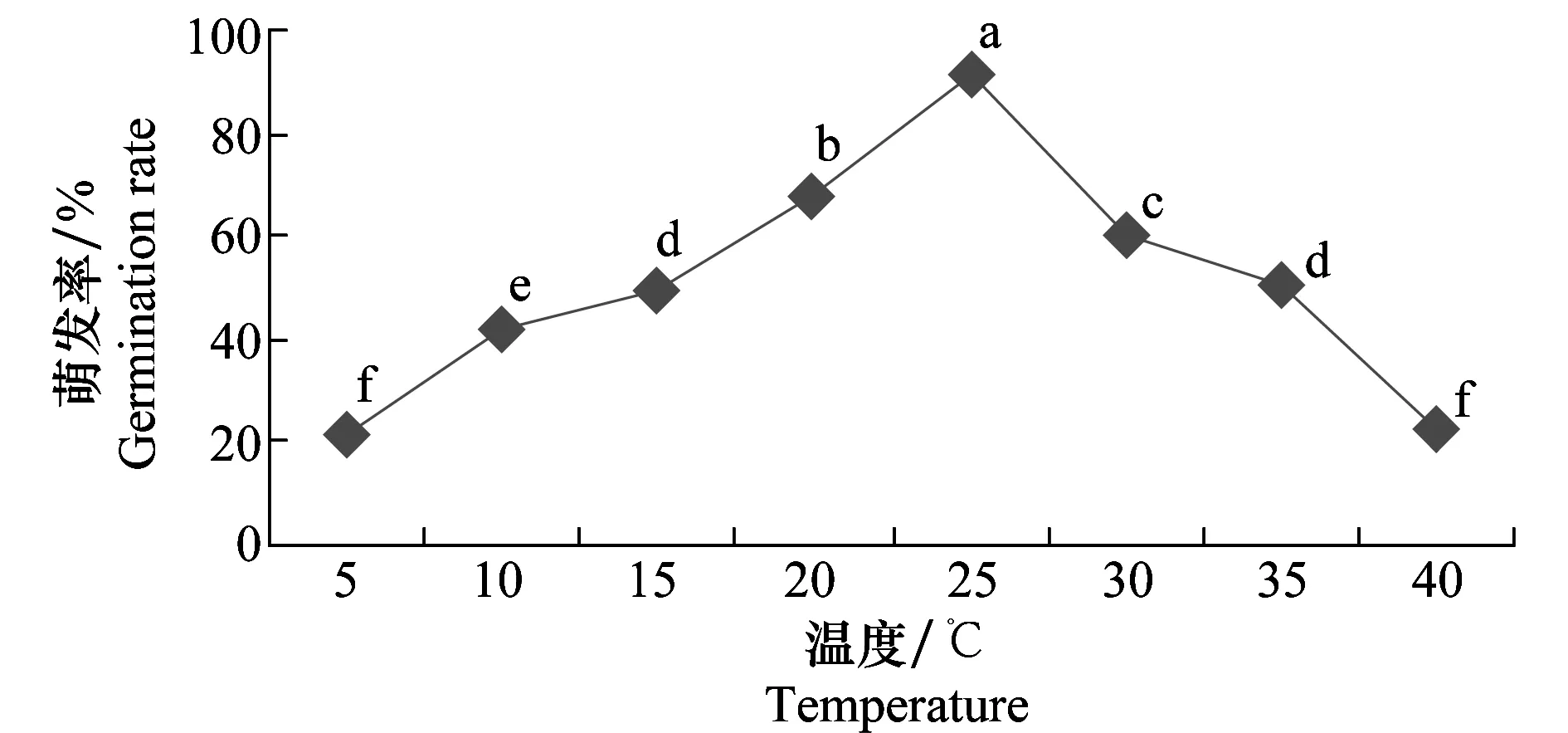
图11 温度对马铃薯褐腐病菌分生孢子萌发的影响
2.5.2 湿度对病原菌分生孢子萌发的影响
试验结果表明:湿度99%时,18 h后仅有少数萌发,萌发率不及8%,湿度99%以下的各处理萌发率为零,而水滴中18 h萌发率已达76%,表明该病菌分生孢子的萌发需要液态水。
2.5.3 pH对病原菌分生孢子萌发的影响
试验结果(图12)表明,病菌分生孢子在pH 4~11范围内均能萌发,pH 3不萌发,最适萌发pH为7,pH 4、10、11虽能萌发,但芽管较其他pH的短。可见孢子萌发对pH要求不严格。
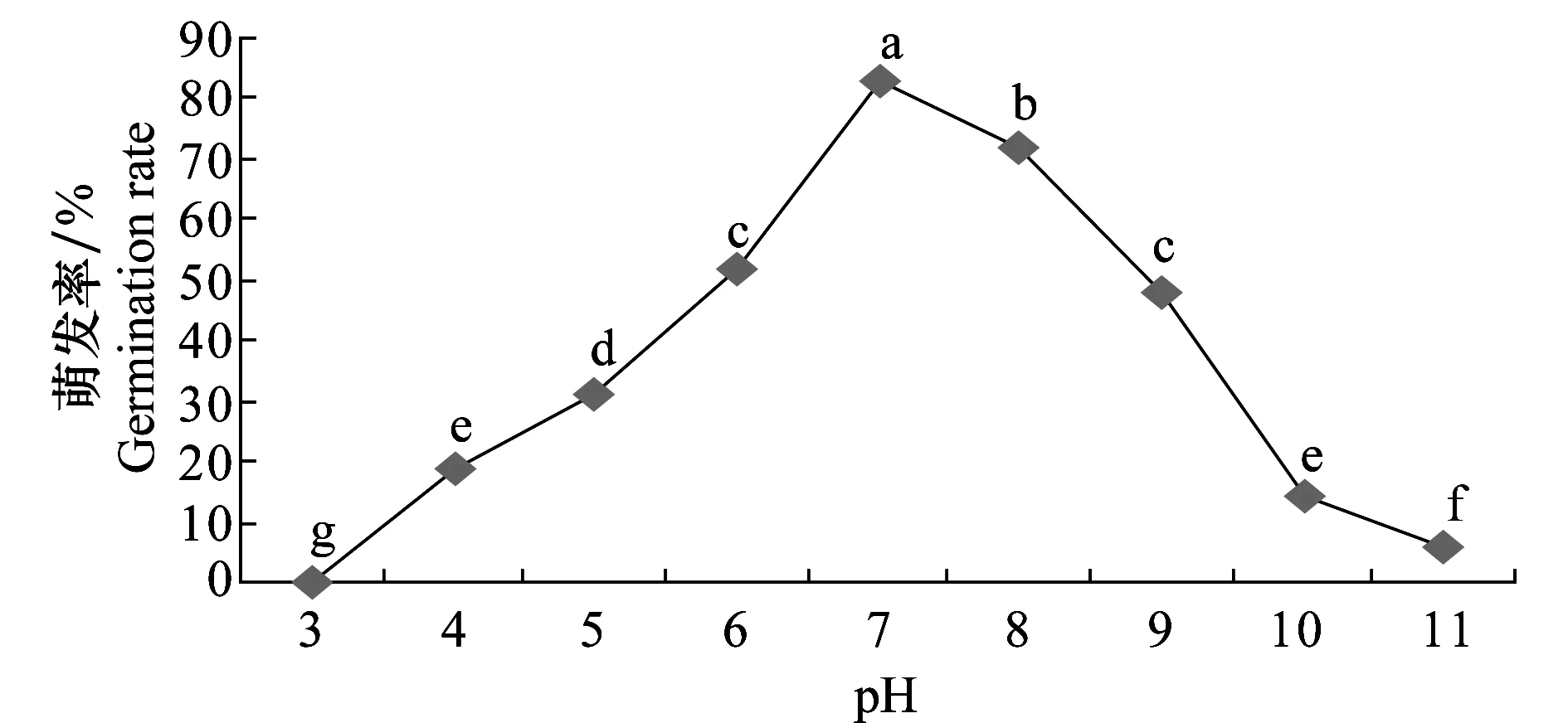
图12 pH对马铃薯褐腐病菌分生孢子萌发的影响
2.5.4 营养液对病原菌分生孢子萌发的影响
分生孢子在葡萄糖液中的萌发最好(图13),12 h萌发率已达72%以上,1∶5的葡萄糖液中高达92%,其次为马铃薯汁液各处理浓度,萌发率为51%~79%,显著高于对照萌发率,说明该病菌侵染寄主后在适宜的温湿度条件下可迅速蔓延,而土壤浸渍液各处理浓度萌发率和对照无显著差异,表明土壤浸渍液对分生孢子的萌发没有促进作用。
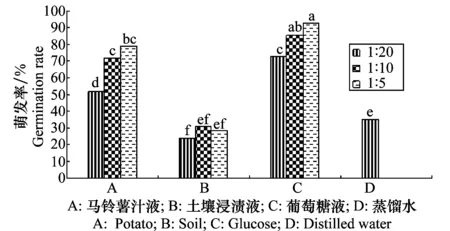
图13 营养液对马铃薯褐腐病菌分生孢子萌发的影响
3 讨论
通过形态学观察结合分子生物学方法将甘肃省马铃薯褐腐病病原鉴定为马铃薯褐腐束梗霉[Doratomycesstemonitis(Pers.exFr.) F.J. Morton & G. Smith]。李金花于2007年报道[6]从采自甘肃张掖的病薯上分离到该菌,只对其形态进行了描述,未做致病性测定及生物学特性研究。白容霖于1999年报道此菌能侵染人参引起黑腐病[13],发病症状与侵染马铃薯症状相似:病斑呈椭圆形或不规则形凹陷, 黑褐色, 病斑边缘明显, 发病后期参根组织呈现黑朽状,形成空腔。在湿度大的情况下, 病斑表面丛生紫黑色绒毛状的病原菌的子实体。其描述的病原形态、大小均与本试验的病原基本一致。以上报道的病菌是否与本研究的病原为同一种、是否存在生理分化现象,还有待进一步研究。还有文献记载此菌有降解木聚糖、半纤维素以及纤维素的能力[14-15],可以从玉米、苜蓿的根际,甜菜、油菜、蚕豆的根以及多种植物的残体上分离得到,可见该菌可以腐生形式存在于田间病残体和土壤中。本研究从病原分离、致病性测定、病原鉴定及其生物学特性等方面进行了较系统的研究,是Doratomycesstemonitis引起马铃薯褐腐病在我国首次较系统的报道。
在早期文献中,束梗孢目(Stilbellales)束梗孢科 (Stilbellaceae)细基束梗霉属(Doratomyces)真菌被组合在Stysanus属下,Hughes于1958年提出将属名改为Cephalotrichum,后来 Morton 和 Smith于1963年建议将其名改为Doratomyces[13]。该属内真菌的一个显著特点是形成明显的孢梗束,Doratomycesstemonitis(Pers.exFr.) F. J. Morton & G.Smith为该属的模式种,是典型的无性型真菌。
生物学特性研究结果表明,低温、干燥不利于该菌的生长,所以在低温干燥的条件下贮藏马铃薯,可减少该病害的发生。此病原菌分离自储藏期的马铃薯薯块上,致病性测定表明伤口是病原侵染的主要途径,而且在在采挖马铃薯薯块过程中也发现部分表皮有伤口的薯块也发生有此病害,所以农事操作时要尽量减少薯块的机械损伤,以免造成伤口为病菌的侵染提供有利条件。
从碳源对菌丝生长的影响试验结果来看,此病菌能利用多种碳源,仅有以L-山梨糖为碳源的培养基抑制该病菌的生长,而有研究报道[16]称以L-山梨糖为唯一碳源时,必须添加有机氮菌株才能正常生长和产酶,L-山梨糖的作用可能是通过抑制了菌体蛋白或某些必需氨基酸、核苷酸的合成,从而影响了菌体生长和产酶的,并且这种影响发生在菌丝体指数生长期之前,而L-山梨糖对Doratomycesstemonitis的抑制机制是否与本报道一致,还有待于进一步研究。
[1]杨成德, 姜红霞, 陈秀蓉, 等. 甘肃省马铃薯炭疽病的鉴定及室内药剂筛选[J]. 植物保护,2012,38(6):127-133.
[2]魏周全, 宗世忠, 张廷义. 定西市马铃薯病害调查[J]. 中国马铃薯, 2005,19(2):124-126.
[3]文朝慧, 何苏琴, 荆卓琼. 甘肃省马铃薯坏疽病病原鉴定[J]. 植物保护,2012,38(5):40-45.
[4]费永祥, 张建朝, 邢会琴. 甘肃省马铃薯细菌性病害种类及1种新纪录病害[J]. 河西学院学报,2010,26(2): 51-53.
[5]郑军庆, 赵多长, 韩晓荣, 等. 天水市马铃薯窖藏病害调查[J]. 中国蔬菜,2011(1): 33-34.
[6]李金花, 柴兆祥, 王蒂, 等. 甘肃马铃薯贮藏期真菌性病害病原菌的分离鉴定[J]. 兰州大学学报, 2007, 42(3): 39-42.
[7]戴芳澜. 中国真菌总汇[M]. 北京: 科学出版社, 1979.
[8]方中达. 植病研究方法[M]. 第3版. 北京: 中国农业出版社,1998.
[9]魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979.
[10]张俊忠. 东祁连山高寒草地土壤真菌多样性研究[D]. 兰州:甘肃农业大学, 2010:35-36.
[11]张小媛, 何红, 胡汉桥, 等. 红海榄赤斑病病原鉴定及其生物学特性研究[J]. 植物病理学报, 2009, 39(6): 584-591.
[12]王艳, 陈秀蓉, 王引权, 等. 甘肃省当归褐斑病菌Septoriasp.生物学特性及其营养利用研究[J]. 中药材,2009,32(4):478-482.
[13]白容霖, 刘伟成. 人参黑腐病病原鉴定[J]. 特产研究, 1999(4):42-43.
[14]耿月华. 中国土壤暗色丝孢菌五个疑难属的形态学和分子系统学分析[D]. 泰安: 山东农业大学, 2011:89.
[15]宋伟. 中国秦岭太白山及周围地区土壤中的暗色丝孢菌多样性研究[D]. 泰安: 山东农业大学, 2008:106.
[16]郝学财.纤维素酶高产菌选育及发酵条件的研究[D]. 无锡: 江南大学,2006.
[17]孙俊, 刘志恒, 黄欣阳, 等. 辣椒褐斑病菌生物学特性研究[J]. 植物保护,2009,35(5):109-113.
IdentificationandbiologicalcharacteristicsofSolanumtuberosumbrownrotcausedbyDoratomycesstemonitis
Chen Taixiang, Chen Xiurong, Yang Chengde, Zhu Haibo, Wang Hanqi, Bian Jing
(PrataculturalCollegeofGansuAgriculturalUniversity;KeyLaboratoryofGrasslandEcosystem,MinistryofEducation,PrataculturalEngineeringLaboratoryofGansuProvince,Sino-U.S.CenterforGrazinglandEcosystemSustainability,Lanzhou730070,China)
The identification and biological characteristics of the pathogen isolated from brown rot ofSolanumtuberosumwere studied. The pathogen was identified asDoratomycesstemonitis(Pers.exFr.) F.J. Morton & G. Smith based on morphological characteristics as well as rDNA-ITS sequences. The optimum temperature for mycelial growth was 25-30 ℃ at pH 6. The pathogen could use monosaccharide, disaccharide and polysaccharide; the best carbon source was sucrose, and the best nitrogen source was glycine. Illumination had no obvious promotion effect on mycelial growth. The optimum temperature for sporangium sprout was 25 ℃ at pH 7. Spores could germinate only in water drop. The filtrate of potato and glucose solution had obvious promotion effect on spore germination. Soil solution had no effects on spore germination.
Solanumtuberosum;Doratomycesstemonitis; pathogen identification; biological characteristics
2013-11-01
:2014-02-16
甘肃省农牧厅项目
S 435.32
:ADOI:10.3969/j.issn.0529-1542.2014.05.005
* 通信作者 E-mail: chenxiurong@gasu.edu.cn

