二斑叶螨抗阿维菌素品系选育及其解毒酶系活力变化
沈一凡, 沈慧敏, 岳秀利, 郭金梅, 宋丽雯
(甘肃农业大学草业学院,草业生态系统省部共建教育部重点实验室,中-美草地畜牧业可持续发展中心,兰州 730070)
二斑叶螨抗阿维菌素品系选育及其解毒酶系活力变化
沈一凡, 沈慧敏*, 岳秀利, 郭金梅, 宋丽雯
(甘肃农业大学草业学院,草业生态系统省部共建教育部重点实验室,中-美草地畜牧业可持续发展中心,兰州 730070)
采用室内生物测定和生化分析方法,以采自甘肃兰州国家级森林公园兴隆山的二斑叶螨为敏感品系(SS),研究二斑叶螨对阿维菌素的抗药性及抗性生化机理。结果表明:在室内用阿维菌素强化筛选24代,获得了二斑叶螨抗阿维菌素品系(Ab-R24),抗性指数(resistance index, RI)为321.5。对SS和Ab-R24解毒酶活性的分析表明,Ab-R24品系体内羧酸酯酶(CarE)、乙酰胆碱酯酶(AchE)、酸性磷酸酯酶(ACP)、碱性磷酸酯酶(ALP)、谷胱甘肽S-转移酶(GSTs)和多功能氧化酶(MFO)活性分别是SS品系的1.43、1.18、1.56、1.48、1.55倍和4.02倍,差异达到显著水平(P<0.05),其中MFO的活性上升最为显著。对SS和Ab-R24解毒酶动力学常数的分析表明,Ab-R24品系体内AchE、GSTs和MFO的Km分别是SS品系的1.14、2.31倍和2.58倍;Vmax分别是SS品系的1.19、2.34倍和1.76倍,差异均达到显著水平(P<0.05)。说明二斑叶螨对阿维菌素抗性增高与MFO活性快速升高有关,AchE和GSTs也参与阿维菌素抗性的形成。
二斑叶螨; 阿维菌素; 抗性选育; 解毒酶; 抗性机理
二斑叶螨(TetranychusurticaeKoch) 是农业生产上的重要害螨,其寄主植物可达200多种,常造成大田作物、果树和蔬菜等严重减产。二斑叶螨繁殖速度快,世代周期短,可在短期内对一些常用杀螨剂产生较高抗性[1],逐步上升为制约西北果树和蔬菜生产发展的主要因素。
阿维菌素(abamectin)是一种抗生素类杀虫杀螨剂,作用于昆虫神经元突触或神经肌肉突触的γ-氨基丁酸(GABA)系统,干扰GABA的正常释放,促使GABA门控的Cl-通道延长开放,大量的Cl-涌入造成神经膜电位超极化,致使神经膜处于抑制状态,从而导致昆虫死亡。由于其对害虫和害螨药效好,对非靶标生物安全,无残留污染等优点,已成为西北果、蔬和大田作物上防治叶螨的支柱品种。但如果长期单一大量使用,势必会导致二斑叶螨抗药性的产生,从而缩短阿维菌素的使用寿命。因此,本研究通过室内强化筛选二斑叶螨抗阿维菌素品系,对抗性品系的生理生化机制分析,明确二斑叶螨对阿维菌素的抗性机理以及靶标酶和主要解毒酶系活力变化,为进一步建立二斑叶螨对阿维菌素的抗性检测方法及为我国西北果、蔬生产合理制定叶螨综合防控方案提供理论依据。
1 材料与方法
1.1 供试二斑叶螨
二斑叶螨敏感品系(susceptible strain,SS):采自甘肃兰州国家级森林公园兴隆山,该公园为国家自然保护区。室内采用雌雄单系在叶螨饲养台(在直径为9 cm 的培养皿底部垫1 cm厚的浸水海绵,其表面覆黑色棉布,将无虫菜豆叶片背面向上平铺于布面,叶片周围用脱脂棉包围,再将二斑叶螨接在菜豆叶片上)饲养,养虫室内在盆栽菜豆苗上繁殖饲养约60代作为二斑叶螨敏感品系(SS),再不接触任何药剂。
二斑叶螨抗阿维菌素品系(abamectin-resistance strain,Ab-R):从二斑叶螨敏感品系(SS)中分出部分群体,扩繁后用阿维菌素药剂进行处理,选育24代后作为二斑叶螨抗阿维菌素品系(Ab-R)。饲养条件:温度(26±1)℃,相对湿度(70±5)%,光周期14 L∥10D[2]。
1.2 主要供试药剂和仪器
1.8%阿维菌素乳油(河北威远生物化工股份有限公司);考马斯亮蓝G-250(天津市光复精细化工研究所);牛血清蛋白(BSA,上海源聚生物科技有限公司);毒扁豆碱(eserine,Sigma);α-醋酸萘酯(α-NA,天津市光复精细化工研究所);坚固蓝B盐(fast blue salt,北京生物有限公司);α-萘酚(α-naphthol,天津市光复精细化工研究所);柠檬酸(citric acid monohydrate,天津市光复科技发展有限公司);柠檬酸钠(sodium citrate tribasic dihydrate,上海建信化工有限公司试剂厂);1-氯-2,4-二硝基苯(CDNB,生工生物工程(上海)有限公司);还原性谷胱甘肽(GSH,北京生物有限公司);对硝基苯酚(p-nitrophenol,山东淄博化学试剂厂);还原性辅酶Ⅱ (NADPH,北京拜耳迪生物公司);对硝基苯甲醚 (P-NA,河北恒业精细化工有限公司);碘化乙酰硫代胆碱(acetylthiocholine iodide,上海源叶生物科技有限公司);二硫双对硝基苯甲酸(DTNB,北京拜尔迪生物公司);对硝基苯基磷酸二钠(4-nitrophenyl phosphate disodium salt,山东淄博化学试剂厂);巴比妥钠(sodium barbital,淄博化学试剂厂)。
仪器:HERMLE Z323K高速冰冻离心机(日本);ELX 800UV酶标仪(Microplate reader,BioTek Instruments,Inc.)。
1.3 试验方法
1.3.1 二斑叶螨抗性种群选育方法
从SS种群中分出二斑叶螨部分群体,室内盆栽菜豆苗上扩繁,待种群密度足够大时用阿维菌素进行处理,以杀死种群65%~75%左右个体的浓度为选择压,用微型喷雾器喷雾处理二斑叶螨种群,叶背、叶面喷雾均匀,但不流失为度。每隔2~3代后进行一次室内毒力测定,计算阿维菌素对二斑叶螨的致死中浓度(LC50),掌握种群抗性发展趋势。并与敏感种群比较,求出抗性指数(resistance index, RI)。
抗性指数(RI)=抗性种群LC50/敏感种群LC50。
1.3.2 二斑叶螨室内毒力测定方法
测定方法参照FAO推荐的玻片浸渍法,并加以改进[3]。用零号毛笔挑取二斑叶螨雌成螨,将其背部粘在有双面胶的载玻片上,每片载玻片粘30头活雌成螨。将阿维菌素药剂稀释成不同浓度梯度,置带螨玻片的一端于药液中,轻轻摇动5 s后取出,迅速用滤纸吸干螨体及其周围多余的药液,每一浓度重复3次,用清水作对照。将其放置于温度(26±1)℃,相对湿度(70±5)%,光周期14 L∥10 D的光照生化培养箱中,24 h后检查死亡率。用吸耳球轻轻吹动螨体,以其足不动者为死亡。
1.3.3 二斑叶螨体内解毒酶和靶标酶活性分析方法
1.3.3.1CarE活性测定
参照何恒果[4]的方法。分别挑取二斑叶螨SS和Ab-R24品系雌成螨约200头,测定时采用3次生物重复和2次技术重复。以α-醋酸萘酯(α-NA)(3×10-4mol/L,含毒扁豆碱)作为底物,与酶液在30 ℃下反应10 min,然后加入25 μL显色剂,用酶标仪于600 nm处测定A值。所测A值减去对照A值,根据标准曲线计算酶液生成α-萘酚量,再经蛋白质测定得出蛋白质含量(μg/mL),即得酶比活力[nmol/(L·mg·min)]。
1.3.3.2AchE活性测定
参照Ellman[5]的乙酰硫代胆碱-二硫双对硝基苯甲酸法(ASCh-DTNB法)并加以改进。分别挑取二斑叶螨SS和Ab-R24品系雌成螨约200头,测定时采用3次生物重复和2次技术重复。以碘化硫代乙酰胆碱(ATChI)作为底物,经AchE水解后生成硫代胆碱和乙酸,与显色剂二硫双对硝基苯甲酸(DTNB)生成黄色物质,以毒扁豆碱终止反应,用酶标仪于412 nm处测其A值。连续扫描20 min,每1 min读1次数。AchE活性计算,具体如下:
AchE活力单位(μmol/min)=(ΔA412·υ)/(ε·L);
AchE比活力[μmol/(min·μg)]=AchE活力单位/酶液蛋白含量;
AchE活力(μmol/min·mite)=AchE活力单位/酶液所用螨数量。
式中,ΔA412为吸光度每分钟的变化值(ΔA412/min)、υ为酶促反应体系、ε为产物的消光系数[0.013 6 L/(μmol·cm)],L为光程(0.6 cm)。
1.3.3.3ACP和ALP活性测定
参照慕立义[6]的测定方法,并加以改进。分别挑取二斑叶螨SS和Ab-R24品系雌成螨约200头,测定时采用3次生物重复和2次技术重复。用0.2 mol/LpH 4.6醋酸缓冲液(0.04 mol/L pH 9.6巴比妥钠-盐酸缓冲液)作为冷冻匀浆液,以对硝基苯基磷酸二钠作为底物,在磷酸酯酶的作用下,水解生成对硝基苯酚,用酶标仪于400 nm处测定A值。计算磷酸酯酶生成的对硝基苯酚量,进一步计算磷酸酯酶的比活力[nmol/(L·mg·min)]。
1.3.3.4GSTs活性测定
参照Clark等[7]的方法。分别挑取二斑叶螨SS和Ab-R24品系雌成螨约200头,测定时采用3次生物重复和2次技术重复。以1-氯-2,4-二硝基苯(CDNB)和还原性谷胱甘肽(GSH)为底物,在GSTs催化下,用酶标仪于340 nm处测定其A值,并计算GSTs比活力[μmol/(L·μg·min)]。参照Habig[8]等方法,依据以下公式计算酶活力:
GSTs活力单位(μmol/min)=(ΔA340·υ)/(ε·L)
式中,ΔA340为光吸收每分钟的变化值(ΔA340/min)、υ为酶促反应体系、ε为产物的消光系数[0.009 6 L/(μmol·cm)],L为光程(1 cm)。
GSTs比活力[μmol/(L·μg·min)]=酶活力单位/酶液蛋白含量。
1.3.3.5MFO活性测定
参照Kim等[9]方法。分别挑取二斑叶螨SS和Ab-R24品系雌成螨约200头,测定时采用3次生物重复和2次技术重复。以对硝基苯甲醚作底物,在氧和NADPH作电子供体条件下,MFO催化发生氧脱甲基作用生成对硝基苯酚,37 ℃下反应30 min,用盐酸终止反应后,先后用氯仿、NaOH溶液萃取,用酶标仪于400 nm处测定A值,根据对硝基苯酚标准曲线方程求得酶促反应生成的对硝基苯酚量,求出MFO氧脱甲基的活性[nmol/(L·mg·min)]。
1.3.3.6酶源蛋白含量的测定
参照Bradford[10]的方法,采用考马斯亮蓝G-250染色法进行测定。
1.3.3.7动力学常数测定
参照Wilkinson[11]的方法。将底物稀释成不同浓度梯度,采用Lineweaver-Burk双倒数作图法计算Km和Vmax值。
1.4 数据统计与分析

2 结果与分析
2.1 二斑叶螨对阿维菌素的抗性选育
二斑叶螨对阿维菌素的抗性选育结果见表1,用阿维菌素对二斑叶螨强化筛选24代后,其LC50由0.1 mg/L上升至32.15 mg/L,抗性指数为321.5。
表1二斑叶螨对室内阿维菌素的抗性选育
Table1ThelaboratoryselectionofresistanceofTetranychusurticaetoabamectin

筛选代数Generationforselection回归方程(y=)Regressionequationχ2ChisquareLC50(95%CL)/mg·L-1抗性指数(RI)ResistanceindexF06.0646+1.0488x0.1720.10(0.01~0.18)-F16.0677+1.0659x0.2160.10(0.01~0.18) 1F37.4392+4.0549x0.1100.25(0.21~0.28)2.5F65.2746+0.8092x0.4460.46(0.04~0.83)4.6F94.8883+0.9325x0.3541.32(0.81~2.48)13.2F123.3570+3.4923x0.2182.95(2.58~3.43)29.5F153.5492+1.5764x1.1168.32(6.30~13.20)83.2F183.3267+1.3477x0.38617.44(10.86~72.29) 174.4 F213.7716+0.8784x0.31125.03(14.14~155.72) 250.3 F243.3672+1.0833x0.37232.15(18.36~143.70) 321.5
2.2 二斑叶螨SS和Ab-R24品系解毒酶比活力测定
二斑叶螨SS和Ab-R24品系解毒酶比活力测定结果见表2。结果表明,Ab-R24品系CarE、ACP、ALP、AchE、GSTs和MFO比活力与SS品系相比均有显著性提高(P<0.05),分别是SS品系的1.43、1.56、1.48、1.18、1.55和4.02倍;Ab-R24品系酶源蛋白含量与SS品系相比只有GSTs和MFO存在显著性差异(P<0.05),CarE、ACP、ALP和AchE酶源蛋白含量差异性均未达到显著水平。
表2二斑叶螨SS和Ab-R24品系解毒酶比活力1)
Table2DetoxificationenzymeactivityinSSandAb-R24strainsofTetranychusurticae

酶Enzyme品系Strain蛋白含量/μg·mL-1Protein比活力±SDSpecificactivity±SD相对比值Relativeratio(R/S)CarESS(61.232±1.844)a(14.544±0.642)b-/nmol·(L·mg·min)-1Ab⁃R24(65.549±0.833)a(20.740±0.085)a1.43ACPSS(69.676±1.620)a(0.471±0.012)b-/nmol·(L·mg·min)-1Ab⁃R24(67.771±2.486)a(0.733±0.009)a1.56ALPSS(67.581±2.272)a(0.466±0.016)b-/nmol·(L·mg·min)-1Ab⁃R24(65.739±3.248)a(0.691±0.031)a1.48AchESS(71.327±1.1638)a(0.119±0.0001)b-/μmol·(L·μg·min)-1Ab⁃R24(72.215±1.1125)a(0.141±0.0007)a1.18GSTsSS(78.311±1.837)a(0.968±0.021)b-/μmol·(L·μg·min)-1Ab⁃R24(60.597±3.172)b(1.501±0.061)a1.55MFOSS(82.374±0.879)a(0.081±0.001)b-/nmol·(L·mg·min)-1Ab⁃R24(59.327±0.769)b(0.326±0.004)a4.02
1) 同一种酶数据后a和b表示抗性品系与敏感品系差异显著(Duncan氏新复极差检验)(P<0.05)。
Data marked with a and b for the same enzyme are significantly different between susceptible and resistant strains by Duncan’s test (P<0.05).
2.3 二斑叶螨SS和Ab-R24品系解毒酶动力学常数
二斑叶螨SS和Ab-R24品系解毒酶动力学常数比较结果见表3。结果表明,Ab-R24品系CarE、AchE、GSTs和MFO的Vmax与SS品系相比均达到显著性差异(P<0.05),分别是SS品系的1.57、1.19、2.34、1.76倍;Ab-R24品系AchE和MFO的Km与SS品系相比均达到显著性差异(P<0.05),分别是SS品系的1.14倍和2.58倍,说明其对底物ATChI和对硝基苯甲醚的亲和能力显著降低,AchE和MFO不仅发生了量变,还发生了质变。
表3二斑叶螨SS和Ab-R24品系解毒酶动力学常数1)
Table3KineticconstantsofdetoxifyingenzymesinSSandAb-R24strainsofTetranychusurticae
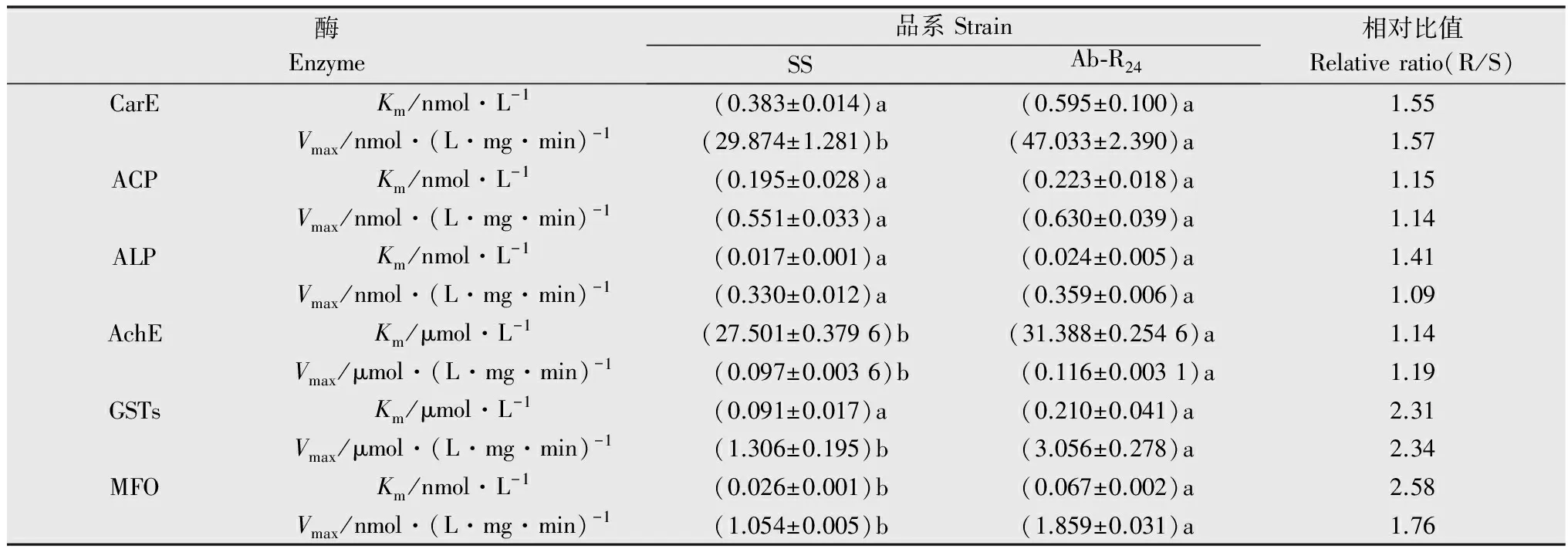
酶Enzyme品系StrainSSAb⁃R24相对比值Relativeratio(R/S)CarEKm/nmol·L-1(0.383±0.014)a(0.595±0.100)a1.55Vmax/nmol·(L·mg·min)-1(29.874±1.281)b(47.033±2.390)a1.57ACPKm/nmol·L-1(0.195±0.028)a(0.223±0.018)a1.15Vmax/nmol·(L·mg·min)-1(0.551±0.033)a(0.630±0.039)a1.14ALPKm/nmol·L-1(0.017±0.001)a(0.024±0.005)a1.41Vmax/nmol·(L·mg·min)-1(0.330±0.012)a(0.359±0.006)a1.09AchEKm/μmol·L-1(27.501±0.3796)b(31.388±0.2546)a1.14Vmax/μmol·(L·mg·min)-1(0.097±0.0036)b(0.116±0.0031)a1.19GSTsKm/μmol·L-1(0.091±0.017)a(0.210±0.041)a2.31Vmax/μmol·(L·mg·min)-1(1.306±0.195)b(3.056±0.278)a2.34MFOKm/nmol·L-1(0.026±0.001)b(0.067±0.002)a2.58Vmax/nmol·(L·mg·min)-1(1.054±0.005)b(1.859±0.031)a1.76
1) 同一种酶数据后a和b表示抗性品系与敏感品系差异显著(Duncan氏新复极差检验)(P<0.05)。
Data marked with a and b for the same enzyme are significantly different between susceptible and resistant strains by Duncan’s test (P<0.05).
3 结论与讨论
通过阿维菌素对二斑叶螨室内强化筛选,前期选育阶段抗性进展极为缓慢,时有断代现象发生,但后期选育阶段抗性迅速上升,从F12到F24代,二斑叶螨Ab-R品系的LC50由2.95 mg/L突升至32.15 mg/L,其RI值由F12代的29.5突升至F24代的321.5,与甘肃常用杀螨剂抗性发展的趋势一致[13]。如果在高强度药剂下继续筛选,抗性将会继续上升,所以应该在阿维菌素使用的同时注意与常用药剂的轮换或者选用混配药剂,延缓二斑叶螨对阿维菌素抗性的升高。
目前,对阿维菌素抗性机理的研究比较明确[14],主要是刺激虫体产生γ-氨基丁酸,阻断运动神经信息的传递,使昆虫出现麻痹症状,不活动不取食以致最后死亡。在国外,Wheelock 和Scott[15]认为家蝇体内多功能氧化酶活性的提高以及其表皮穿透性降低是对阿维菌素产生抗性的主要原因;Argentine 等[16]证明马铃薯甲虫体内酯酶和多功能氧化酶活性的提高是对阿维菌素产生抗性的主要原因,与体内谷胱甘肽S-转移酶的氧化代谢和马铃薯甲虫表皮穿透力的降低关系不大。在国内,何林等[17]在对朱砂叶螨的研究过程中发现其对阿维菌素的抗性主要由羧酸酯酶活性的改变所致;孟和生[18]研究发现橘全爪螨体内乙酰胆碱酯酶活性的提高是其对阿维菌素产生抗性的主要原因之一。
本研究通过对二斑叶螨Ab-R24品系中酯酶和解毒酶系活力的测定,结果发现,抗性品系体内CarE、AchE、ACP、ALP、GSTs和MFO的活性均显著高于敏感品系,其中MFO的活性上升最为显著。产生这一现象的原因可能由于二斑叶螨Ab-R24品系体内解毒酶活性增加所产生的代谢抗性是导致二斑叶螨对阿维菌素产生抗药性最主要的机理,其中MFO活性上升可能与阿维菌素分子结构中带有氧甲基基团(-OCH3)有密切的关系。鉴于代谢抗性在二斑叶螨抗性发展中的重要性,本研究对二斑叶螨SS和Ab-R24品系活体中酯酶和解毒酶系进行测定比较,以明确二斑叶螨对阿维菌素的抗性机理,为防止二斑叶螨对阿维菌素过快产生抗药性而轮换交替合理用药提供理论依据。
[1]Stumpf N, Nauen R. Biochemical markers linked to abamectin resistance inTetranychusurticae(Acari:Tetranychidae)[J].Pesticide Biochemistry and Physiology,2002,72(2): 111-121.
[2]沈慧敏,张新虎.二点叶螨对甲氰菊酯、氧乐果和四螨嗪抗药性的选育、衰退和恢复[J].昆虫学报,2002,45(3): 341-345.
[3]何林,赵志模,邓新平,等.朱砂叶螨对三种杀螨剂的抗性选育与抗性风险评估[J].昆虫学报,2002,45(5): 688-692.
[4]何恒果.桔全爪螨对甲氰菊酯和阿维菌素的抗性及其酯酶基因的克隆与表达研究[D].重庆:西南大学,2010.
[5]Ellman G L, Courtney K D, Featherstone R M. A new and rapid colorimetric determination of acetylcholinesterase activity[J].Biochemical Pharmacology,1961,7(2): 88-95.
[6]慕立义.植物化学保护研究方法(植保专业用)[M].北京:中国农业出版社, 1994:158-160.
[7]Clark A G, Dick G L, Smith J N. Kinetic studies on a glutathione S-transferase from the larvae ofCostelytrazealandica[J].The Biochemical Journal,1984,217(1): 51-58.
[8]Habig W H, Pabst M J, Jakoby W B.Glutathione S-transferases. The first enzymatic step in mercapturic acid formation[J].The Journal of Biological Chemistry,1974,249(22): 7130-7139.
[9]Kim Young-Joon J, Lee Si-Hyeock, Lee Si-Woo, et al. Fenpyroximate resistance inTetranychusurticae(Acari: Tetranychidae):cross-resistance and biochemical resistance mechanisms[J].Pest Management Science,2004,60(10): 1001-1006.
[10]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1): 248-254.
[11]Wilkinson G N. Statistical estimations in enzyme kinetics[J]. The Biochemical Journal,1961,80(2): 324-332.
[12]李二虎,吴文君,陈之浩,等.小菜蛾对苦皮藤素抗性选育及交互抗性测定[J].昆虫学报,2003,46(1): 18-21.
[13]高新菊,张志刚,段辛乐,等.二斑叶螨抗四螨嗪品系筛选及其解毒酶活力变化[J]. 中国农业科学,2012,45(7): 1432-1438.
[14]Bloomquist J R. Toxicology, mode of action and target site-mediated resistance to insecticides acting on chloride channels[J].Comparative Biochemistry and Physiology Part C: Pharmacology,Toxicology and Endocrinology,1993,106(2):301-314.
[15]Wheelock G D, Scott J G. Immunological detection of cytochrome P450 from insecticide resistant and susceptible house flies (Muscadomestica)[J].Pesticide Biochemistry and Physiology,1990,38(2): 130-139.
[16]Argentine J A, Clark J M, Lin H. Genetics and biochemical mechanisms of abamectin resistance in two isogenic strains of Colorado potato beetle[J].Pesticide Biochemistry and Physiology,1992,44(3): 191-207.
[17]He Lin, Xue Chuanhua, Wang Jinjun, et al. Resistance selection and biochemical mechanism of resistance to two acaricides inTetranychuscinnabarinus(Boiduval)[J].Pesticide Biochemistry and Physiology,2009,93(1): 47-52.
[18]孟和生.桔全爪螨抗药性检测及抗性机理[D].泰安:山东农业大学,2002.
ResistanceselectionofTetranychusurticaetoabamectinstrainandchangesintheactivityofdetoxificationenzymes
Shen Yifan, Shen Huimin, Yue Xiuli, Guo Jinmei, Song Liwen
(PrataculturalCollegeofGansuAgriculturalUniversity,KeyLaboratoryofGrasslandEcosystem,MinistryofEducation;Sino-U.S.CenterforGrazinglandEcosystemSustainability,Lanzhou730070,China)
In order to study the insecticide resistance and resistance biochemistry mechanism ofTetranychusurticaeto abamectin, we used bioassay and biochemical analysis methods. In addition,T.urticaefrom Xinglong Mountain in Gansu Lanzhou National Forest Park was used as a susceptible strain (SS). The results indicated thatT.urticaeabamectin-resistance 24 (Ab-R24) was obtained after indoor screening for 24 generations with abamectin, whose resistance index (RI) was 321.5. The analysis of SS and Ab-R24detoxification enzyme activity showed that the activities of carboxylesterases (CarE), acetylcholinesterase (AchE), acid phosphatase (ACP), alkaline phosphatase (ALP), glutathione S-transferase (GSTs) and mixed function oxidase (MFO) of Ab-R24strain wereinvivo1.43, 1.18, 1.56, 1.48, 1.55 and 4.02 times of the corresponding activity of SS, respectively, which reached the significance level (P<0.05). The analysis of SS and Ab-R24detoxifying enzyme kinetic constants showed that theKmvalues of AchE/GSTs and MFO of Ab-R24strain wereinvivo1.14, 2.31 and 2.58 times of the corresponding value of SS, respectively; at the same time, theVmaxvalues were 1.19, 2.34 and 1.76 times of the corresponding value of SS, respectively, which reached the significance level (P<0.05). In conclusion, the activity of MFO rose most obviously, indicating that the rise ofT.urticae’s abamectin resistance was closely related with the rapid rise of MFO’s activity. There is no doubt that AchE and GSTs are both involved in the formation of abamectin resistance.
Tetranychusurticae; abamectin; resistance selection; detoxification enzyme; biochemical mechanism of resistance
2013-10-09
:2013-11-12
公益性行业(农业)科研专项(201103020);国家自然科学基金(31260442)
S 481.4
:ADOI:10.3969/j.issn.0529-1542.2014.05.008
* 通信作者 Tel:0931-7632260; E-mail:ndshm@gsau.edu.cn

