低氧致炎与低氧性肺动脉高压
夏世金 吴俊珍 胡明冬
低氧致炎与低氧性肺动脉高压
Hypoxia-induced inflammation and hypoxic pulmonary hypertension
夏世金1吴俊珍1胡明冬2
低氧; 肺动脉高压; 炎症
低氧性肺动脉高压(hypoxic pulmonary hypertension, HPH)对人的长期严重危害依然未得到很好解决,是一治疗极为棘手、高致死率和高致残率的病理生理综合征,被认为是“假恶性”肿瘤[1]。低氧性肺血管结构重建(hypoxic pulmonary vascular structural remodeling, HPVSR)和低氧性肺血管收缩(hypoxic pulmonary vasoconstriction, HPV)是HPH形成的两大基本病理生理特征[2]。肺血管内皮细胞(pulmonary vascular endothelial cell, PVEC)、肺血管平滑肌细胞(pulmonary vascular smooth muscle cell, PVSMC)和肺成纤维细胞是构成肺血管壁的主要细胞,这些细胞结构和功能的异常变化是导致HPVSR和HPV的主要原因。目前,对HPH的机制:①HPH机制复杂,尚未完全阐明;②有关HPH机制理论可归纳为低氧性肺血管结构重建学说、低氧性肺血管收缩学说、低氧性肺血栓学说、低氧性细胞增殖学说、低氧性细胞凋亡学说和低氧性炎症学说等。在HPH治疗方面: HPH治疗策略有降低肺动脉压力、抑制血管异常增生、减轻肺血管肥厚及其结构重建和抗炎等。近年来,以前未被足够重视的低氧性炎症机制和抗炎治疗策略在HPH研究中越来越受到高度关注,并可望成为研究的重点和热点。
一、低氧性炎症是HPH发生的主要原因之一
研究表明,低氧能诱发炎症,可称之为低氧性炎症。低氧是HPH的独立危险因素[2]。临床研究显示,肺动脉高压(pulmonary artery hypertension, PAH)患者肺血管丛状病变周围存在T细胞、B细胞、巨噬细胞及树突状细胞等炎症细胞浸润[3]。PAH患者血清白细胞介素-1(interleukin-1, IL-1)、IL-6 、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、C反应蛋白(C-reactive protein, CRP)和单核细胞趋化因子1(monocyte chemotactic factor-1, MCP-1)等水平明显升高[4],且肺动脉丛状病变处趋化因子CX3CLl和CCL5表达显著升高,诱导缩血管物质血管内皮生长因子(vascular endothelial growth factor, VEGF)、内皮素-l(endothelin, ET-1)、血小板衍化生长因子(platelet -derived growth factor, PDGF)等高表达[5]。炎性细胞及其分泌的炎性细胞因子、趋化因子、黏附分子等可导致PVEC损伤和PVSMC的增殖,从而参与HPV 和HPVSR进程[3]。这些研究结果提示炎症是PAH形成的重要因素[3]。
动物实验表明,在HPH大鼠PVSMC中,促炎细胞因子巨噬细胞移动抑制因子 (migration inhibitory factor, MIF)表达升高,进而增强肺动脉血管收缩,参与HPH发生[6]。PVSMC中的Rho/Rho-kinase (ROCK) 信号通路在PAH的发病机制中发挥着重要作用。Rho-kinase 有2个亚型,ROCK1 和 ROCK2,在不同细胞中发挥不同的作用,ROCK1主要在循环炎症细胞,ROCK2主要在脉管系统中起作用[7]。在低氧培养的PVEC和HPH动物模型中可诱导出brahma-related gene 1 (Brg1) 和 brahma (Brm) 。Brg1/Brm过表达增强,同时其消耗减少,导致细胞黏附分子(cell adhesion molecule, CAM)的过量转录[8]。低氧时PVEC中15-脂氧合酶(15-lipoxygenase)出现高表达,后者可提高NK-κB的活性[9]。慢性HPH中,NALP3 炎症小体激活,导致促炎症细胞因子分泌,尤其是IL-1β,引起中性粒细胞炎症,激活的炎症细胞进一步招募更多的炎症细胞并释放大量的炎症因子引起炎症的瀑布反应,损伤血管内皮细胞[10]。
研究发现,低氧诱导因子-1(hypoxia-inducible factor 1, HIF-1)是介导低氧性炎症的信号通路。低氧使巨噬细胞和中性粒细胞中HIF-1 激活。HIF-1可上调VEGF及其受体表达,使局部血管通透性增强,导致更多的免疫细胞到达炎症部位,引起PVEC的炎症性损伤[11]。低氧时HIF-1α过度表达可增强NF-κB p65核定位与转录活性,导致上皮细胞释放大量的趋化因子和细胞因子(TNF-α等)[12]。而TNF-α可诱导成纤维细胞大量表达NF-κB[13],低氧时小鼠PVSMC中NF-κB表达增强,促进HIF-1α转录[14]。低氧所诱导细胞产生和释放的炎症细胞因子可强化NF-κB通路,增加HIF表达,反过来又加剧细胞低氧[15]。上述研究提示HIF-1与NF-κB会话信号通路(cross talk)可能在调控HPH炎症发生中处于重要地位[16],是维系低氧与炎症恶性循环的纽带,可望成为有效干预HPH的理想靶标,值得深入研究。此外,环磷酸腺苷应答元件结合蛋白(CAMP response element binding protein, CREB)是一种重要的核转录因子,参与炎症细胞因子(如IL-6等)等基因的转录,与NF-κB存在“cross talk”关系[17],与低氧损伤及HPH密切相关[18],近年来受到极大的关注,可能在HPH炎症中发挥重要作用。
二、炎症性低氧是HPH发展的一个重要因素
在HPH中,炎症反应可导致肺组织的氧供需失衡,肺组织细胞代谢需氧量剧增,肺微循环血栓等阻断氧的供给。炎症是肺组织对损害因子的一种防御反应,但侵入肺部的炎性细胞耗氧量增加,炎症部位形成低氧环境,加重低氧程度[12]。低氧可诱发炎症,炎症又可加重低氧,于是2012年著名杂志刊文提出“inflammatory hypoxia,炎症性低氧”新概念[19]。
动物实验表明,早期发现炎症细胞因子受体拮抗剂对PAH大鼠模型有一定的效果[20-21],近期发现间质干细胞移植能逆转HPH[12]。但HPH的抗炎研究主要集中于动物模型,而抗炎药物对HPH早期有效,可是存在有免疫抑制问题[22],临床应用已受到严格的限制。因此,寻求安全有效的HPH抗炎策略已成为当务之急。
上述研究提示,低氧性炎症与炎症性低氧二者共处一体即HPH共同体,且低氧与炎症存在着恶性循环关系,但其机制尚未阐明。就某种意义而言,炎症既是低氧的“果”,又是加重低氧的“因”,炎症在HPH发生中起着关键作用。低氧与炎症的恶性循环可能是HPH防治困难的主因之一,而要打破这种恶性循环的关键环节的策略就是抗炎,见图1。
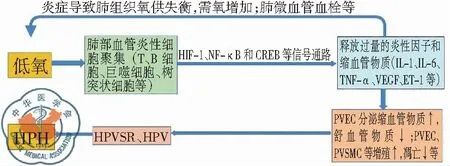
图1 低氧导致HPH发生过程的简要模拟图
目前,由于炎症在HPH发生发展的作用与机制尚未阐明,严重制约了抗炎在HPH临床中的应用。因此,积极筛选并明确机体的内源性基因,作为干预HPH的目标基因,调控目标基因的内源性表达,从而达到安全有效防治HPH之目的是防治HPH的新方向与新策略。
三、表观遗传学是阐明HPH炎症机制的有效策略
在HPH中炎症细胞因子基因表达出现上调或下调,那么这些基因的表达变化是一过性的?还是在一定时间内维持稳定?又能持续多久?需要从表观遗传学入手解答这些问题。
表观遗传学调控是一类不涉及遗传物质改变的基因调节方式,发现其几乎存在于生物调控的所有环节[23]。表观遗传学调控的一个最常见、最清楚和最重要的机制是DNA甲基化。DNA甲基化可调控基因表达的开启、关闭与水平。甲基化常导致基因表达沉默或降低,去甲基化则使基因表达重新激活。DNA甲基化主要由DNA甲基化转移酶(DNA methyltrasferases, DNMTs)所控制。已鉴定的人类具有催化活性的DNMTs有三种:DNMT1、DNMT3A和DNMT3B[24]。表观遗传修饰一旦形成,即使撤除干预因素,也可长时间保持稳定,维持对基因表达水平的调控,从而参与细胞和机体形成与环境相适应的稳态。
炎症细胞因子DNA甲基化与炎症相关疾病密切关联[25]。DNA甲基化在炎症领域的研究进展较快[26]。TNF-α的DNA甲基化修饰与非肿瘤胃黏膜病变[27],IL-6的DNA甲基化修饰与口腔癌[28],IL-10甲基化修饰与乳腺癌密切相关[29]。可以推测,低氧作为一种干预因素,可能会影响炎症因子基因表达的表观遗传修饰调控。
总之,低氧诱发炎症,炎症又加重低氧,共同参与HPH的发生和发展。低氧性炎症、炎症性低氧与HPH形成恶性循环,而抗炎是打破这种恶性循环的有效策略。抗炎策略的确立依赖于HPH炎症机制的阐明,而表观遗传学(如DNA甲基化等)为阐明HPH炎症机制提供了理论依据和有效方法。
1 McLaughlin VV, Archer SL, Badesch DB, et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association[J]. J Am Coll Cardiol, 2009, 53(17): 1573-1619.
2 Lahm T, Albrecht M, Fisher AJ, et al. 17β-Estradiol attenuates hypoxic pulmonary hypertension via estrogen receptor-mediated effects [J]. Am J Respir Crit Care Med, 2012, 185(9): 965-980.
3 Price LC, Wort SJ, Perros F, et al. Inflammation in pulmonary arterial hypertension[J]. Chest, 2012, 141(1): 210-221.
4 Humbert M, Monti G, Brenot F, et al. Increased interleukin-1 and interleukin-6 serum concentrations in severe primary pulmonary hypertension[J]. Am J Respir Crit Care Med, 1995, 151(5): 1628-1631.
5 Balabanian K, Foussat A, Dorfmüller P, et al. CX(3)C chemokine fractalkine in pulmonary arterial hypertension[J]. Am J Respir Crit Care Med, 2002, 165(10): 1419-1425.
6 Zhang B, Luo Y, Liu ML, et al. Macrophage migration inhibitory factor contributes to hypoxic pulmonary vasoconstriction in rats [J]. Microvasc Res, 2012, 83(2): 205-212.
7 Shimizu T, Fukumoto Y, Tanaka S, et al. Crucial role of ROCK2 in vascular smooth muscle cells for hypoxia-induced pulmonary hypertension in mice[J]. Arterioscler Thromb Vasc Biol, 2013, 33(12): 2780-2791.
8 Chen D, Fang F, Yang Y, et al. Brahma-related gene 1 (Brg1) epigenetically regulates CAM activation during hypoxic pulmonary hypertension[J]. Cardiovasc Res, 2013, 100(3): 363-373.
9 Li J, Rao J, Liu Y, et al. 15-Lipoxygenase promotes chronic hypoxia- induced pulmonary artery inflammation via positive interaction with nuclear factor-κB[J]. Arterioscler Thromb Vasc Biol, 2013, 33(5): 971-979.
10 Villegas LR, Kluck D, Field C, et al. Superoxide dismutase mimetic, MnTE-2-PyP, attenuates chronic hypoxia-induced pulmonary hypertension, pulmonary vascular remodeling, and activation of the NALP3 inflammasome[J]. Antioxid Redox Signal, 2013, 18(14): 1753-1764.
11 Wang PP, Kong FP, Chen XQ, et al. HIF-1 signal pathway in cellular response to hypoxia[J]. J Zhejiang Univ (Medical Sci), 2011, 40(5): 559-566.
12 Lee C, Mitsialis SA, Aslam M, et al. Exosomes mediate the cytoprotective action of mesenchymal stromal cells on hypoxia-induced pulmonary hypertension[J]. Circulation, 2012, 126(22): 2601-2611.
13 Werner SL, Barken D, Hoffmann A. Stimulus specificity of gene expression programs determined by temporal control of IKK activity[J]. Science, 2005, 309(5742): 1857-1861.
14 Belaiba RS, Bonello S, Zähringer C, et al. Hypoxia up-regulates hypoxia-inducible factor-1alpha transcription by involving phosphatidylinositol 3-kinase and nuclear factor kappaB in pulmonary artery smooth muscle cells[J]. Mol Biol Cell, 2007, 18(12): 4691-4697.
15 Rius J, Guma M, Schachtrup C, et al. NF-kappaB links innate immunity to the hypoxic response through transcriptional regulation of HIF-1alpha[J]. Nature, 2008, 453(7196): 807-811.
16 Nizet V, Johnson RS. Interdependence of hypoxic and innate immune responses[J]. Nat Rev Immunol, 2009, 9(9): 609-617.
17 Wei Z, Wang F, Song J, et al. Norisoboldine inhibits the production of interleukin-6 in fibroblast-like synoviocytes from adjuvant arthritis rats through PKC/MAPK/NF-κB-p65/CREB pathways[J]. J Cell Biochem, 2012, 113(8): 2785-2795.
18 Garat CV, Crossno JT Jr, Sullivan TM, et al. Inhibition of phosphatidylinositol 3-kinase/Akt signaling attenuates hypoxia-induced pulmonary artery remodeling and suppresses CREB depletion in arterial smooth muscle cells[J]. J Cardiovasc Pharmacol, 2013, 62(6): 539-548.
19 Clambey ET, McNamee EN, Westrich JA, et al. Hypoxia-inducible factor-1 alpha-dependent induction of FoxP3 drives regulatory T-cell abundance and function during inflammatory hypoxia of the mucosa [J]. Proc Natl Acad Sci U S A, 2012, 109(41): E2784-2793.
20 Voelkel NF, Tuder RM, Bridges J, et al. Interleukin-1 receptor antagonist treatment reduces pulmonary hypertension generated in rats by monocrotaline[J]. Am J Respir Cell Mol Biol, 1994, 11(6): 664-675.
21 Kimura H, Kasahara Y, Kurosu K, et al. Alleviation of monocrotaline- induced pulmonary hypertension by antibodies to monocyte chemotactic and activating factor/monocyte chemoattractant protein-1[J]. Lab Invest, 1998, 78(5): 571-581.
22 Vergadi E, Chang MS, Lee C, et al. Early macrophage recruitment and alternative activation are critical for the later development of hypoxia-induced pulmonary hypertension[J]. Circulation, 2011, 123(18): 1986-1995.
23 Zhao S, Xu W, Jiang W, et al. Regulation of cellular metabolism by protein lysine acetylation[J]. Science, 2010, 327(5968): 1000-1004.
24 LaPlant Q, Vialou V, Covington HE 3rd, et al. Dnmt3a regulates emotional behavior and spine plasticity in the nucleus accumbens[J]. Nat Neurosci, 2010, 13(9): 1137-1143.
25 Shanmugam MK, Sethi G. Role of epigenetics in inflammation-associated diseases[J]. Subcell Biochem, 2012, 61: 627-657.
26 Hartnett L, Egan LJ. Inflammation, DNA methylation and colitis-associated cancer[J]. Carcinogenesis. 2012, 33(4): 723-731.
27 Tahara T, Shibata T, Nakamura M, et al. Effect of polymorphisms of IL-1β and TNF-α genes on CpG island hyper methylation (CIHM) in the nonneoplastic gastric mucosa[J]. Mol Carcinog, 2011, 50(11): 835-845.
28 Gasche JA, Hoffmann J, Boland CR, et al. Interleukin-6 promotes tumorigenesis by altering DNA methylation in oral cancer cells[J]. Int J Cancer, 2011, 129(5): 1053-1063.
29 Son KS, Kang HS, Kim SJ, et al. Hypomethylation of the interleukin-10 gene in breast cancer tissues[J]. Breast, 2010, 19(6): 484-488.
(本文编辑:王亚南)
夏世金,吴俊珍,胡明冬. 低氧致炎与低氧性肺动脉高压[J/CD]. 中华肺部疾病杂志: 电子版, 2014, 7(5): 563-565.
10.3877/cma.j.issn.1674-6902.2014.05.022
国家自然科学基金(81270115)
1200040 上海,复旦大学附属华东医院上海市 老年医学研究所、老年医学科
2400037 重庆,第三军医大学新桥医院全军 呼吸内科研究所
胡明冬, Email: huhanshandd@aliyun.com
R563
A
2014-08-23)

