壬基酚对子代大鼠皮质部神经生长相关蛋白的影晌
许 洁,汪 洋,张 镖,杨雪峰,罗 娅,封孝亚,张元梅,黄仁厚,俞 捷
(1.重庆医科大学 公共卫生学院,重庆 400016;2.遵义医学院 公共卫生学院,贵州 遵义 563099;3.遵义医学院附属医院 胃肠外科,贵州 遵义 563099)
壬基酚(Nonylphenol, NP)是环境内分泌干扰物的典型代表,NP使用普遍,环境污染面极为广泛,我国污染严重[1-2]。研究表明,NP对人和动物生长发育和繁衍有一定的影响[3-4],因此,NP这类物质已成为当今国际毒理学界的重要研究领域或前沿。本课题组前期研究发现NP可使子代大鼠的生理发育指标和神经发射时间延长,成年仔鼠学习记忆能力降低[5], NP所致神经毒性的机制目前尚不清楚。
神经生长相关蛋白 (growth associatedprotein-34,GAP-43)是神经元发育、生长、再生形成的标志蛋白质[6],本研究通过建立孕哺期暴露NP的仔鼠模型,观察仔鼠断乳期(21 d)、儿童期(60 d)脑组织皮质部神经元细胞GAP-43的表达,并判断NP暴露剂量与GAP-43蛋白表达的相关性,初步探讨NP引起认知功能障碍的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物分组及处理 清洁级SD大鼠60只(动物合格证号:SCXK(渝)20070005),按雌:雄2:1同笼交配,次日晨经阴道涂片检查发现精子者,当日记为妊娠0 d(GD0),将交配成功的28只孕鼠根据妊娠日期分层后随机分配到4组,即对照组、低、中、高剂量组:分别为NP 0、50、100、200 mg/kg/day,每组6~7只,单笼饲养,于受孕第6天到出生后21 d哺乳期(GD6~PND21)空腹灌胃NP,对照组灌胃溶剂花生油,体积均为10 mL/kg/d。F1仔鼠21 d后按8g/100g干饲料喂食,饲养于相对湿度(60±5)%,温度(20±2)℃,自然通风,12 h光照12 h黑暗,自由取食、饮水。
1.1.2 试剂 NP纯度99%(东京化成株试会社),精制花生油(山东鲁花牌);一抗GAP-43为兔抗鼠亲和纯化抗体(京中山生物试剂制品有限公司);兔抗鼠GAP-43多克隆抗体(北京中山生物试剂制品有限公司);二抗羊抗兔(北京中杉金桥生物科技有限公司);DAB显色试剂盒(DAKO公司)。
1.1.3 免疫组化实验器材 电热恒温水浴箱(北京市永光明医疗仪器厂);101-2型电热干燥箱(上海路达实验仪器有限公司);双重纯水蒸馏器(上海亚荣生化仪器厂);Fx-200电子天平(北京赛多利斯电子有限公司);普通光学显微镜(日本奥林巴斯公司)。
1.2 方法
1.2.1 免疫组化步骤 ①组织固定后,常规洗涤、透明、石蜡包埋、切片。②梯度脱蜡至水。③H202室温孵育10 min。④0.01M PBS洗2× 3 min。⑤枸橼酸缓冲液烧开修复40 min,冷却。⑥0.01M PBS洗2× 3 min。⑦滴加1∶100稀释的anti-GFAP 25 μL,37 ℃孵育60 min。⑧滴加生物素标记羊抗兔IgG,室温30~60 min。⑨0.01M PBS洗3×5 min。⑩DAB显色液染色约5 min,自来水冲干净。0.01M PBS洗3×2 min。蒸馏水洗;梯度酒精脱水,中性树脂胶封片。
1.2.2 免疫组化图象分析及处理 每组内每张大鼠脑切片在皮质和海马区随机挑选3个200倍视野进行拍照。应用Image-Pro Plus6.0软件对每张照片进行分析得出每张照片的阳性细胞数和累积光密度值(Integral optical density,IOD)。IOD值越大,阳性表达越强。
1.3 统计学分析数据 用SPSS 13.0统计软件录入及分析,采用单因素方差分析做差异比较,有差异者进一步进行LSD两两比较,相关分析采用pearson相关分析,检验水准α=0.05。
2 结果
对照组及低剂量组仔鼠21 d、60 d皮质部GAP-43阳性细胞数较多,呈棕黄色,胞浆染色,阳性细胞密集分布;高剂量组与对照组比较,海马和皮质部GAP-43阳性细胞数目很少,而且染色较浅。随着给药剂量和给药时间的增加,GAP-43阳性细胞数目逐渐减少,且染色变浅。21 d各剂量组脑组织与60 d比较,GAP-43阳性细胞较小,密度较大,细胞重叠较多(见图1~2)。
图像分析数据显示,孕鼠NP暴露后,21 d、60 d 高剂量组仔鼠皮质部位GAP-43免疫反应阳性细胞平均数目、积分光密度低于对照组,有统计学差异(P<0.05) ,中、低剂量组与对照组相比,未见显著性差异;且21 d、60 d仔鼠皮质部位GAP-43阳性细胞数与NP暴露剂量呈负相关(r=-0.537、-0.697,P<0.05);21 d、60 d仔鼠皮质部位GAP-43光密度与NP暴露剂量呈负相关(r=-0.711、-0.568,P<0.05),从纵向比较,各暴露组21 d仔鼠皮质GAP-43阳性细胞数高于60 d(t=1.391,P<0.05,见表1)。
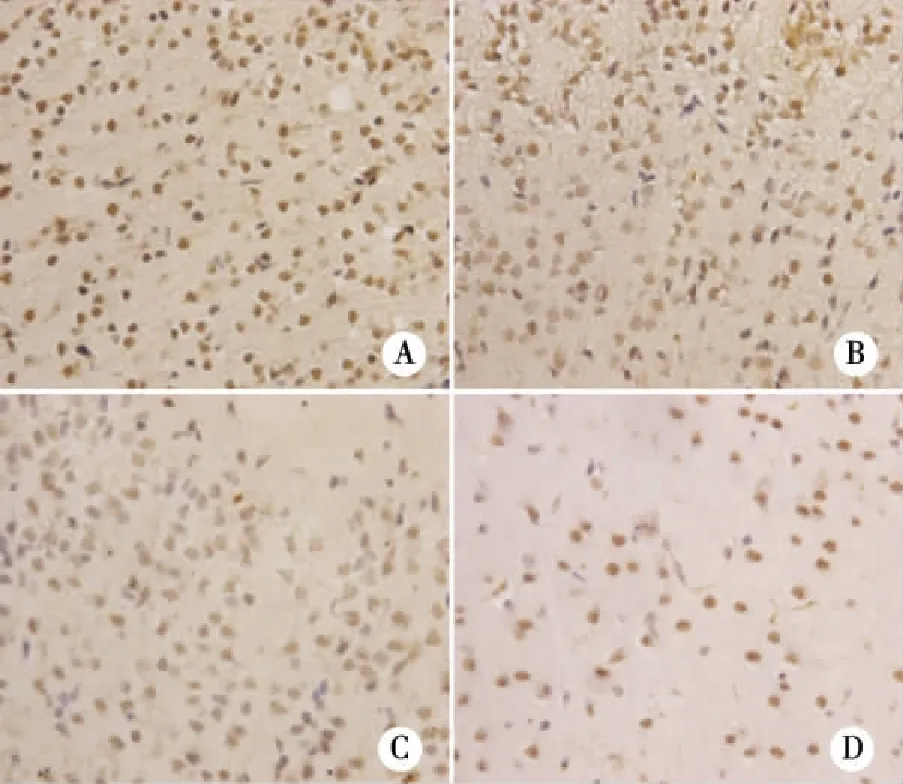
注:A:对照组;B:低剂量组;C:中剂量组;D:高剂量组图1 NP各剂量组21 d仔鼠皮质GAP-43蛋白表达(×200)
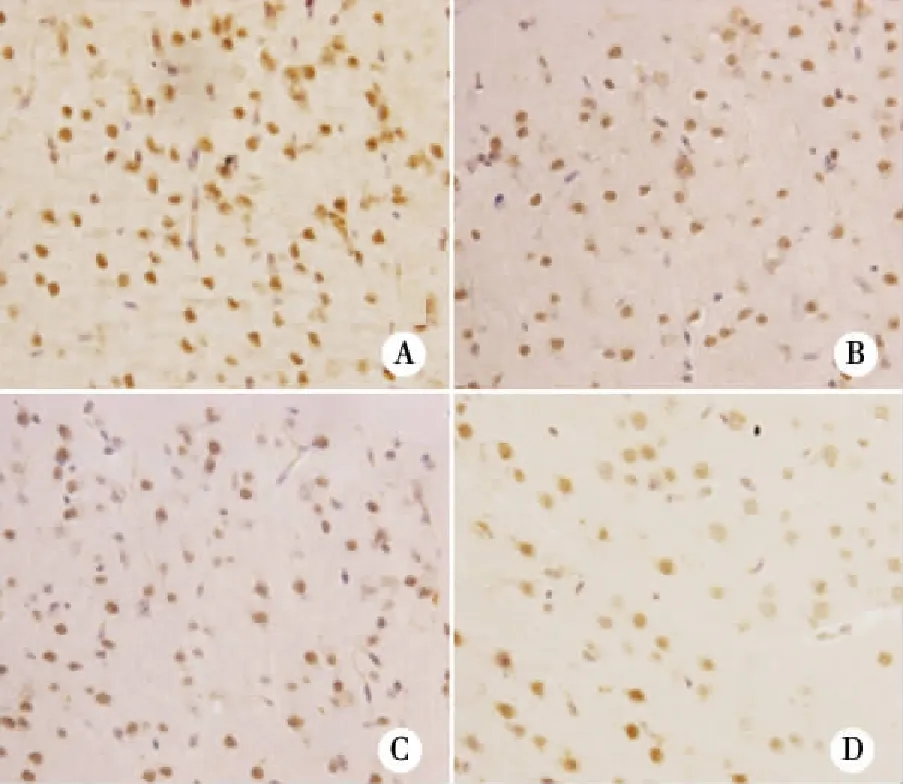
注:A:对照组;B:低剂量组;C:中剂量组;D:高剂量组图2 NP各剂量组60 d仔鼠皮质GAP-43蛋白表达(×200)
表1各组仔鼠21 d和60 d皮质部位GAP-43蛋白表达
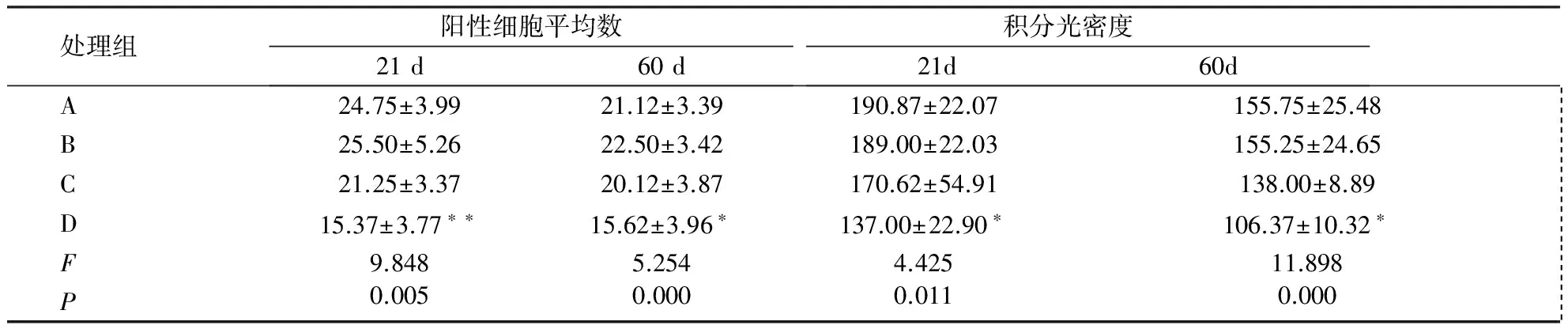
处理组阳性细胞平均数21d60d积分光密度21d60dA24.75±3.9921.12±3.39190.87±22.07155.75±25.48 B25.50±5.2622.50±3.42189.00±22.03155.25±24.65 C21.25±3.3720.12±3.87170.62±54.91138.00±8.89 D15.37±3.77∗∗15.62±3.96∗137.00±22.90∗106.37±10.32∗ F9.8485.2544.42511.898 P0.0050.0000.0110.000
注:方差分析:与对照组比较*P<0.05,**P<0.01。
3 讨论
GAP-43广泛的分布神经系统中,参与神经元发育、再生、LTP形成。正常大鼠脑内许多区域有GAP-43免疫反应阳性神经元[7]。GAP-43一般在出生后1周达到表达高峰,随着年龄增加而逐步下降,大部分脑区GAP-43表达水平很低,而皮质部GAP-43一直保持在较高水平[8]。本研究结果与文献报道的一致,结果显示,对照组仔鼠在出生后21 d直到60 d,大脑皮质部位均可见GAP-43免疫反应阳性神经元。相对断乳期来说,虽然成熟期GAP-43免疫反应阳性细胞数减少、光密度值较小,但仍然有表达,说明从断乳期到成熟期,仔鼠脑组织中的GAP-43在仍然发挥信号转导和递质释放等作用。
目前未见NP对神经生长相关蛋白GAP-43影响的研究,因此,为了从神经生长相关营养因子这个角度,有更多的实验数据证实NP的神经毒性,进一步探索NP对神经系统特别是子代神经系统的毒性机制,本部分实验观察和检测了在神经元生长发育及学习记忆等过程中发挥重要作用的神经生长相关蛋白GAP-43的蛋白表达,结果表明,孕期NP暴露后, 从断乳期到儿童期,仔鼠脑组织皮质部GAP-43表达受抑制,高剂量组与对照组比较差异有统计学意义,且GAP-43的表达与NP暴露剂量呈负相关,纵向比较发现,仔鼠成熟期的GAP-43蛋白及mRNA表达较断乳期少。
综合以上实验研究结果推测,大鼠孕期NP暴露后,有可能通过抑制GAP-43的表达,进一步干扰GAP-43参与的神经系统生长发育的多个环节,包括干扰信号转导、神经递质的释放、突触可塑性、Ca2+信号传递和磷脂代谢以及单胺类递质释放等,进而影响神经系统的各项生理功能,损伤子代的学习记忆。这种损害可以一直持续到成年期,即使停止NP暴露,仔鼠的脑海马区和皮质部GAP-43表达量仍然未能恢复到对照组水平,其学习记忆能力也不能完全恢复。
[参考文献]
[1] Jie X, Jianmei L, Zheng F,Lei G,et al.Neurotoxic effects of nonylphenol: a review[J]. Wien Klin Wochenschr, 2013, 125(3-4):61-70.
[2] Xu J, Wang P, Guo W F. Seasonal and spatial distribution of nonylphenol in Lanzhou Reach of Yellow River in China[J]. Chemosphere, 2006, 65(9):1445-1451.
[3] Kim S K, Kim B K,Shim J K, et al.Nonylphenol and Octylphenol-Induced Apoptosis in Human Embryonic Stem Cells is Related to Fas-Fas Ligand Pathway [J]. Toxicol Sci, 2006,9(19):1832-1835.
[4] Zha J, Wang Z, Wang N, et al. Histological alternation and vitellogenin induction in adult rare minnow after exposure to ethynylestradiol and nonylphenol[J]. Chemosphere, 2006,7(14):1079-1081.
[5] Jie X, Yang W, Jie Y, et al. Toxic Effect of Gestational Exposure to Nonylphenol on F1 Male Rats[J]. Birth Defects Research (Part B), 2010,89(5):418-429.
[6] Chirwa S, Aduonum A, Pizarro J, et al. Dopaminergic DA1 signaling couples growth associated protein 43 and long-term potentiation inguinea pig hippocampus[J]. Brain Res Bull, 2005,64(5):433-440.
[7] Viberg H,Mundy W J Eriksson P.Neonatal exposure to decabrominated diphenyl ether results in changes in BDNF,CaMKII andGAP-43,biochemical substrates of neuronal survival,growth,and synaptogenesis[J] . Neurotoxicology, 2008,29(1):152-159.
[8] Tolner E A,Vliet E A,Holtmaast A J,et a1.GAP-43 mRNA and proteinexpression in the hippocampal and parahippocampal region during thecoupe of epilep togenesis in rats[J]. Eur J Neurosci, 2003,17(11):2369-2380.

