成年大鲵实验室饲养及蜕皮和体表粘液收集方法
许永杰,李学英, 王大忠,罗蔓莉,耿娜娜,郑 翔
(1.遵义医学院 细胞生物学与遗传学教研室,贵州 遵义 563099; 2.遵义师范学院,贵州 遵义 563002)
大鲵(Andriasdavidianus),俗称娃娃鱼,属两栖纲有尾目隐鳃鲵科,我国主要分布在贵州、陕西、湖南等地。其被誉为“活化石”,具有很高的食用及药用价值,被国家列为Ⅱ类重点保护动物。王利峰等发现大鲵皮肤分泌粘液中含有抗菌肽,能够在浓度为12~22μg /mL时具有对革兰阴性和革兰阳性细菌的抑菌作用[1]。Guo等报道大鲵粘液提取物具有磷酯酶A2活性,大鲵的粘液和蜕皮是提取DNA的优质材料[2-3]。从粘液和蜕皮中提取DNA与从肝脏等中提取DNA相比,明显具有非损伤性的优势[4]。非损伤性取材或其他科学研究都需要将大鲵人工饲养一段时间,然而实验室大多不具备养殖场所具备的水源、食物、气温等条件,因此提供实验室成功饲养大鲵的数据和资料显得很有必要。鉴于此,本文提供了1年实验室成功饲养大鲵和用于大鲵皮肤粘液和蜕皮收集的基本数据。
1 材料与方法
1.1 实验材料 鱼缸(长120 cm,宽45 cm,高30 cm),BS110S型电子天平(北京塞多利斯仪器系统有限公司),红水温度计(衡水布莱迪仪表有限公司),FP-1006型增氧机(西安广腾电子科技有限公司),YSD-4G型药理、生理实验多用仪(北京众实迪创科技发展有限责任公司),空调(格力电器股份公司)。
1.2 实验动物 人工养殖第2代大鲵1条,全长94 cm,体重5.75 kg,雌性,购于贵定锦江娃娃鱼有限责任公司。
1.3 实验方法
1.3.1 大鲵饲养方法 模拟野生大鲵阴暗的生长环境,用黑纸将玻璃鱼缸全部封闭,鱼缸上面搭盖黑色遮盖物,使鱼缸内不见光线。将大鲵小心放进鱼缸内,避免刮擦伤。饲养过程中将大鲵放于安静的实验室。养殖用水为在空气中静置3 d的自来水,pH值为6.65~7.16,增氧机增加溶氧量,连续不断供氧, 根据天气变化的情况和水质的混浊度,2~5 d换水一次。根据大鲵进食的情况,2~5d在19∶00~20∶00投饵一次。投饲食物为鲤鱼,切为鱼块,摄食量以大鲵8 min未再进食为准,即所投最后鱼块如果大鲵在8 min内未被摄食,计算摄食量为最后一块之前所摄食鱼块重量。观察记录水温、水质、增氧情况和大鲵食量、精神状态和排便情况。
1.3.2 电刺激法和背部直接刮擦法 分别以10~50 V电压多位点刺激大鲵背部皮肤8 min,刺激后10 min收集大鲵粘液,其刺激的时间点分别为第1、3、6、8、16天。背部直接刮擦法为灭菌朔料三角板在大鲵背部直接稍用力刮擦。
2 结果
2.1 大鲵生长状况 在2011年8~9月和10~11月温度在20~24 ℃,大鲵活动量大,反应敏捷,摄食次数分别为14次和16次,总摄食量分别为480.42 g和773.38 g;12月温度在7~14 ℃,大鲵活动量小,反应迟钝,摄食次数为5次,总摄食量为148.56 g;2012年3~4月温度在7~24 ℃,随温度升高大鲵活动量逐渐增强,摄食次数为14次,总摄食量为363.50 g;5~6月温度在20~24 ℃,大鲵活动性强,摄食次数为15次,总摄食量为511.12 g;7~8月温度为22~24 ℃,大鲵活动性强,摄食次数为14次,总摄食量为403.72 g(见图1)。在适宜温度范围(15~22℃)内大鲵摄食反应灵敏,主动摄食,摄食量大;在低温范围内(7~11 ℃)大鲵摄食反应迟钝,不主动摄食,摄食量小。在7~11 ℃大鲵活动量小,静止在水缸中,长时间不游动;在12~14 ℃大鲵活动量稍有增加,在水中缓慢游动;在15~22 ℃活动性最强,在水中快速游动。大鲵在水温为15~22 ℃摄食量大和活动度高,反应敏捷,生长状况良好。
2.2 物理刺激法观察记录大鲵反应
2.2.1 电刺激法观察大鲵反应 在一个月内进行电刺激实验,记录电压幅度、时间及大鲵反应等参数并进行统计分析(见图2)。给予10 V电刺激,大鲵表现出躁动不安,皮肤大量脱落,收集到蜕皮3.69 g;给予20~40 V电刺激,大鲵反应逐渐更加强烈,躁动越来越强,背部弓起,发怒,有攻击行为,仅收集到少量蜕皮或未收集到蜕皮;给予50 V电刺激,大鲵发怒,处于高度防御和进攻状态,尾部不断击打鱼缸四壁,产生大量蜕皮。在10~40 V电压均未收集到粘液,在50 V电压,大鲵处于高度激惹状态,有少量粘液0.2 g。
2.2.2 背部直接刮擦法观察大鲵反应 用灭菌塑料三角板在大鲵背部稍用力来回刮,观察大鲵反应。刮1 min后,见大鲵皮肤分泌粘液,开始为稀薄透明状,容易从刮板上取下,随后为粘稠白色粘液,不易从刮板取下。共收集到77.76 g粘液。
2.2.3 电钻噪音刺激后大鲵反应 大鲵在从生态饲养环境移到实验室中的前半月时间中,躁动,不进食,且在电钻噪音下活动度加大,且分泌了大量的粘液和蜕皮。经过1个月的时间,即适应了实验室环境。再以电钻噪音刺激,大鲵无反应。

注:图中精神状态、水质和增氧得分1,2,3分别表示程度的低,中,高。图1 实验室饲养大鲵生长状况
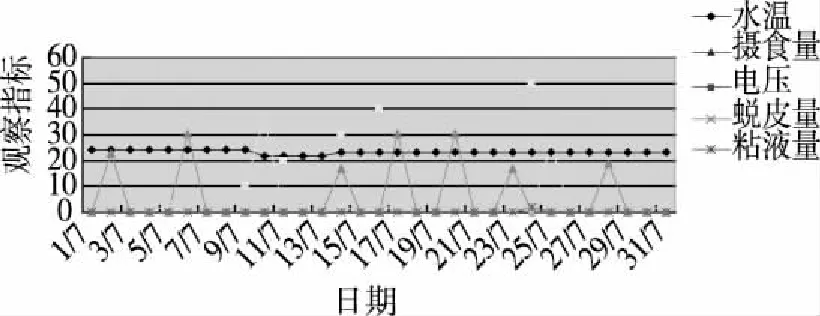
注:图中粘液量和蜕皮量数值均扩大10倍,以便于趋势分析。图2 电刺激大鲵各项数据
3 讨论
大鲵生态养殖技术日臻成熟,养殖业呈现良好发展态势,生态饲养数据已有报道,但大鲵的实验室饲养数据,未见报道。沈猷慧等(2000)报道大鲵喜阴暗怕阳光、喜安静怕噪音、喜清水怕浑水、喜凉爽怕炎热和鲵苗喜群居、成鲵喜独居等习性[5]。实验室饲养大鲵,大鲵在7~11℃摄食量小,反应迟钝,活动度弱;水温在15~22 ℃时摄食量大,活动度高,反应敏捷,适宜大鲵生长。同沈猷慧等对野生大鲵生存条件的报道相一致。
目前,对大鲵产品的开发均是宰杀后对其表皮、肌肉、脂肪等进行加工利用,这样粗放型的利用方法不能充分发掘大鲵资源的价值。随着养殖规模的扩大,大鲵资源的精深加工利用已经成为一个关系大鲵产业能否持续健康发展的紧迫课题。针对大鲵体内富含多种天然生物活性物质,对大鲵活性成分进行提取、研发具有高附加值的下游产品如食品、化妆品、保健品、药品等,可以实现人工养殖大鲵产品的产业化、市场化和国际化。大鲵皮肤粘液中含有抗菌肽、抗氧化和增强机体免疫等活性物质[1,6],并且已经开发出“湘鲵”等护肤品和“仙鲵蔻”系列牙膏产品。如果从剥离的两栖类皮肤中直接获得抗菌肽必须处死动物,不利于资源的可持续利用。因此,探索非损伤性、可重复采集的方式来收集大鲵皮肤粘液进行抗菌肽研究是必要的。诱导刺激粘液的方法主要有:微生物诱导法、化学物质诱导法(去甲肾上腺素)、物理刺激法(电流刺激和按摩)[7]。Asoodeh等用4~6 V电压电刺激沼泽蛙,收集蛙类皮肤粘液[8],而杨国华等发现中国大鲵表面神经丘杯状托的缺失[9],故此本课题组推测中国大鲵皮肤表面神经丘感受刺激的阈值可能较高,选择了10~50 V电压进行阶梯式电刺激以收集皮肤和体表粘液。结果发现,除第1次电刺激(10V)的蜕皮量较大(3.69 g)外,之后虽然增加了刺激电压,蜕皮量未增加,反而大大下降,也未收集到体表粘液;当电压从20V增至50V时,蜕皮量有一定程度的提高,但仍然低于第1次刺激,体表仅有少量粘液分泌。此时大鲵已经处于极度激怒状态,为避免过高电压对大鲵机体可能造成的损伤而没有进一步进行实验。可见,电刺激对于大鲵皮肤及其粘液的收集不是一种适宜的方法。直接刮擦大鲵背部,观察到大量粘液分泌,其作用可能相当于直接按摩大鲵背部粘液腺和颗粒腺,促使粘液大量分泌,但也有可能是大鲵的防御反应。其次,此法操作相对简单,可以避免微生物法中需要选择菌种和掌握接种菌量的弊端。同时,用直接刮擦法进行试验期间,大鲵活动度和摄食量无明显变化,生存状况良好。可见是一种较好的实现持续收集大鲵皮肤粘液的有效方法。此外,大鲵饲养过程中,还观察到电钻噪音在首次对大鲵进行干扰时,也使大鲵皮肤产生大量的粘液。但再次干扰时未见此现象。可见,成年大鲵对声音和电刺激均有一定的耐受,对其生存无太大影响。
综上所述,通过模拟大鲵生境,可以在实验室内进行大鲵的长期饲养,便于对其取材以进行科学研究。对于体表粘液的收集来说,直接刮擦法是一种简单、易行、有效的方法。
[参考文献]
[1] 王利锋, 李学英, 王大忠. 大鲵皮肤分泌液中抗菌肽的鉴定及生物活性研究 [J]. 中国生化药物杂志, 2011, 32(4):269-272.
[2] Guo W, Ao M, Li W, et al. Major biological activities of the skin secretion of the Chinese giant salamander, Andrias davidianus [J]. Z Naturforsch C, 2012, 67(1-2):86-92.
[3] Guo W, Ao M, Li W, et al. Skin secretion and shedding is a good source for non-destructive genetic sampling in the Chinese giant salamander, Andrias davidianus [J]. Z Naturforsch C, 2013, 68(3-4):164-168.
[4] 张志敏, 刘南君, 牛静, 等. 煮沸裂解法快速提取大鲵DNA [J].遵义医学院学报, 2010, 33(5):424-425.
[5] 李德俊, 周开亚, 费梁. 两栖爬行动物学研究 [M]. 贵州:贵州科技出版, 2000:326-331.
[6] 曲敏, 闰欣, 李伟, 等. 大鲵低聚糖肽对小鼠免疫功能调节作用的研究 [J]. 北京农学院学报, 2012, 27(1):42-44.
[7] 马瑜, 孙燕, 李治. 两栖类皮肤抗菌肽的分离纯化与抗菌活性检测技术 [J]. 药物生物技术, 2010, 17(1):83-86.
[8] Asoodeh A, Zardinia H Z, Chamanic J K. Identification and characterization of two novel antimicrobial peptides, temporin-Ra and temporin-Rb, from skin secretions of the marsh frog (Rana ridibunda) [J]. J Pept Sci, 2012, 18(1):10-16.
[9] 杨国华, 程红, 付宏兰, 等. 中国大鲵机械感受器的超微结构 [J]. 动物学报, 2001, 47( 5) : 587-592.

