结核分枝杆菌ClpC2基因序列分析及功能预测
李岱容,穆柳青,张春燕,杨 春
(1.重庆医科大学附属第一医院 呼吸科, 重庆 400016;2.重庆医科大学 病原微生物教研室, 重庆 400016)
结核分枝杆菌(mycobacteriumtuberculosis, MTB)引起的结核病是重要的传染病,随着耐药和泛耐药菌株增多,结核病仍然给人们的生命健康带来了巨大的威胁[1]。目前结核杆菌的诊断与治疗均存在很多的难点,急需新的诊断指标与治疗靶点。ATP依赖的Clp蛋白酶系统是重要的酶系统,参与调节体内蛋白质代谢,清除不可逆损伤蛋白,对外应激耐受及维持内环境的稳态。MTB具有自身特殊的Clp蛋白酶系统,含有多个Clp亚基: ClpP1、ClpP2、ClpB、ClpC1、ClpC2、ClpX[2]。目前MTB的Clp蛋白酶中除ClpP1、ClpC1外,其余亚单位的结构功能仍然未有文献对其详细阐述[3-4]。由于MTB生长缓慢,具有高致病性,实验条件苛刻,本文应用生物信息学的方法,重点对ClpC2亚单位的保守性及其生物学作用进行分析,希望能从中得到更多的信息,为结核杆菌的诊断和治疗提供新的靶点。
1 方法
1.1 多重序列比对和进化树构建 首先在NCBI数据库中查找MTB的标准菌株H37Rv的clpC2基因核苷酸序列,用NCBI的BLAST程序搜索其同源生物序列。使用 ClustX 2.0版软件进行多重序列比对,序列对齐后再加以人工检查。进化树使用MEGA5.1软件的邻接归并法(Neighbor-Joining Method, NJ)构建,Kimura两参数模型(Kimura′s two-parameter),自展检验(bootstrap analysis)重复1 000次。基于分枝杆菌16s rRNA基因进化树的构建也采用上述同样的方法进行。
1.2 种内及种间进化分歧 运用MEGA5.1软件包中的Kimura′s two-parameter模式对分枝杆菌属16s rRNA和clpC2基因序列进行分析后,计算种内及种间进化分歧。
1.3 ClpC2保守结构域与二级结构的预测 从NCBI下载ClpC2的序列后,提交序列至http://swissmodel.expasy.org网站预测ClpC2 的保守结构域与二级结构[5]。
1.4 ClpC2蛋白酶的基本生物信息学分析 应用ExPASy的ProtParam对ClpC2氨基酸序列进行氨基酸数量、分子量、等电点、氨基酸组成及亲水性等基本理化性质的分析。应用PSORTb version 3.0.0分析蛋白质的亚细胞定位。蛋白质信号肽预测采用SignalP,参数选取革兰氏阳性菌和隐马尔可夫模型(HMM)。ProtScal分析重组蛋白质的疏水性。应用Gene ontology(GO)在线软件对ClpC2蛋白酶的功能进行分析(见表1)。
表1生物信息学分析网址

程序 应用网址ProtParam理化性质分析http://www.expasy.ch/tools/protparam.html/PSORTb亚细胞定位预测http://www.psort.org/ProtScal疏水性分析http://www.expasy.org/tools/protscale.html/SignalP信号肽预测http://www.cbs.dtu.dk/services/SignalP/Geneontology(GO)蛋白功能预测http://www.ebi.ac.uk/ego/
1.5 跨膜分析 用TMHMM2.0 在线工具对ClpC2的氨基酸序列跨膜进行预测分析。
2 结果
2.1 clpC2基因核苷酸序列分析及进化树构建 库中所有的分枝菌属的16s rRNA 和clpC2基因同源序列分别构建的系统进化树(见图1)。与16s rRNA基因相比,clpC2基因在分枝杆菌不同种之间的相似性降低,进化距离明显变大,明显分为两个大群。从图1B中可见,结核分枝杆菌复合群菌株(M.africanum,M.canettii,M.tuberculosis,M.bovis等)聚为一族,然而在非典型分枝杆菌中同源性低,在麻风杆菌中该同源基因缺如,总的平均进化距离为0.59,高于16s rRNA的总的平均进化距离(0.17)。
2.2 16s rRNA和clpC2同源基因之间的基因距离 虽然,clpC2基因与16s rRNA基因相比,进化距离明显变大,分枝杆菌不同种之间的相似性降低,但是,我们从表2中看出,clpC2在结核分枝杆菌复合群中基因距离几乎没有差距(0.00~0.01),显示clpC2在结核分枝杆菌复合群中高度同源,非常保守,而在其他分枝菌属中则呈现出不同的进化距离,明显高于16s rRNA的基因距离。
2.3 保守结构域的预测 经由Interproscan预测,ClpC2 的结构特征是具有两个Clp-氨基末端结构域(Clp-N)和一个Double Clp-N 基序(见图2)。Clp-N结构域序号为PF02861,分别位于第110与162、183与233位aa之间,与ClpA 和 ClpB蛋白氨基端同源,虽然这些域的功能不肯定,但是可以形成蛋白的结合位点[6]。Double Clp-N 基序序号为IPR023150,位于97与230位aa之间。Double Clp-N 基序可见于ATP依赖的Clp蛋白酶的N端,这个N端域可以与AAA(+)蛋白配体结合域D1相互作用[7]。
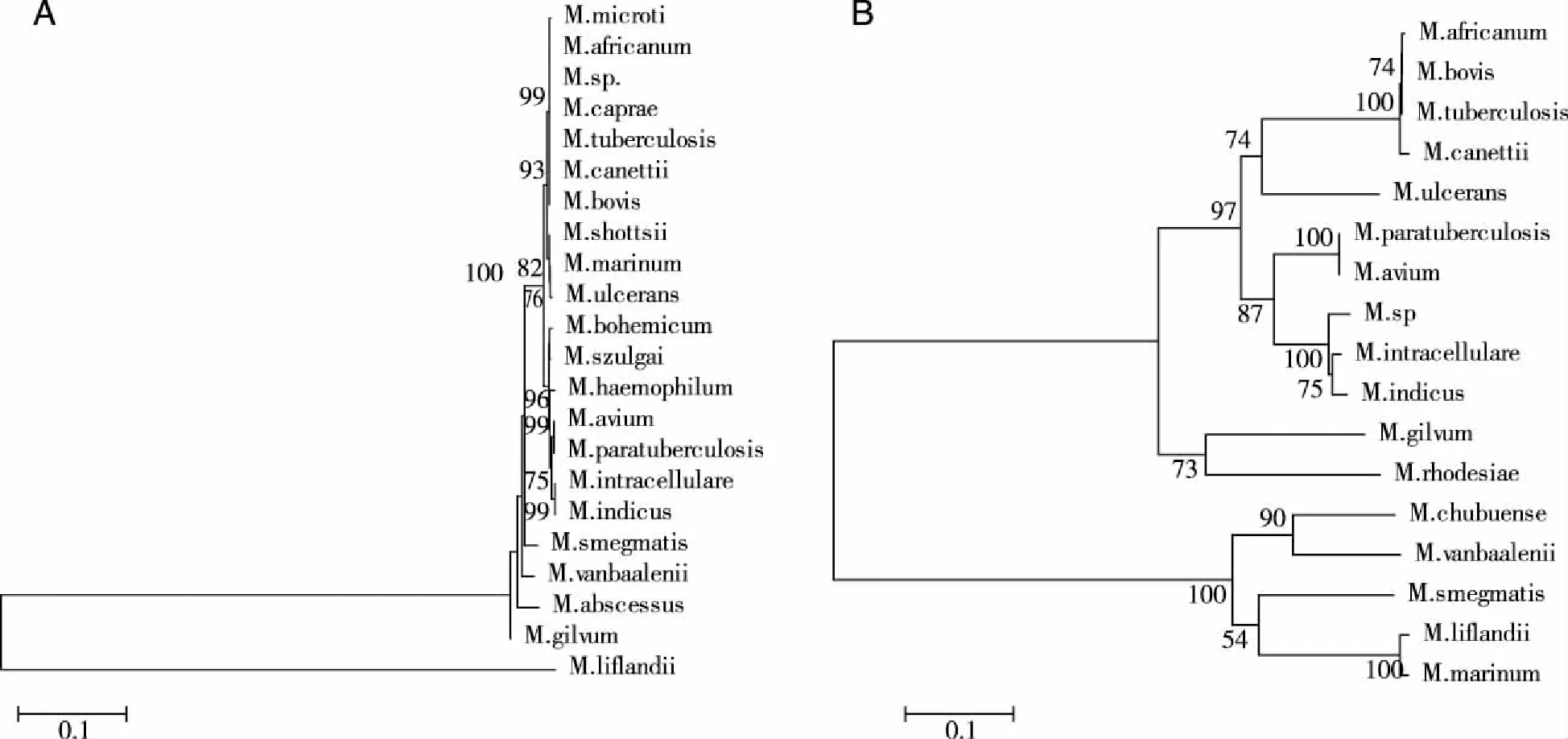
注:用Clustal X 软件作多重序列比对后,进化树采用neighbor-joining法用MEGA 5.1软件构建而成,评估方法为Bootstrap法。标尺的一个刻度代表0.1的进化距离,节点旁的数值表示1000 次重复中Bootstrap值的百分数。总的平均进化距离分别为0.17(见图1A)、0.59(见图1B)。图1 基于16s rRNA(A)和clpC2基因(B)核苷酸序列的分枝杆菌的系统进化树

图2 预测的结核分枝杆菌ClpC2蛋白结构域
表2 H37Rv菌中16s rRNA和clpC2基因与其他分枝杆菌属同源基因之间的基因距离
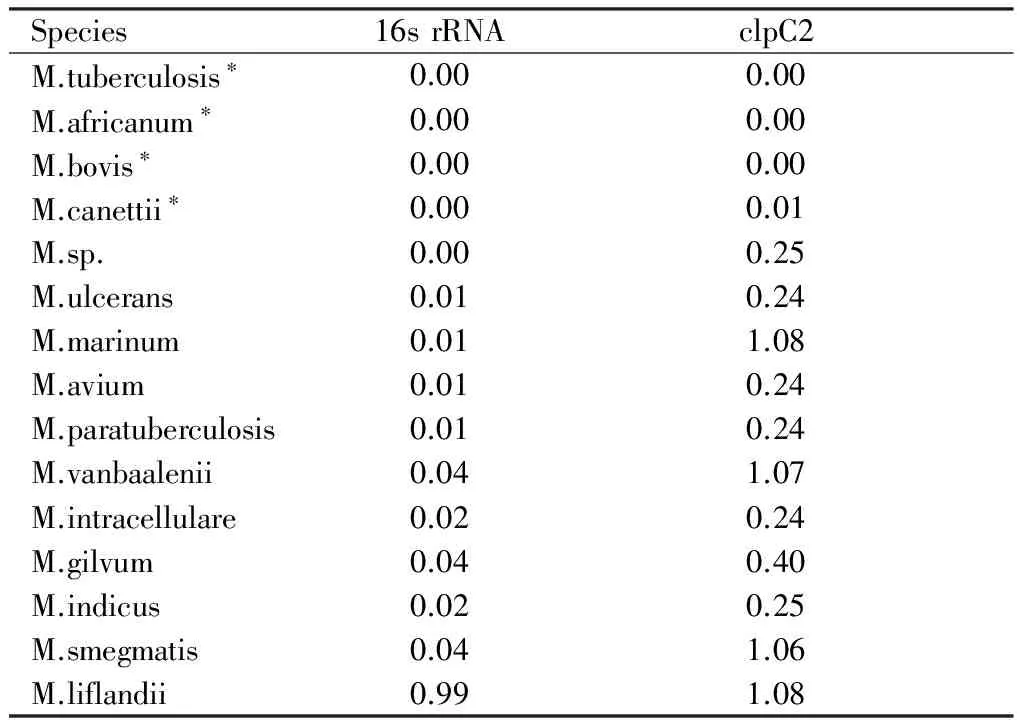
Species16srRNAclpC2M.tuberculosis∗0.000.00M.africanum∗0.000.00M.bovis∗0.000.00M.canettii∗0.000.01M.sp.0.000.25M.ulcerans0.010.24M.marinum0.011.08M.avium0.010.24M.paratuberculosis0.010.24M.vanbaalenii0.041.07M.intracellulare0.020.24M.gilvum0.040.40M.indicus0.020.25M.smegmatis0.041.06M.liflandii0.991.08
注:*为结核分枝杆菌复合群的成员。
2.4 二级结构预测 将ClpC2序列上传到SWISS-MODEL服务器,对其进行二级结构预测。结果表明ClpC2具有螺旋(helix)和卷曲(coil)两种折叠结构,在两个Clp-N功能域部分,彼此肽链的折叠差异很小,预示着高度保守的二级结构与功能的稳定有着紧密的联系。
2.5 ClpC2蛋白基本信息预测结果 ClpC2分子量26.6kD,理论等电点5.54,ProtParam预测ClpC2蛋白酶的总平均疏水值 (Grand Average of Hydropathy,GRAVY)为-0.122,为亲水性蛋白。PSORTb version 3.0.0 亚细胞定位预测ClpC2在细胞质表达(亚细胞定位分数:cytoplasmic 9.97)。SignalP预测ClpC2不是信号肽。G O 分析表明ClpC2具有水解、参与蛋白代谢、ATP-结合、肽酶活力功能,由此推知ClpC2应具有水解和催化功能,对细菌的代谢过程起作用,从而影响细菌的生理,在这些过程中需要消耗能量ATP。
2.6 跨膜分析 TMHMM2.0 软件分析结果表明,对ClpC2蛋白未形成跨膜结构域(见图3)。

图3 结核分枝杆菌ClpC2蛋白跨膜分析
3 讨论
1998年结核分支杆菌基因组测序的完成标志着人类与MTB的斗争进入到一个新的阶段[8],每个可能的药物靶子和可用于疫苗设计的保护性抗原均可能从基因组序列中检索。生物信息学是生物学与计算机科学及应用数学等学科相互交叉而形成的一门新兴学科,利用生物信息学方法寻找新的基因或蛋白质已有一定的基础,可以大大的节约时间和精力。
蛋白酶一直被认为是致病微生物的重要毒力因子。细菌可以通过ATP依赖的蛋白酶Clp系统调节其蛋白质水平及活性,以帮助细菌适应环境,从而进行生长、繁殖、转移等生命活动,进而引起各种感染性疾病[9]。作为一类高度保守并广泛存在的热休克蛋白,ATP依赖的蛋白酶Clp系统可帮助其他蛋白质进行正确折叠、修复、降解、复合物形成、运输等,从而影响细胞的生命活动,因此倍受科学家们的关注。
结核分枝杆菌Clp酶含有6个Clp亚单位:ClpB、ClpC1、ClpC2、ClpP1、ClpP2、ClpX。文献已经报道了ClpP1、ClpP2、ClpX、ClpC1等几个亚单位具有重要的功能,是生物的生理调控和蛋白质量控制所必需的,与结核分枝杆菌的致病性和在单核细胞、巨噬细胞中的持留性相关[10-12]。而对于ClpC2等亚基,到现在为止,蛋白的空间结构尚未解析出来,且对其在MTB致病中的作用,相关文献所提供的信息也很少。
clpC2基因又名clpx’,编码ClpC2单体蛋白,在结核分枝杆菌中,每个单体都为252个aa,基因功能未知,是假想的ATP结合亚单位。本研究经过核苷酸的多重序列分析,发现clpC2在结核分枝杆菌复合群中保守性非常高,而在其他非结核分枝杆菌中的同源性低,在麻风分枝杆菌中该同源基因缺如。
结构域是蛋白质中具有进化保守性的一段氨基酸序列,同时也是分子相互作用过程中发挥重要作用的结构和功能的区域。本研究发现ClpC2 的结构特征是具有两个Clp-N结构域和一个Douple Clp-N 基序。Clp-N结构域是Clp蛋白酶和Dnak/DnaJ分子伴侣的亚单位[6],Douple Clp-N基序与AAA(+)蛋白配体结合域D1相互作用,含有ClpA/ClpB家族、ClpC超家族所有的基序特征,归属于ClpA/ClpB家族和ClpC超家族。因此推测ClpC2同ClpA、ClpB功能相似,应该是Clp蛋白酶系统的调节亚基。
随着人类基因组计划的开展,在基因结构、定位、表达和功能研究等方面都积累了大量的数据,如何充分利用这些已有的数据资源,加速人类基因克隆研究,同时避免重复工作,节省开支,已成为一个急迫而富有挑战性的课题摆在我们面前。本文通过生物信息学预测,获得了ClpC2蛋白的许多基本信息:ClpC2蛋白为亲水性、非跨膜蛋白、在细胞质内表达,推测该蛋白可能作为分子伴侣具有稳定细胞内蛋白质量的作用。此外,由于具有水解和催化功能,可能还对细菌的代谢过程起作用,影响细菌的生理。由于这些过程中需要消耗能量,因而该蛋白仍然是一个依赖于ATP的Clp亚单位,可能是潜在的抗结核药物的作用靶点。
本研究通过对clpC2基因的信息学预测,为后续深入研究ClpC2蛋白的生物学功能、验证ClpC2作为药靶的候选蛋白的可行性提供基础资料。另外本文还发现clpC2基因的进化距离明显大于16s rRNA基因,且在结核分枝杆菌复合群中高度保守,在其他分枝杆菌的种间保守性相对较差,因而该基因还可用于鉴别结核分枝杆菌和非结核分枝杆菌。
[参考文献]
[1] World Health Organization. Global Tuberculosis Control: Surveillance P, Financing. WHO Report.(2010) http://www.who.int/tb/publications/global_report/2010/en/index.html.
[2] Ribeiro-Guimarães M L, Pessolani M C.Comparative genomics of mycobacterial proteases[J].Microb Pathog, 2007,43(5-6):173-178.
[3] Ollinger J, O′Malley T, Kesicki EA ,et al. Validation of the essential ClpP protease in Mycobacterium tuberculosis as a novel drug target[J].J Bacteriol, 2012,194(3):663-668.
[4] Schmitt E K, Riwanto M, Sambandamurthy V, et al. The natural product cyclomarin kills Mycobacterium tuberculosis by targeting the ClpC1 subunit of the caseinolytic protease[J].Angewandte Chemim (International Ed. In English), 2011,50(26):5889-5891.
[5] Zdobnov E M,Apweiler R. InterProScan-an integration platform for the signature-recognition methods in InterPro[J].Bioinformatics,2001,17: 847-848.
[6] Barnett M E,Zolkiewska A,Zolkiewski M.Structure and activity of ClpB from Escherichia coli:Role of the amino-and carboxyl-terminal domains[J].J Biol Chem, 2000,275(48):37565-37571.
[7] Guo F, Maurizi M R , Esser L , et al. Crystal structure of ClpA, an Hsp100 chaperone and regulator of ClpAP protease[J].The Journal of biological chemistry, 2002,277(48) :46743-46752.
[8] Cole S T, Brosch R, Parkhill J, et al. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence[J].Nature,1998, 393(6685):537-544.
[9] Kajfasz J K, Martinez A R, Rivera-Ramos I, et al. Role of Clp proteins in expression of virulence properties of Streptococcus mutans[J].J Bacteriol,2009,191(7):2060-2068.
[10] Raju R M, Unnikrishnan M, Rubin D H, et al.Mycobacterium tuberculosis ClpP1 and ClpP2 function together in protein degradation and are required for viability in vitro and during infection[J].PLoS Pathog, 2012,8(2):e1002511.
[11] Kar N P, Sikriwal D, Rath P,et al.Mycobacterium tuberculosis ClpC1: characterization and role of the N-terminal domain in its function[J].Febs J, 2008,275(24):6149-6158.
[12]Dziedzic R, Kiran M, Plocinski P, et al.MycobacteriumtuberculosisClpX interacts with FtsZ and interferes with FtsZ assembly[J].PLoS One, 2010,5(7):e11058.

