MiRNA-93-5p对VEGF的转录调控及其与梅花鹿茸细胞增殖的关系1)
李璐 李婷 李沐 吴炎 齐琳 崔东明 胡薇
(吉林农业大学,长春,130118)
MiRNA-93-5p对VEGF的转录调控及其与梅花鹿茸细胞增殖的关系1)
李璐 李婷 李沐 吴炎 齐琳 崔东明 胡薇
(吉林农业大学,长春,130118)
为了探讨miRNA-93-5p对梅花鹿血管内皮生长因子(VEGF)的转录调控作用及其与鹿茸细胞生长的关系,分离了鹿茸顶端软骨组织细胞,利用Trizol试剂法提取细胞总RNA,反转录合成cDNA。根据GenBank已发表的相关序列设计梅花鹿VEGF基因的3′端非编码区部分序列(3′UTR)特异引物并进行克隆,构建VEGF基因的3′UTR野生型及其突变体序列双荧光素酶报告基因载体并进行荧光素酶活性检测。再将人工合成的miRNA-93-5p模拟物转染鹿茸软骨细胞,MTT法检测鹿茸细胞体外增殖的变化;Western blotting分析VEGF蛋白的表达丰度。结果表明:成功获得了鹿茸组织VEGF基因的3′UTR序列,野生型序列长度为356 bp,突变体长度为336 bp。荧光素酶活性检测结果表明,转染野生型质粒组细胞荧光素酶活性降低,而转染突变体组细胞荧光素酶活性无明显变化。MTT法和Western blotting结果显示,鹿茸细胞的体外增殖受到抑制,VEGF蛋白的表达水平下降,且呈时间依赖性。
鹿茸细胞;miRNA-93-5p;血管内皮生长因子;转录调控;细胞增殖
鹿茸是雄鹿顶部未骨化且密生茸毛的幼角,每年周期性的脱落与再生,是哺乳动物中唯一可以完全再生的器官。鹿茸生长速度极快,在快速生长期可达到12.5 mm/d[1-2]。新生的鹿茸中具有极其丰富的血管,随着鹿茸的生长,血管也迅速延伸,以提供鹿茸生长时所需的营养物质[3-4]。血管内皮生长因子(VEGF)是一种具有高度生物学活性的功能性糖蛋白,可以使皮肤血管的通透性明显增加[5]。Kumar等[6]研究发现VEGF及其受体(VEGFR)能特异地促进细胞分裂、增殖及迁移,促进血管内皮细胞的有丝分裂,在肿瘤新生血管生成过程中起着至关重要的作用。Clark等[7]曾报道VEGF及VEGFR在皮肤、间充质层细胞、软骨细胞和初角茸的骨中都有广泛地表达。MicroRNA(miRNA)是一种广泛存在的内源性非编码蛋白质的单链小RNA,可以通过与靶标基因mRNA 3′非编码区上的靶点结合,介导mRNA降解或抑制mRNA转录后水平的表达,从而导致靶标蛋白表达量的下降[8-9]。近十年来的研究发现,miRNA在胚胎发育及细胞的增殖、分化和凋亡等多种生命活动中发挥着重要作用[10]。Lei等[11]曾报道miRNA能特异性识别VEGF靶基因3′非编码区序列,抑制靶基因的翻译,在蛋白表达的过程中起着精细的调节作用。但是,目前关于鹿miRNA的研究国内外报道甚少。因此,本研究从RNA组学的角度,以鹿茸顶端组织为研究对象,探讨miRNA对VEGF基因表达的调控及其对鹿茸细胞增殖的影响,以期更深入地探讨细胞生长因子在鹿茸生长调节机制方面可能具有的重大意义。此外,还可以促进我国鹿科动物miRNA研究的开展和不断深入。
1 材料与方法
1.1 材料
供试鹿茸:2013年6月,梅花鹿二杠锯茸采自长春市农科院鹿场一头3岁左右的东北梅花雄鹿。
主要试剂:限制性内切酶HindⅢ与EcoRⅠ购自大连宝生物工程公司;胶原酶Ⅰ、胶原酶Ⅱ、透明质酸酶及二甲基亚砜(DMSO)购自Sigma;高糖DMEM培养基购自Gibco;胎牛血清(FBS)购自天津市灏洋生物制品科技有限责任公司;HP转染试剂购自Roche;MTT购自Solarbio;双荧光素酶报告基因载体、miRNA模拟物购自广州市锐博生物科技有限公司;Dual-Luciferase Reporter Assay System购自Promega;SYBR GREENⅠ荧光定量PCR试剂盒购自天根生化科技有限公司;Western及IP细胞裂解液购自碧云天生物技术公司;兔抗人VEGFA抗体、羊抗兔IgG-HRP购自北京博奥森生物技术公司;ECL发光显色试剂盒购自北京康为世纪生物科技有限公司。
1.2 方法
鹿茸软骨细胞培养:按照Li等[12]的取材方法,使用高温消毒处理的手术刀在离鹿茸顶端5 cm处沿垂直鹿茸生长轴方向切断。采用酶消化法,将分离出的鹿茸软骨组织剪成1.0 mm3的小块,用胶原酶Ⅰ和透明质酸酶37 ℃消化1.5 h,再加入胶原酶Ⅱ继续消化3 h。当观察到大量细胞从组织块中游离出来时,1 000 r·min-1离心5 min。将离心收集的细胞与组织块加入含10% FBS的DMEM培养液中,置于培养箱中37 ℃、5%的CO2继续培养。
鹿茸软骨细胞总RNA提取与双链cDNA的合成:待鹿茸软骨细胞丰度达到80%以上时收集细胞,按照Trizol操作手册提取细胞样品总RNA,1.0%琼脂糖凝胶电泳检测其完整性。以提取的总RNA为模板,在逆转录酶AMV作用下反转录合成双链cDNA。
梅花鹿VEGF基因3′非编码区(3′UTR)野生型及其突变体序列的克隆与分析:参照GenBank中相关序列,设计VEGF基因3′UTR野生型及其突变体序列特异性引物(VEGF 3′UTR-F:CCGCTCGAGAAGGAGCCTCCCTCAGGGTTTCG。VEGF 3′UTR-R:GAATGCGGCCGCTGTGGGTGGGTGTGTCTACAGGAA-TC。VEGF 3′UTR-mut-F:GCGCAGATGTAGCGGGGTCCGG。VEGF 3′UTR-mut-R:GACCCCGCTACATCTGCGCACAG。)。以cDNA为模板进行PCR扩增,利用DNA凝胶回收试剂盒回收产物,将回收产物连接到pMD18-T载体上,转化大肠杆菌DH5α中,涂板并于37 ℃培养。挑取转化菌落,接种于LB液体培养基,37 ℃振荡培养过夜,提取质粒并将鉴定正确的重组质粒送北京三博远志生物技术有限责任公司进行序列测序。
双荧光素酶报告质粒的构建及荧光素酶活性检测:将VEGF基因3′UTR野生型及其突变体序列分别连入双荧光素酶报告基因载体,构建重组质粒pmiR-PB-ReportTMVector-VEGF-3′UTR,再将重组质粒与miR-93-5p模拟物(mimics)共同转染鹿茸软骨细胞。培养24、48、72 h后收集6孔培养板中各组细胞,加入PLB充分裂解,13 000 r·min-1离心5 min,收集上清液。按照Dual-Luciferase Reporter Assay System试剂盒说明书进行操作,再加入LARⅡ溶液,490 nm波长下测定各孔光吸收值,即萤火虫荧光素酶的活性测定值M1。最后加入Stop&Glo Substrate,490 nm波长下再次测定各孔光吸收值,即海肾荧光素酶活性的测定值M2。荧光素酶的表达量以M1/M2的比值表示。每次3个重复。
Stem-loop SYBR Green荧光定量PCR检测:待鹿茸软骨细胞汇合度达到80%时,将miR-93-5p模拟物转染细胞,培养24、48、72 h后收集细胞;提取细胞总RNA,反转录合成cDNA;以cDNA为模板,PCR分别扩增miR-93-5p及内参基因U6。上样体系,2.5×RealMasterMix 10.0 μL,模板1.00 μL,上游引物1.00 μL,下游引物1.00 μL,20×SYBR Solution 1.25 μL,RNase free H2O补充至25.00 μL。PCR条件,94 ℃ 2 min→(94 ℃ 20 s→58 ℃ 20 s→68 ℃ 20 s)40个循环,每个样品重复3次。数据处理采用2-ΔΔCt相对定量的方法。
miR-93-5p对鹿茸细胞体外增殖影响的MTT法检测:取生长汇合度为80%的鹿茸软骨细胞制成细胞悬液接种于96孔板中,细胞贴壁后转染miR-93-5p模拟物,培养24、48、72 h后,向培养板中加入5 g·L-1MTT溶液20 μL,37 ℃孵育4 h,弃去上清液。每孔加入200 μL DMSO,酶标仪490 nm波长下测定各孔光吸收值(OD值)。
蛋白质的免疫印迹分析:将细胞汇合度为80%的鹿茸软骨细胞接种于6孔板中,24 h后转染miR-93-5p模拟物,待培养24、48、72 h后分别收集细胞,加入细胞裂解液,12 000 r·min-1离心20 min。BCA法测定蛋白质量浓度,并将所有样品调至质量浓度一致。SDS-聚丙烯酰胺凝胶电泳结束后,将蛋白胶转移到PVDF膜上,5%脱脂奶粉室温下封闭2 h,TBST洗膜3次,再将PVDF膜置于含一抗兔抗人VEGFA抗体(1∶200)的封闭液中温浴2 h,TBST洗膜3次,加入羊抗兔的IgG-HRP二抗(1∶500)中,室温孵育2 h,TBST洗膜后,进行ECL法显色。
统计学分析:试验数据采用SPSS 13.0统计学软件进行独立样本t检验,判断其统计学意义,以平均值±标准差表示。
2 结果与分析
2.1 鹿茸组织总RNA提取结果
采用Trizol法提取鹿茸组织总RNA,经1.5%琼脂糖凝胶电泳验证,提取RNA呈现28、18、5 s 3条带,总RNA提取成功,可进行后续试验(图1)。

图1 鹿茸组织总RNA提取电泳图
2.2 梅花鹿VEGF基因3′UTR野生型及其突变体序列的克隆
以鹿茸软骨细胞cDNA为模板,利用VEGF 3′UTR及其突变体引物序列进行PCR扩增,并对重组质粒pMD-18T-VEGF 3′UTR(包括野生型及其突变体)进行双酶切鉴定。PCR及酶切产物经琼脂糖凝胶电泳检测,结果与预期大小一致,野生型为356 bp,突变型为336 bp(图2~图3)。
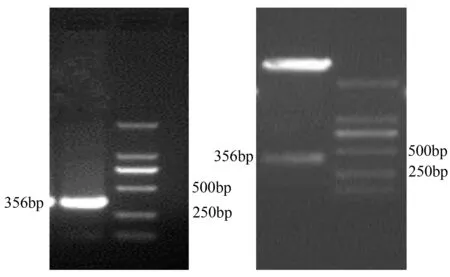
1.PCR鉴定产物;2.双酶切产物;M.DNA Marker(DL2000)。
图2 VEGF基因3′UTR野生型序列PCR扩增结果及双酶切鉴定结果
2.3 荧光素酶活性检测
荧光素酶活性检测结果见表1。与阴性对照组比较,转染组荧光素酶活性下降,其中48 h最为明显,证明该转染体系稳定有效。将VEGF 3′UTR上预测的结合位点突变后,与阴性对照组比较,荧光素酶活性未产生明显地变化,证实预测的VEGF 3′UTR上具miR-93-5p的结合位点。

1.PCR鉴定产物;2.双酶切产物;M.DNA Marker(DL2000)。
图3VEGF基因3′UTR突变体序列PCR扩增结果及双酶切鉴定结果
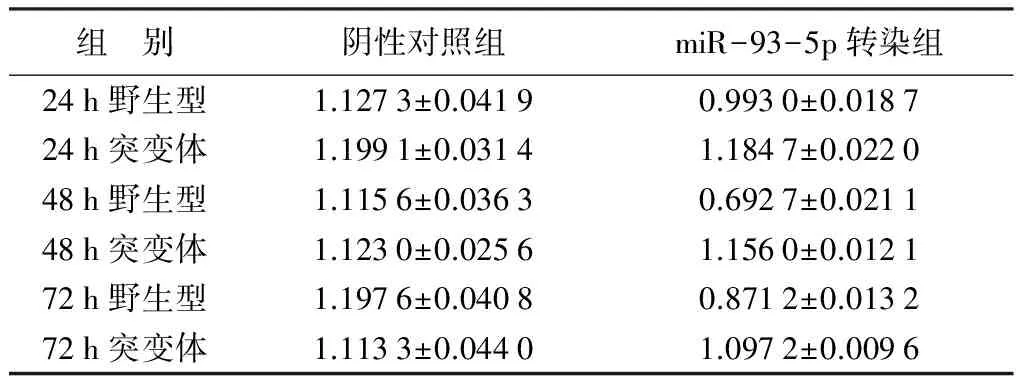
表1 荧光素酶检测结果
注:表中数据为平均值±标准差。
2.4 Stem-loop荧光定量PCR检测miR-93-5p的表达水平
鹿茸软骨细胞转染miR-93-5p模拟物24、48、72 h后,miR-93-5p相对表达水平分别为296.45、683.74、157.39。与正常细胞组(10.93)、阴性对照组(8.89)相比,转染组表达水平明显升高,且48 h表达水平最高,进一步验证了miR-93-5p可以在细胞内稳定而高效地表达。
2.5 鹿茸软骨细胞体外增殖MTT法检测
利用MTT法对转染后鹿茸软骨细胞的生长状态进行观察。由表2可知,鹿茸软骨细胞的增殖在转染miR-93-5p后发生显著变化,与正常细胞组及阴性对照组相比,转染miR-93-5p组鹿茸软骨细胞的增殖速度变缓,体外细胞的增殖受到抑制。
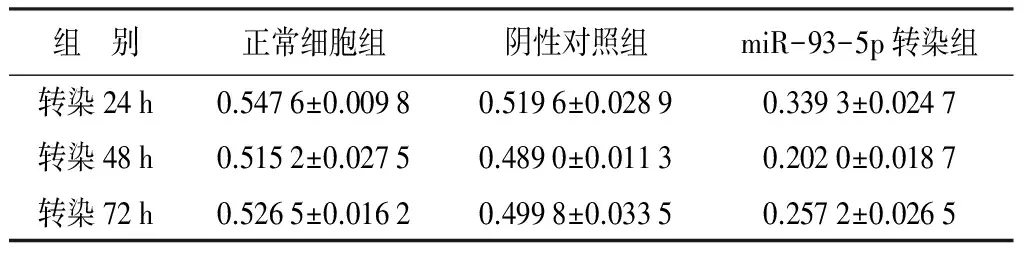
表2 转染miR-93-5p对鹿茸软骨细胞增殖的影响
注:表中数据为平均值±标准差。
2.6 miR-93-5p转染鹿茸软骨细胞后VEGF表达的Western blotting检测
利用Western blotting检测转染miR-93-5p后鹿茸软骨细胞VEGF蛋白的表达水平。结果显示,与内参GAPDH相比,正常细胞组与阴性对照组无明显变化,转染组蛋白表达水平随着时间的延长逐渐降低,说明miR-93-5p在一定程度上抑制了VEGF蛋白的表达,见图4。

1.正常细胞;2.阴性对照;3.转染24 h;4.转染48 h;5.转染72 h。
图4 转染miR-93-5p后鹿茸软骨细胞VEGF蛋白表达的Western blotting检测
3 结论与讨论
鹿茸是我国名贵的传统中药,其药用价值多少年来一直受到人们的青睐。鹿茸拥有令人惊奇的生物学现象:其具有惊人的生长速度,但却没有任何癌变的迹象;鹿茸是唯一能够完全再生的哺乳动物器官,每年能够完全再生一次[13]。因此,鹿茸已经成为很好地研究再生的医学模型,为人类提供了唯一的探讨生长调控过程的机会。有研究表明,这一现象是生长中的鹿茸顶端存在血管化的软骨,而有别于其它典型的无血管化软骨。但血管在软骨生长中的机制以及促使鹿茸快速生长的因素至今为止仍不太为人所知。还有研究显示,在鹿茸顶端前软骨和软骨组织检测到VEGF及其受体的表达,这一发现与VEGF在鹿茸血管生成中的作用是一致的。VEGF的生物学特性主要表现在:增加微血管的通透性,促进血管内皮细胞的分裂和增殖,进而导致新生血管的生成,VEGF主要是通过与其受体的结合发挥生物学作用[14]。
MicroRNA是所有小分子非编码RNA中研究得最多也最为深入的。它是真核生物细胞中存在的一类小调控RNA,它们基于与靶mRNA序列互补,可以降解靶mRNA和抑制蛋白质翻译,从而对生物体基因表达起到精细调节的作用。miRNA的功能主要是调节生物体内与机体生长、发育、疾病发生过程有关的基因的表达。在动物的全部基因中,miRNA参与了30%左右基因的表达调控,包括大多数生长、发育、癌症发生等生理机制[15-16]。目前,对鹿miRNA的鉴定、表达谱分析及功能研究知之甚少,而miRNA介导的表达调控方式是基因表达调控机制中不可缺少的重要组成部分,发现和鉴定特定组织细胞发育阶段中特定非编码RNA及其在基因表达调控中的具体作用是当前及今后一段时间内功能基因组学研究的热点之一。因此,鉴于鹿茸独特的生理作用,本课题首先在克隆获得VEGF基因3′UTR序列的基础上,利用生物信息学软件分析其3′UTR序列中存在的miRNA位点共31个,再结合本课题组以往制备的鹿茸顶端不同组织miRNA芯片结果,筛选出9种可调控VEGF基因的靶miRNA,发现其中miRNA-93-5p是鹿茸顶端不同组织中差异表达最明显的。据此,选择miRNA-93-5p进行后续的研究。同时,荧光素酶活性检测系统进一步验证了VEGF是miRNA-93-5p调控的靶基因。在此基础上,将人工合成的miRNA模拟物转染至鹿茸细胞后模拟内源性miRNA发挥作用。MTT法检测结果表明,与对照组比较,转染miR-93-5p的细胞增殖受到抑制,VEGF蛋白的表达水平有所下降,且呈时间依赖性。这些结果证明了miRNA-93-5p对VEGF具有一定的调控作用,进而对鹿茸软骨细胞的体外增殖具有抑制作用。
近年来,国内外众多学者对鹿茸角可完全再生这一特殊的动物学生命现象给予了高度的关注。而相对于其他哺乳动物来说,鹿miRNA的研究相对较少。本研究发现,在鹿茸软骨细胞的快速生长中,miRNA可以抑制VEGF的表达。从RNA水平上探讨了miRNA在鹿茸生长发育中的调控作用。不仅保存了鹿这一我国珍贵物种的基因资源,也为从根本上阐明鹿茸生长的分子机理提供了新的参考依据。
[1] 王艳梅.东北梅花鹿茸主要成分系统性比较研究[D].哈尔滨:东北林业大学,2004.
[2] Price J, Allen S. Exploring the mechanisms regulating regeneration of deer antlers[J]. Philosophical Transactions of the Royal Society of London Series B: Biological Sciences,2004,359:809-822.
[3] 魏明立,褚文辉,赵海平,等.鹿茸干细胞与鹿茸再生[J].特产研究,2011(2):47-51.
[4] 王秋玉,王本祥.论鹿茸生长因子[J].中医药学报,2000(6):10-12.
[5] Ellis L M, Hicklin D J. VEGF-targeted therapy:mechanisms of anti-tumour activity[J]. Nature Reviews Cancer,2008,8(8):579-591.
[6] Kumar P, Chatterjee S, Acharya S, et al. Significant modulation of macrophages associated cytokines TNF-α, VEGF and apoptotoic protein Bax, Bcl2 abrogates tumor cells[J]. Cellular immunology,2013,284(1/2):172-181.
[7] Clark D E, Lord E A, Suttie J M. Expression of VEGF and pleiotrophin in deer antler[J]. The Anatomical Record Part A: Discoveries in Molecular, Cellular, and Evolutionary Biology,2006,288(12):1281-1293.
[8] Iorio M V, Croce C M. MicroRNA dysregulation in cancer: diagnostics, monitoring and therapeutics[J]. EMBO molecular medicine,2012,4(3):143-159.
[9] Bossé G D, Simard M J. A new twist in the microRNA pathway: Not Dicer but Argonaute is required for a microRNA production[J]. Cell Research,2010,20(7):735-737.
[10] 呼高伟,陈兆国,程天印,等.MicroRNA及其研究现状[J].中国人兽共患病学报,2012,28(2):167-171.
[11] Lei Z, Li B, Yang Z, et al. Regulation of HIF-1αand VEGF by miR-20b tunes tumor cells to adapt to the alteration of oxygen concentration[J]. PloS One,2009,4(10):e7629.
[12] Li C, Waldrup K A, Corson I D, et al. Histogenesis of antlerogenic tissues cultivated in diffusion chambers in vivo in red deer (Cervuselaphus)[J]. Journal of Experimental Zoology,1995,272(5):345-355.
[13] 岳占碰,邓旭明,冯海华.鹿茸角发育与再生机理[J].经济动物学报,2005,9(1):46-49.
[14] Jacobsen J, Grankvist K, Rasmuson T, et al. Expression of vascular endothelial growth factor protein in human renal cell carcinoma[J]. BJU international,2004,93(3):297-302.
[15] Leshkowitz D, Horn-Saban S, Parmet Y, et al. Differences in microRNA detection levels are technology and sequence dependent[J]. Rna,2013,19(4):527-538.
[16] Long Jianjin, Wang Yin, Wang Wenjian, et al. Identification of microRNA-93 as a novel regulator of vascular endothelial growth factor in hyperglycemic conditions[J]. Journal of Biological Chemistry,2010,285(30):23457-23465.
Transcription Regulation Effect of miRNA-93-5p on VEGF Gene and Its Relationship with Antler Cell Proliferation
/Li Lu, Li Ting, Li Mu, Wu Yan, Qi Lin, Cui Dongming, Hu Wei
(Jilin Agricultural University, Changchun 130118, P. R. China)//Journal of Northeast Forestry University.-2014,42(11).-146~149
We isolated the cartilage cells from antler tip and extracted cells total RNA by Trizol reagent to explore the effect transcriptional regulation of miRNA-93-5p on vascular endothelial growth factor (VEGF) and the relationship with the growth of antler cells, and synthesized cDNA by reverse transcription. With the published relative sequence in GenBank, we designed and cloned the specially primers of 3’UTR of sika deer VEGF gene, constructed dual luciferase reporter gene vectors of VEGF gene 3’UTR containing wild-type or mutant sequence, and detected the relative activity of luciferase. We detected the changes of the in vitro proliferation of cartilage cells by MTT after transfected cartilage cells using miRNA-93-5p mimics, and analyzed the expression abundance of VEGF protein by western blotting. We obtained 3’UTR sequence of VEGF from antler tissue. The length of wild-type sequence is 356 bp and the length of mutant sequence is 336 bp. Luciferase activity detection indicates that the luciferase activity of the wild-type plasmid transfected cells is reduced, whereas mutant cells have no obvious change of luciferase activity. By MTT assay and western blotting, antler cells are inhibitedinvitroand the expression level of VEGF protein decrease along with the time increase.
Antler cells; miRNA-93-5p; Vascular endothelial growth factor; Transcriptional regulation; Cell proliferation
1) 国家自然科学基金(30972083);吉林省科技发展计划项目(20090574)。
李璐,女,1990年11月生,吉林农业大学生命科学学院,硕士研究生。
胡薇,吉林农业大学生命科学学院,副教授。E-mail:huwei9002@126.com。
2014年4月1日。
Q786
责任编辑:程 红。

