微波/过氧化氢降解水中甲基红
戴竹青, 王密华, 贾韧刃,周 盼(.常州大学环境与安全工程学院,江苏常州 364;.中国石油天然气股份有限公司抚顺石化分公司,辽宁抚顺 300)
微波/过氧化氢降解水中甲基红
戴竹青1, 王密华1, 贾韧刃2,周 盼1
(1.常州大学环境与安全工程学院,江苏常州 213164;2.中国石油天然气股份有限公司抚顺石化分公司,辽宁抚顺 113001)
研究了微波/过氧化氢协同作用下水中甲基红的降解。考察了甲基红初始质量浓度、pH、H2O2加入量、反应时间、温度等因素对降解率和降解量的影响,并建立了甲基红降解的数学模型。结果表明,碱性条件下、反应时间延长有利于甲基红的降解,甲基红初始质量浓度越大,则氧化苛刻度Z值越大,甲基红降解反应动力学为一级反应,反应速率常数为0.172 4 min-1,降解量的活化能126.6 kJ/mol。在H2O2加入体积分数为1.6%、甲基红初始质量浓度为130 mg/L、反应温度473 K、反应时间为12 min、pH=10的条件下,甲基红的降解率可达到78%。
甲基红;微波;过氧化氢;降解

对于水和废水的微波处理是一种有效方法。使用微波技术,可以使农药等各种有机化合物降解[5-8]。但仅仅单独依靠微波的能量不足以破坏许多化合物的化学键。因此,使用微波结合各种高级氧化技术来增强各种污染物的处理效率、缩短反应时间的各种微波协同氧化剂氧化染料的各种方法多有报道[9-11]。应用微波加热结合过氧化氢(MW-H2O2)处理污染物已被证明是一种有效的氧化技术[12-13],因为它会产生活性物质,由带有一个+2.8 eV氧化还原电位的羟基自由基组成,可以非选择性降解大部分有机化合物。同时,相比一些混合的微波系统,MW-H2O2体系不需要催化剂分离,并且没有污染环境的潜在风险,具有更大的优越性。
本文研究了微波/过氧化氢辐射下偶氮染料甲基红水溶液降解过程,考察各反应时间、温度、过氧化氢加入量等因素对甲基红降解量和降解率的影响,并提出甲基红实验条件下的降解数学模型。
1 实验部分
1.1 实验仪器与试剂
MDS-10微波消解仪,上海新仪微波化学科技有限公司;pHB-9901酸度计,上海艾旺工贸有限公司;Specord50紫外可见光分光光度计,德国Jena公司。H2O2溶液(质量分数30%)、甲基红均为分析纯。
1.2 实验方法
将20 mL甲基红水溶液放入微波消解仪中,在600 W的功率下消解后,取适量溶液用紫外可见分光光度计于436 nm处测其吸光度。利用甲基红溶液标准曲线A=0.066 2ρ-0.018 8(R2=0.999 4),计算出甲基红溶液反应前的质量浓度ρ0和反应后的质量浓度ρt,以计算甲基红溶液的降解率和降解量。
2 结果与讨论
2.1 甲基红降解模型的建立
配制质量浓度不同的甲基红溶液,在微波条件下,考察溶液初始质量浓度在50~150 mg/L、pH在2~12、过氧化氢加入体积分数在0.2%~1.6%、反应温度413~493 K、反应时间在4~16 min,各因素对降解率和降解量的影响。
考察不同参数设定下甲基红的降解量和降解率,对不同实验参数下获得的所有降解量、降解率数据进行多元非线性回归,得到降解量和降解率的公式如下:
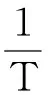
(1)
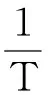
(2)
式中:ρ0为甲基红初始质量浓度,mg/L;T为反应温度,K;φ(H2O2)为H2O2加入体积分数,%;t为反应时间,min。
降解量回归公式相关系数为0.927 0,降解率回归公式的相关系数为0.904 8,自由度为66。
将实验值与计算值对比,列于表1和表2,结果表明,两个回归公式中,降解量的计算误差在±2.5%,降解率的计算误差为±2.0%,说明回归公式的准确度较高,可以用于微波/过氧化氢辐射下甲基红水溶液降解过程中降解量和降解率的预测。
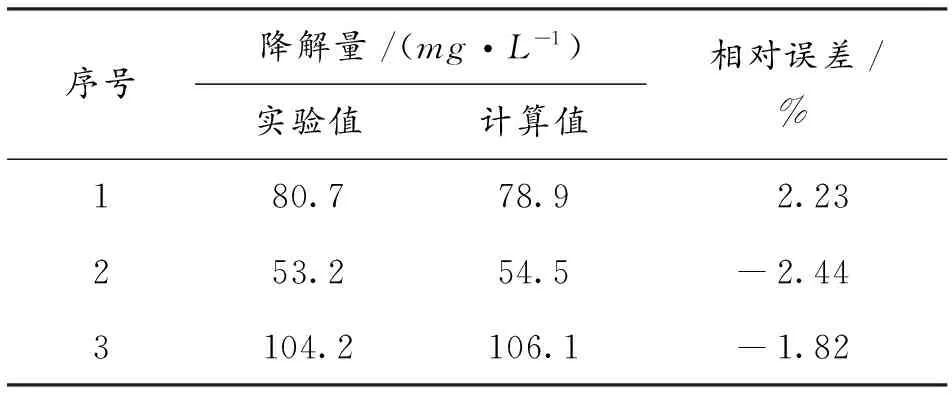
表1 降解量实验值与计算值的比较Table 1 Comparison of mathematical and experimental degradation amount
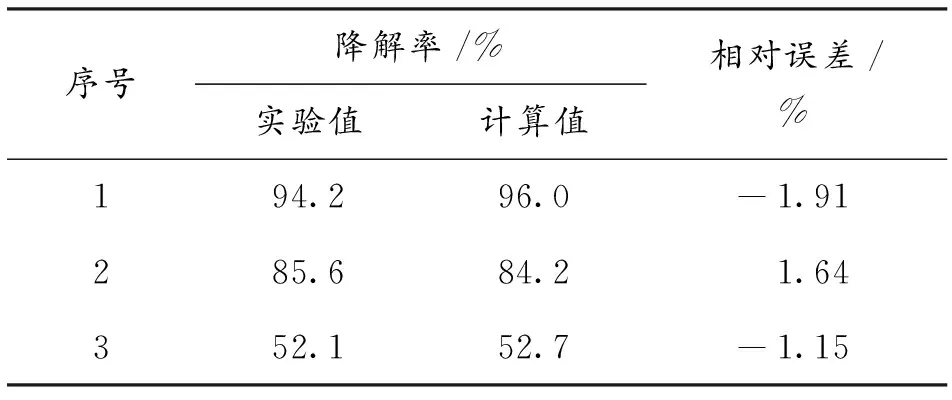
表2 降解率实验值与计算值的比较Table 2 Comparison of mathematical and experimental degradation rate
2.2 各参数对甲基红降解的影响
2.2.1 甲基红初始质量浓度的影响 根据多元非线性回归所获得的公式,在pH=10、H2O2加入体积分数为1.0%,反应温度473 K、反应时间为12 min的条件下,考察甲基红初始质量浓度对降解率及降解量的影响,结果见图1。由图1可知,随着甲基红初始质量浓度的增加,微波消解后水中甲基红含量也相应增加,即降解率减小;但甲基红的降解量是随着初始质量浓度的增加而增加。表明反应后水中剩余甲基红含量与其初始质量浓度有很大的相关性。如需要控制反应降解后甲基红含量相对稳定或呈恒定值,则反应温度、反应时间、H2O2加入量、pH等条件需相应调整。
为评价在甲基红不同初始质量浓度下,微波消解后使水中甲基红剩余浓度保持定值的难易程度,引用苛刻度的概念,以氧化条件苛刻度Z值来表征其对降解量的影响,Z值与反应温度、时间、溶液pH、H2O2加入量有关,即Z=f[T,t,pH,φ(H2O2)]。甲基红初始质量浓度对氧化苛刻度Z值的影响见图2。随着水中甲基红初始质量浓度的增加,即控制微波降解后甲基红含量相对稳定时,降解氧化条件的苛刻度Z值相应增加,并且控制微波降解后水中甲基红剩余质量浓度越低,则氧化苛刻度Z值越高,表明控制条件的难度越大。
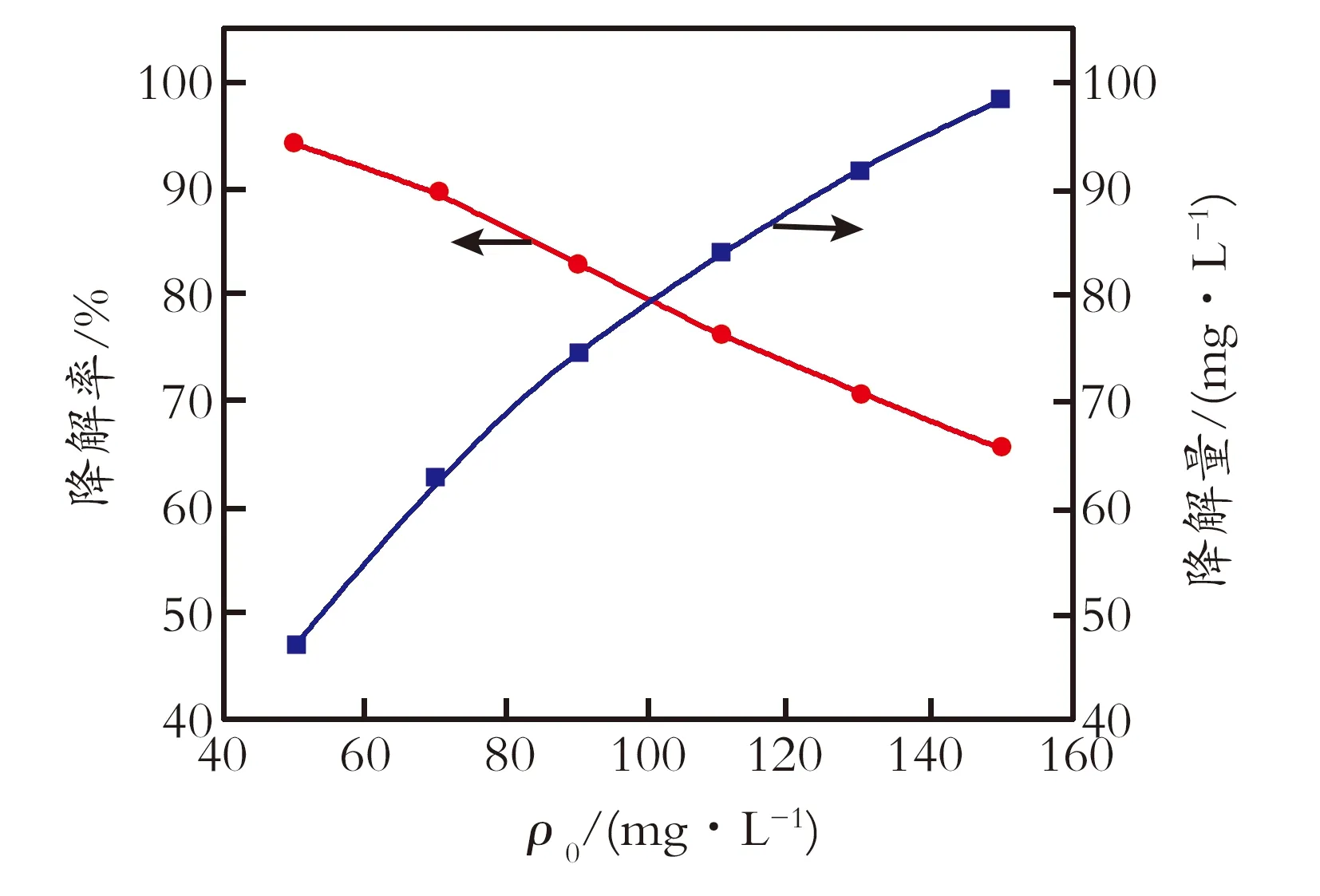
图1 甲基红初始质量浓度对降解率及降解量的影响
Fig.1Influenceofinitialmassconcentrationofmethylred
tothedegradationamount/rate
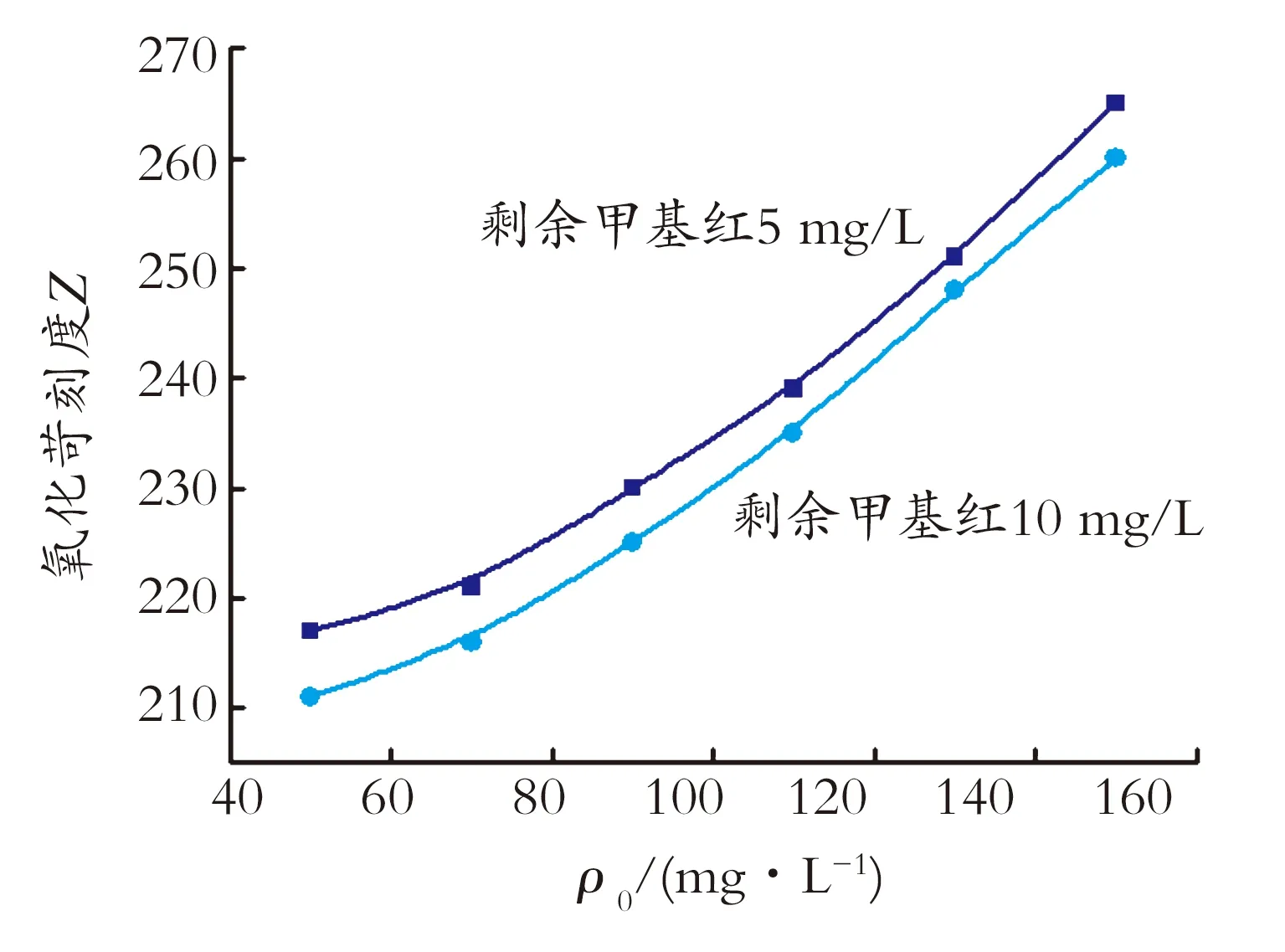
图2 甲基红初始质量浓度与氧化苛刻度的关系
Fig.2Relationshipofinitialmassconcentrationofmethyl
redandoxidationseverity
2.2.2 pH的影响 在H2O2加入体积分数为1.0%、甲基红初始质量浓度为130 mg/L,反应温度473 K、反应时间为12 min的条件下,考察溶液pH对甲基红降解率、降解量的影响,结果见图3。由图3可知,降解率和降解量随着pH的增加而提高,表明在碱性条件下更有利于甲基红的降解。Zhou Minghua等[14]在采用电-芬顿化学法降解甲基红时发现在pH=3的条件下,甲基红降解率最高,而Zaki Ajji[15]采用伽马射线辐射甲基红水溶液使其降解的研究表明在酸性和碱性条件下,甲基红均能发生降解,并且碱性条件下的降解与辐照强度指数相关,酸性条件下的降解与辐照强度线性相关。Hong Jun等[16]研究发现罗丹明B染料在碱性条件下更有利于降解。本实验得出在碱性条件下有利于甲基红降解的结论与黄卫红等[17]的研究结论一致。这是因为在碱性环境下,甲基红中—COOH会形成—COO-,而增加甲基红在水中的溶解度;并且在碱性条件下,溶解的偶氮体会较多地转化为醌腙体,在OH自由基及高温环境下,醌腙体的亚胺基极易被氧化并与苯环断裂可加快甲基红的降解。
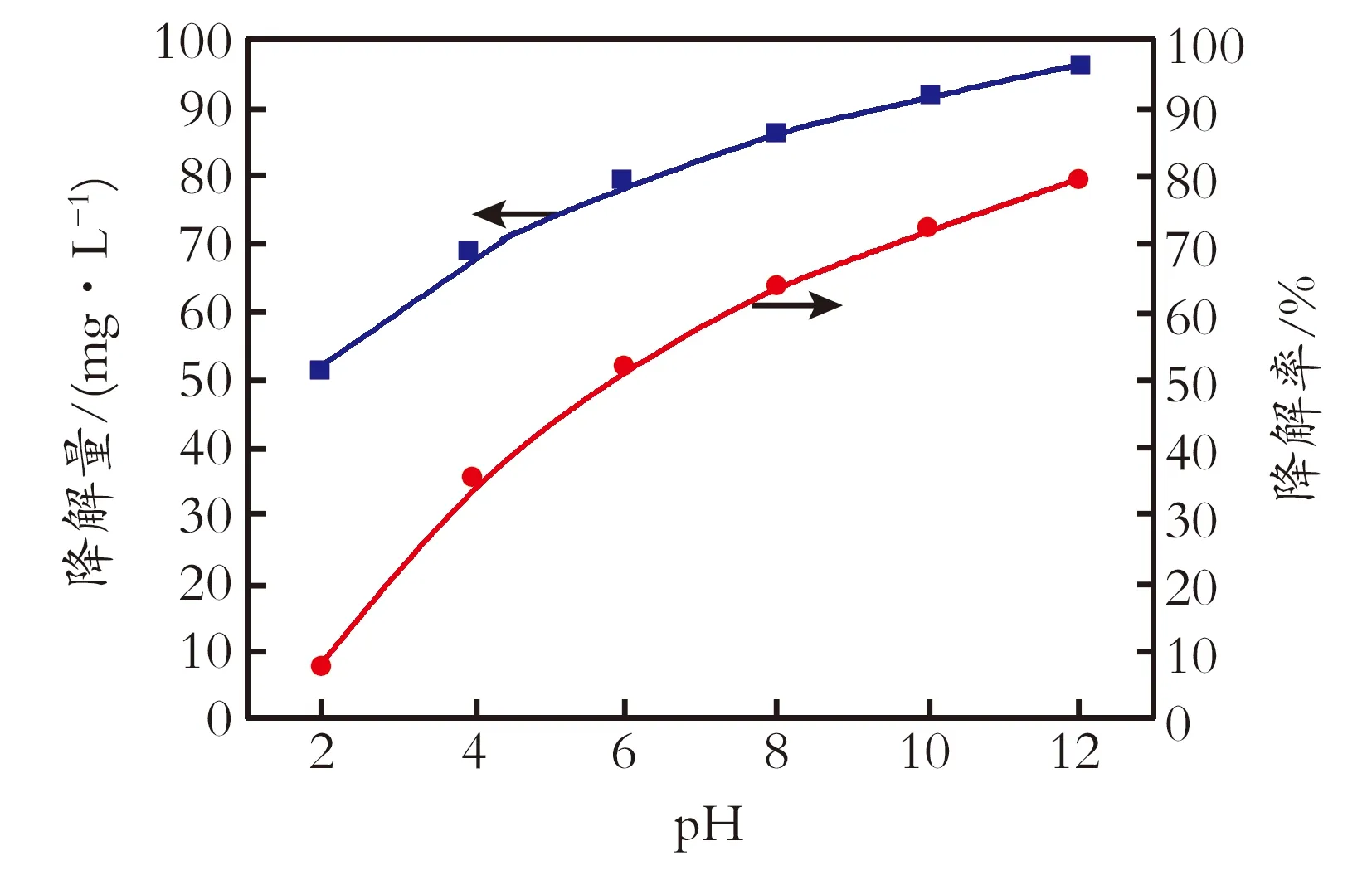
图3 pH对降解率和降解量的影响
Fig3InfluenceofpHtothedegradationamount/rate
2.2.3 H2O2加入量的影响 在pH=10、甲基红初始质量浓度为130 mg/L,反应温度473 K、反应时间为12 min的条件下,考察H2O2加入体积分数对降解率和降解量的影响,结果见图4。由图4可知,当甲基红初始质量浓度一定时,随着H2O2加入体积分数的增加,甲基红的降解率和降解量均相应增加,H2O2加入体积分数为1.6%时,降解量为100 mg/L,而降解率为78%。在这是因为在微波辐照下有机物发生直接热解作用,溶液中H2O2溶液浓度的增大将导致有更多的·OH产生,单位分子获得的·OH浓度相对值提高,有利于甲基红的降解。
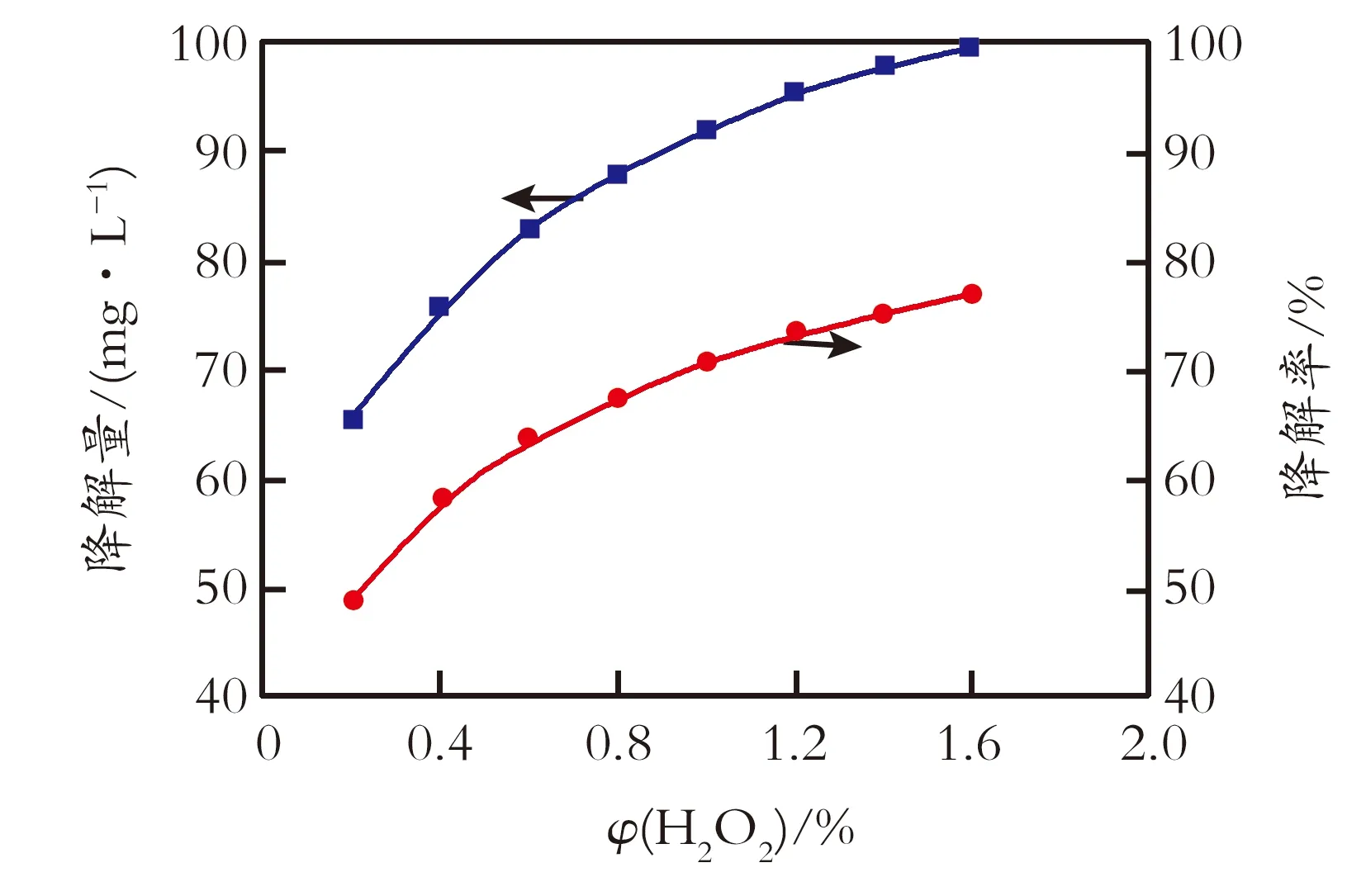
图4 H2O2加入量对降解率和降解量的影响
Fig.4InfluenceofH2O2tothedegradationamount/rate
2.2.4 反应温度的影响 在H2O2加入质量分数为1.0%、甲基红初始质量浓度为130 mg/L,反应时间为12 min、pH=10的条件下,考察反应温度对降解率、降解量的影响,结果见图5,由图5可知,反应温度1/T与降解量均成线性关系,反应级数为一级。采用Fenton体系对甲基红降解进行研究同样发现甲基红的降解为一级反应[18]。本实验反应常数为0.172 4 min-1,相关系数为0.993 1。根据阿仑尼乌斯(Arrhenius)公式以及公式(1)、(2),可以计算出降解量的活化能为126.6 kJ/mol。
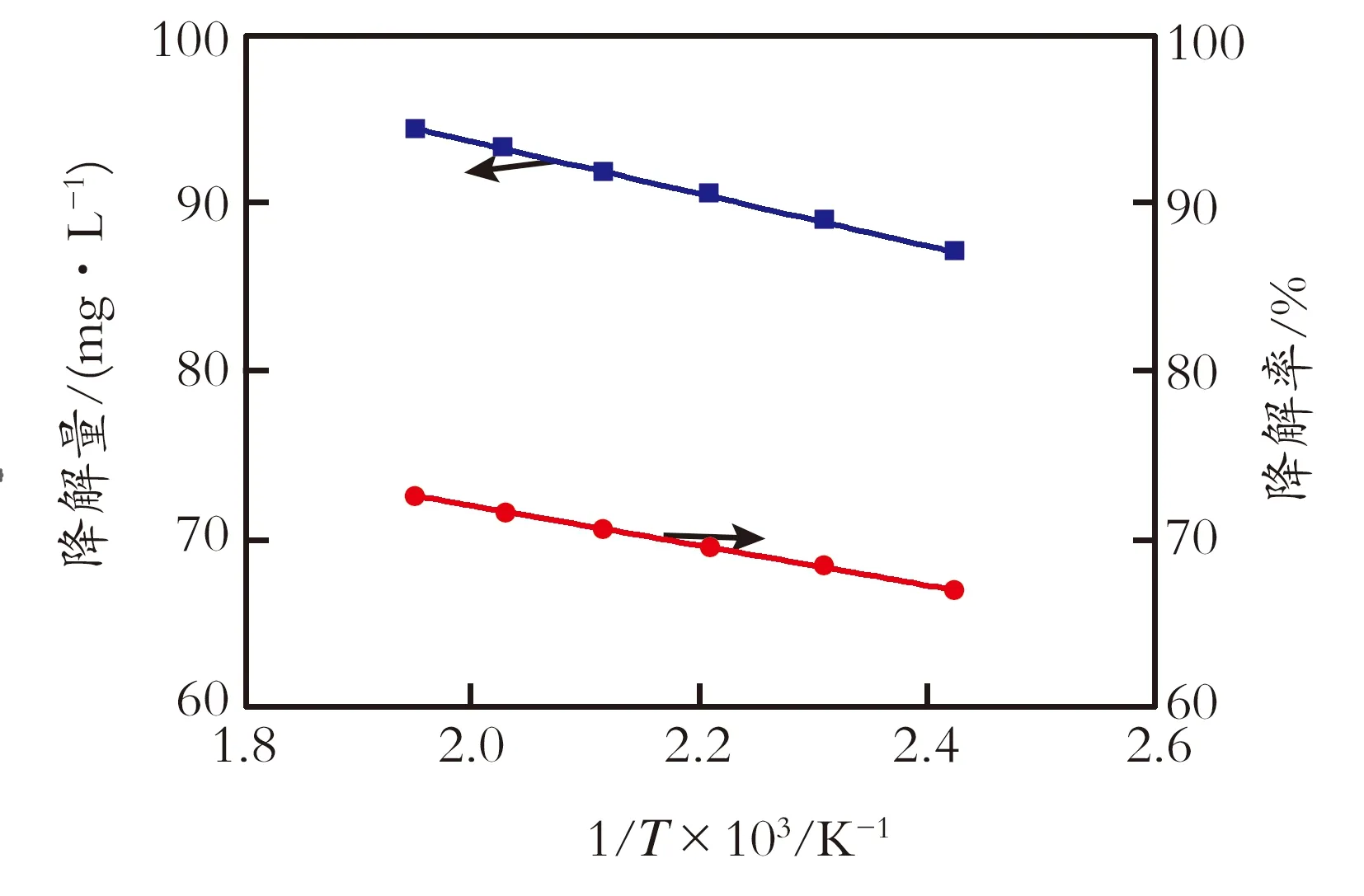
图5 反应温度对降解率和降解量的影响
Fig.5Influenceoftemperaturetothe
degradationamount/rate
2.3 甲基红降解吸收光谱

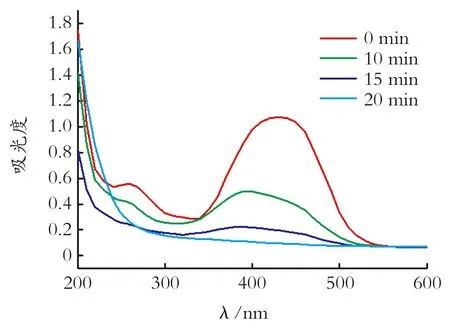
图6 甲基红降解光谱变化
Fig.6Spectrachangesofmethylredindegradationcourse
3 结论
随着甲基红的初始质量浓度的增加,其降解量增加而降解率下降。如要保持甲基红降解后残余质量浓度不变,残余质量浓度越低、初始质量浓度越高,则氧化条件苛刻度Z值越高,控制条件越严格;随着溶液pH的增加,甲基红降解量和降解率增加,碱性条件有利于甲基红的降解;增加H2O2加入量同样可以增加甲基红的降解量和降解率;甲基红降解为一级反应,反应常数为0.172 4 min-1,降解量的活化能126.6 kJ/mol。
[1]Hankare P P,Patil R P,Jadhav A V ,et al.Enhanced photocatalytic degradation of methyl red and thymol blue using titania-alumina-zinc ferrite nanocomposite[J].Applied Catalysis B:Environmental,2011,107:333-339.
[2]Ne′stor Javier Bejarano-Pe′rez,Marco Fidel Sua′rez-Herrera.Sonophotocatalytic degradation of congo red and methyl orange in the presence of TiO2as a catalyst[J].Ultrasonics Sonochemistry,2007,14:589-595.
[3]Zhou Minghua,Yu Qinghong,Lei Lecheng,et al.Electro-Fenton method for the removal of methyl red in an efficient electrochemical system[J].Separation and Purification Technology, 2007,57:380-387.
[4]Tavares M G,da SilvaLozele V A,Sales Solano A M,et al.Electrochemical oxidation of methyl red using Ti/Ru0.3Ti0.7O2and Ti/Pt anodes[J].Chemical Engineering Journal,2012(204-206):141-150.
[5]Remya N,Jih-Gaw Lin.Current status of microwave application in wastewater treatment-A review[J].Chemical Engineering Journal,2011,166:797-813.
[6]黄卫红,阮介兵,陈义群,等.微波辅助芬顿试剂降解联苯胺废水的研究[J].环境科学与技术,2009,32(8):130-133.Huang Weihong,Ruan Jiebing,Chen Yiqun,et al.Synergetic degradation of benzidine wastewater by microwave/Fenton reagent[J].Environmental Science & Technology,2009,32(8):130-133.
[7]Zhang Lei, Guo Xingjia, Yan Fei, et al.Study of the degradation behaviour of dimethoate under microwave irradiation[J].Journal of Hazardous Materials,2007,149:675-679.
[8]Lai T L,Yong K F,Yu J W,et al.High efficiency degradation of 4-nitrophenol by microwave-enhanced catalytic method[J].Journal of Hazardous Materials,2011,185:366-372.
[9]李莉,张秀芬,马禹,等.微波增强TiO2光催化降解染料和水杨酸[J].化工学报,2008,59(12):3067-3072.Li Li,Zhang Xiufen,Ma Yu,et al.Photodegradation of dyes and salicylic acid with microwave-enhanced TiO2catalyst[J].Journal of Chemical Industry and Engineering (China),2008,59(12):3067-3072.
[10]张朝红,沈曼莉,王冬梅,等.碳酸钠溶液改性活性炭催化微波照射降解结晶紫[J].中国给水排水,2008,24(23):80-84. Zhang Zhaohong,Shen Manli,Wang Dongmei, et al.Degradation of crystal violet by modified activated carbon with sodium carbonate solution under microwave irradiation[J].China Water & Wastewater, 2008,24(23):80-84.
[11]Zhang Zhaohong,Xu Yao,Ma Xiping,et al.Microwave degradation of methyl orange dye in aqueous solution in the presence of nano-TiO2-supported activated carbon (supported-TiO2/AC/MW)[J].Journal of Hazardous Materials,2012(209-210):271-277.
[12]Ju Y M,Yang S G,Dinga Y C,et al.Microwave-enhanced H2O2-based process for treating aqueous malachite green solutions:Intermediates and degradation mechanism[J].Journal of Hazardous Materials, 2009,171:123-132.
[13]戴巍,戴竹青.微波/过氧化氢降解水中苯酚[J].化学工业与工程,2011,28(6):39-42.Dai Wei,Dai Zhuqing.Degradation of phenol in water by microwave radiation and hydrogen peroxide[J].Chemical Industry and Engineering,2011,28(6):39-42.
[14]Zhou M H,Yu Q H,Le L C,et al.Electro-Fenton method for the removal of methyl red in an efficient electrochemical system[J].Separation and Purification Technology,2007,57:380-387.
[15]Ajji Z.Usability of aqueous solutions of methyl red as high-dose dosimeter for gamma radiation[J].Radiation Measurements,2006,41:438-442.
[16]Hong J,Yuan N,Wang Y X,et al.Efficient degradation of Rhodamine B in microwave-H2O2system at alkaline pH[J].Chemical Engineering Journal,2012,191:364-368.
[17]黄卫红,陈义群,阮介兵,等.微波/活性炭/双氧水协同降解甲基红废水的研究[J].环境工程学报,2008,2(12):1655-1658. Huang Weihong,Chen Yiqun,Ruan Jiebing,et al.Study on synergetic degradation of methyl red wastewater by microwave/active carbon/H2O2[J].Chinese Journal of Environmental Engineering, 2008,2(12):1655-1658.
[18]Ashraf S S,Rauf M A,Alhadrami S.Degradation of methyl red using Fenton’s reagent and the effect of various salts[J].Dyes and Pigments,2006,69:74-78.
[19]张小弟,李伟善,黄启明,等.Pt/Ti电极的制备及其对甲基红的催化氧化[J].材料研究与应用,2008,2(4):508-510.Zhang Xiaodi,Li Weishan,Huang Qimin,et al.Preparation of Pt/Ti electrode and its catalytic oxidation for mehtyl red[J].Materials Research and Application, 2008,2(4):508-510.
(编辑 闫玉玲)
Degradation of Methyl Red in Water by Microwave Radiation and Hydrogen Peroxide
Dai Zhuqing1,Wang Mihua1,Jia Renren2,Zhou Pan1
(1.SchoolofEnvironmental&SafetyEngineeringofChangzhouUniversity,ChangzhouJiangsu213164,China;2.ChinaNationalPetroleumCo.,FushunPetrochemicalCompany,FushunLiaoning113001,China)
The synergy effect of microwave/peroxide degradation to the methyl red in water was investigated.The initial concentration of substate, pH, the amount of hydrogen peroxide, reaction time, and temperature were examined respectively, and a mathematical model was established in order to study the degradation of methyl red.The results showed that the degradation was enhanced under alkaline conditions and a longer reaction time.If low residual concentration was demanded with high initial concentration, a high valueZ, the oxidation severity was required.The degradation of methyl red is a first order reaction, of which the reaction rate constant is 0.172 4 min-1and the activation energy is 126.6 kJ/mol.The degradation rate can be as high as 78% in following conditions:initial mass concentration 130 mg/L, volume fraction of hydrogen peroxide 1.6%, reaction at 473 K for 12 min, pH=10.
Methyl Red;Microwave;Peroxide;Degradation
1006-396X(2014)06-0011-05
2014-05-08
:2014-10-23
江苏省科技攻关项目“印染废水提标与回用技术开发”(BY2012100)。
戴竹青(1962-),女,硕士,高级工程师,从事环境监测及水处理技术的研究;E-mail:daizhq@163.com。
TE991; X52
: A
10.3969/j.issn.1006-396X.2014.06.003

