葛根芩连汤对2型糖尿病模型大鼠作用的研究
武志黔 郝改梅 薛晓兴 何洁 吴晏 韩静 王伟
·论著·
葛根芩连汤对2型糖尿病模型大鼠作用的研究
武志黔 郝改梅 薛晓兴 何洁 吴晏 韩静 王伟
目的探索葛根芩连汤单药及联合西格列汀对2型糖尿病模型大鼠血糖值、胰岛素耐量、葡萄糖耐量的作用,从而初步揭示葛根芩连汤治疗2型糖尿病的生物学机制。方法采用高脂饲料喂养合并链脲佐菌素(streptozotocin,STZ)诱导建立2型糖尿病模型大鼠58只,予以无菌水(正常组和模型组)、葛根芩连汤(中药组)、西格列汀(西药组)、葛根芩连汤联合西格列汀(中加西组)给药6周的治疗方案,动态监测各组模型动物体重、空腹血糖(fasting blood glucose, FBG),以及给药前、给药后3周、给药后6周的胰岛素耐量试验和葡萄糖耐量试验。结果给药6周后,与模型组相比,中药组FBG降低(P<0.05),葡萄糖耐量改善(P<0.05);西药组体重降低改善(P<0.05),FBG降低(P<0.05),胰岛素耐量、葡萄糖耐量改善(P<0.05);中加西组体重降低改善(P<0.05),FBG降低明显(P<0.01),胰岛素耐量、葡萄糖耐量均改善明显(P<0.01)。给药各组疗效顺序如下:中加西组>西药组>中药组。结论葛根芩连汤与西格列汀单独使用时,西药组疗效优于中药组,联合使用时其疗效明显优于两药单独使用,表明葛根芩连汤对西格列汀的疗效有一定的辅助作用。
葛根芩连汤; 西格列汀; 2型糖尿病; 胰岛素耐量; 葡萄糖耐量
葛根芩连汤源自《伤寒论》,是中医经典方[1]。随着现代医学发展,此方剂被赋予了新的适应病症,广泛应用于内、外、妇、儿等各科疾病,一直是研究的热点。西格列汀是一种新型二肽基肽酶-4抑制剂药物,是目前最早在中国上市用于治疗2型糖尿病二肽基肽酶-4抑制剂类药物[2]。高脂喂养合并腹腔注射小剂量链脲佐菌素(streptozotocin, STZ)是目前应用较多的建立2型糖尿病大鼠模型的方法[3]。目前以单方葛根芩连汤、单用西格列汀及联合两者治疗该模型研究较少,故本研究旨在系统研究探索葛根芩连汤、西格列汀单用及联合用药对2型糖尿病模型大鼠空腹血糖值、胰岛素耐量、葡萄糖耐量的作用,从而初步揭示葛根芩连汤治疗2型糖尿病的生物学机制及其对西格列汀的辅助作用。
1 材料与方法
1.1 实验动物
SPF级SD雄性大鼠70只,体重(140±10)g,购自北京维通利华,生产许可证:SCXK(京)2010-0008。饲养于北京中医药大学科研中心动物室,环境温度为20~25℃,12/12小时昼夜规律喂养。
1.2 2型糖尿病大鼠模型建立
适应性喂养一周后,根据体重随机分组,分出正常组10只和高脂组60只,正常组予以普通饲料,高脂组予以高脂饲料,猪油、蛋黄粉、大豆油、奶粉、蔗糖、多维预混料、多矿预混料、胆酸钠等,由北京华阜康生物科技股份有限公司生产,生产许可证号为SCXK(京)2009-0008,5周后予以腹腔注射STZ 30 mg/kg造模,一周后检测空腹血糖,若血糖值≥11.1 mmol/L即造模成功[4-5],血糖值<11.1 mmol/L者,按照原剂量再腹腔注射1次STZ,得模型大鼠48只。
1.3 分组
模型建立后,根据血糖值和体重对模型大鼠进行随机分组,分为模型组(12只)、西药组(12只)、中药组(12只)、中加西组(12只),分组原则为组间血糖值、体重均无统计学差异(P<0.05)。正常组、模型组予以水,西药组按10 mg/kg予以西格列汀,中药组按9.1 g/kg生药量予以葛根芩连汤汤剂,中加西组为予西药一小时后予中药,均为灌胃给药,给药共6周,给药期间各组大鼠无死亡。
1.4 试剂及仪器
主要试剂:STZ由北京创信生物公司分装(批号:sigmaS0130);葡萄糖由北京普博欣生物科技有限责任公司生产(批号:PB11130-3);氯化钠注射液由石家庄四药有限公司生产(批号121225402);胰岛素注射液由江苏万邦生化医药股份有限公司生产(批号1211216,注射器批号1196207)。仪器:血糖仪与试纸为雅培糖尿病护理有限公司生产的Optium Xceed“安妥超越”血糖仪和其配套Optium血糖试纸。
1.5 药品
葛根(批号:201002734)、黄芩(批号:201003742)、黄连(批号:201002358)、甘草(批号:201133681)由北京同仁堂(亳州)饮片有限责任公司提供;磷酸西格列汀片(批号:T2669)由默沙东生产,规格100 mg(以西格列汀计),14片装,30℃以下保存。
1.6 葛根芩连汤制备
将葛根、黄芩、黄连、炙甘草按照5∶3∶3∶2的比例进行传统方法水煎提取。加10倍量的水,浸泡30分钟,先煎葛根20分钟,再和余药共煎30分钟,纱布粗滤取滤液;残渣加10倍量的水煎煮30分钟,趁热滤过;合并两次滤液,分别通过减压旋转蒸发仪回收溶剂制成浓缩液,在水浴锅上蒸发水分制成流浸膏。
1.7 胰岛素耐量试验
大鼠非夜禁食4小时后,测定0点血糖值并立即腹腔注射0.75 IU/kg胰岛素,30分钟、60分钟、120分钟分别测定血糖值,并按相邻时间点值和的1/2乘以相邻时间的间隔为相邻时间的曲线下面积计算血糖下降曲线下面积(area under the curve, AUC)值(以0点值为1,其他时间点血糖值与0点血糖值得比值为各时间点值,其曲线下面积为血糖下降AUC)。分别于给药前、给药后3周、给药后6周进行测定。
1.8 葡萄糖耐量试验
大鼠隔夜禁食12小时后,测定0点血糖值并立即灌胃2 g/kg葡萄糖,30分钟、60分钟、120分钟分别测定血糖值,并计算血糖变化AUC值。分别于给药前、给药后3周、给药后6周进行测定。
1.9 血糖值与体重测定
给药前及给药后每周对大鼠空腹血糖值(fasting blood glucose, FBG)、体重进行测定。
1.10 统计学方法
2 结果
2.1 体重
给药前,模型组大鼠体重与给药各组均无显著性差异,模型组、给药各组大鼠体重均低于正常组,P<0.05;给药后,正常组大鼠体重稳定增加,模型组大鼠体重降低,西药组大鼠体重缓慢增加,中药组体重略有降低,中加西组体重稳定增加。
给药6周后,各组体重值有所变化,数据呈正态分布,相互独立,且方差齐,见表1。5组体重值经方差分析,F=4.99,P=0.005<0.05,差异有统计学意义。西药组和模型组用LSD-t两两比较,P=0.0295<0.05,差异有统计学意义;中加西组和模型组比较,P=0.0314<0.05,差异有统计学意义;中药组和模型组相比,差异无统计学意义,P>0.05。认为葛根芩连汤、西格列汀均有改善2型糖尿病大鼠体重的作用,两者联用效果优于单药效果。
表1 各组大鼠体重变化
2.2 FBG
给药前,模型组大鼠FBG与给药各组均无显著性差异,模型组、给药各组大鼠FBG高于正常组(P<0.05);给药后,西药组大鼠第4~6周FBG低于模型组(P<0.05),中药组大鼠FBG低于模型组但差异无统计学意义(P>0.05),中加西组大鼠给药后第2~6周FBG明显低于模型组(P<0.05)。
给药6周后,各组FBG值有所变化,数据呈正态分布,相互独立,且方差齐,见表2。5组FBG值经方差分析,F=101.52,P=0.000<0.05,差异有统计学意义。西药组和模型组用LSD-t两两比较,P=0.0466<0.05,差异有统计学意义;中药组和模型组相比,P=0.0135<0.05;中加西组和模型组比较,P=0.000<0.01,差异有统计学意义。认为葛根芩连汤、西格列汀均有降低2型糖尿病大鼠FBG的作用,且西格列汀降糖效果优于葛根芩连汤,两者联用效果优于单药效果。
表2 给药各组大鼠FBG变化
2.3 胰岛素耐量试验
给药前,与正常组相比,模型组和给药各组予以胰岛素后其血糖下降速率低,血糖下降AUC值高(P<0.01);与模型组相比,给药各组血糖下降速率与血糖下降AUC均无统计学差异(P>0.05),见表3。
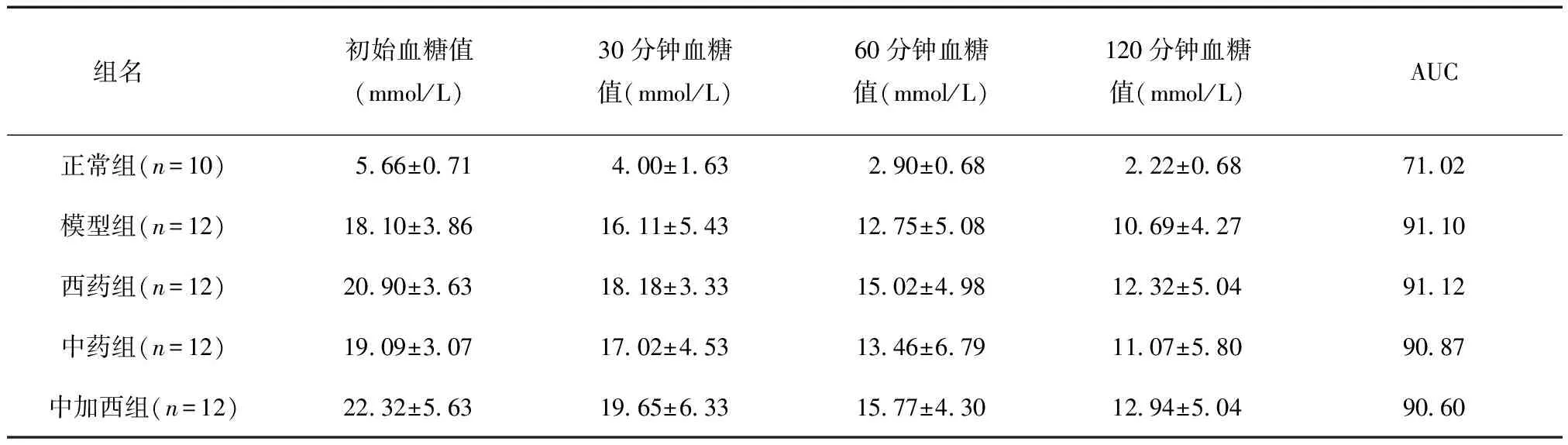
表3 给药前给药各组胰岛素耐量试验结果
给药后3周,与正常组相比,模型组、中药组予以胰岛素后其血糖下降速率低,血糖下降AUC高(P<0.01),西药组血糖下降速率较高,血糖下降AUC较低(P<0.05),中加西组血糖下降速率较高,但血糖下降AUC无统计学差异(P>0.05);与模型组相比,中药组血糖下降速率较高,但血糖下降AUC差异无统计学意义(P>0.05),西药组、中加西组血糖下降速率较高,血糖下降AUC值较低(P<0.05),见表4。
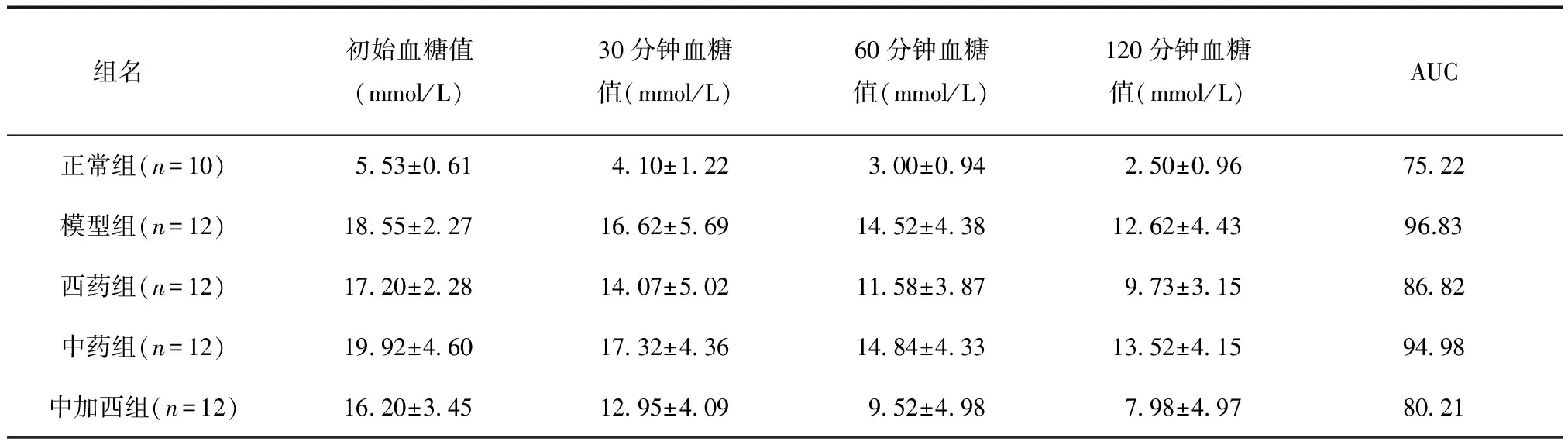
表4 给药后3周给药各组胰岛素耐量试验结果
给药后6周,各组血糖下降AUC值有所变化,数据呈正态分布,相互独立,且方差齐,见表5。5组AUC值经方差分析,F=60.481,P=0.000<0.05,差异有统计学意义。与正常组相比,模型组、中药组予以胰岛素后其血糖下降速率低,血糖下降AUC高(P<0.01),西药组血糖下降速率较高,血糖下降AUC较低(P<0.05),中加西组血糖下降速率较高,但血糖下降AUC无统计学差异(P>0.05);与模型组相比,中药组下降速率高,但血糖下降AUC差异无统计学意义(P>0.05),西药组下降速率较高,血糖下降AUC降低,用LSD-t两两比较,P=0.0210<0.05,差异有统计学意义,中加西组下降速率高,血糖下降AUC低,用LSD-t两两比较,P=0.000<0.01,差异有统计学意义。认为西格列汀可改善2型糖尿病大鼠的胰岛素耐量,与葛根芩连汤联合使用,效果更优。
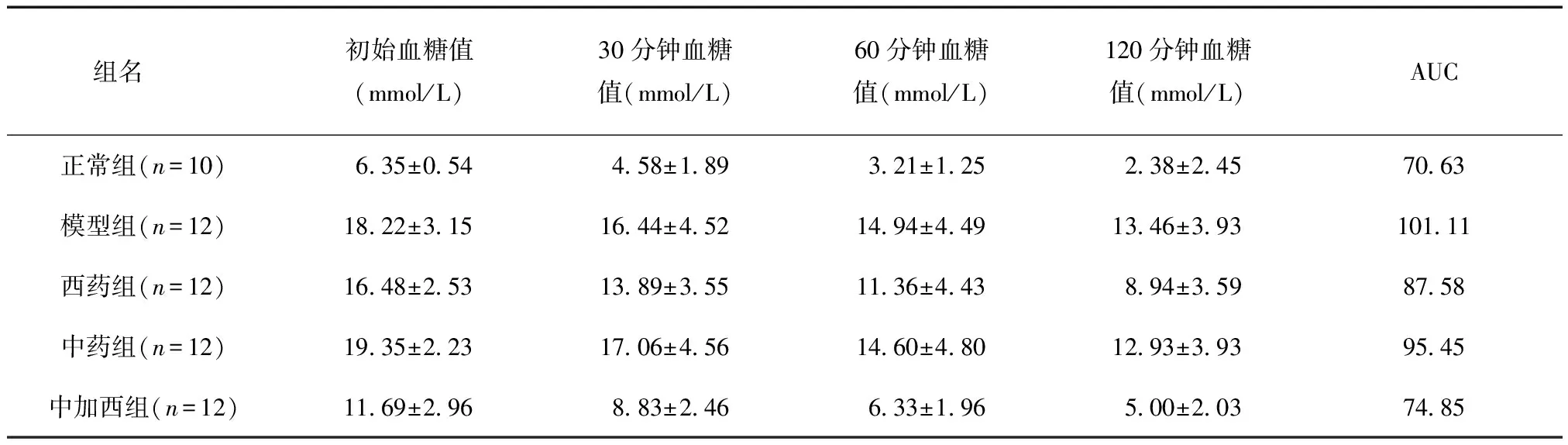
表5 给药后6周给药各组胰岛素耐量试验结果
2.4 葡萄糖耐量试验
给药前,与正常组相比,模型组与给药各组予以葡萄糖后血糖变化AUC均高于正常组AUC(P<0.01);与模型组相比,给药各组血糖变化AUC无统计学差异(P>0.05);见表6。
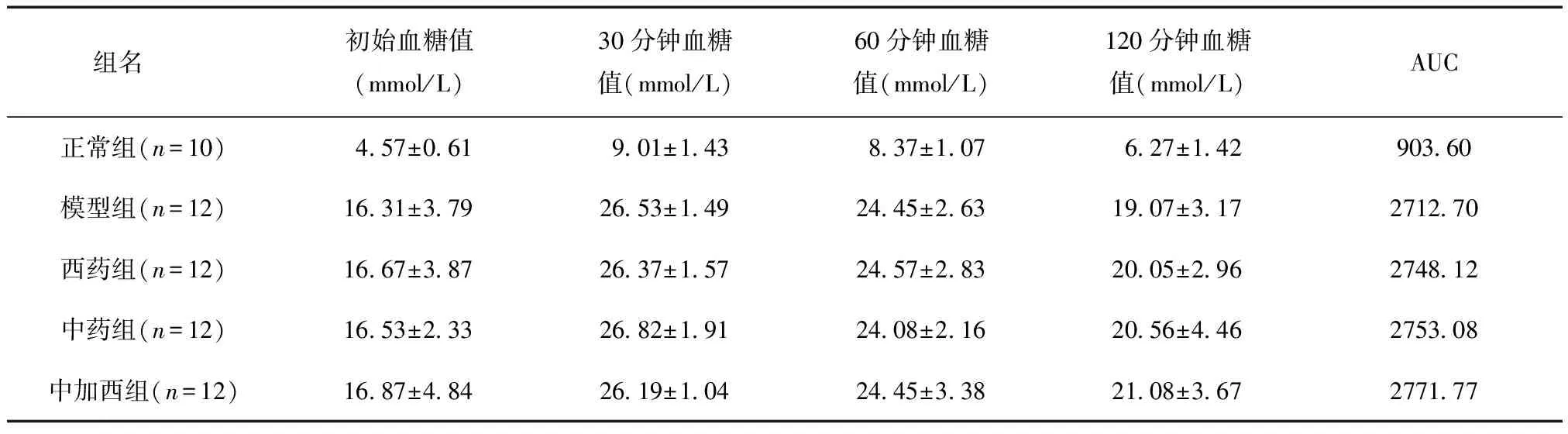
表6 给药前给药各组葡萄糖耐量试验结果
给药后3周,与正常组相比,模型组与给药各组予以葡萄糖后血糖变化AUC均高于正常组AUC(P<0.01);与模型组相比,中药组AUC略低,差异无统计学意义(P>0.05),西药组、中加西组AUC均较低(P<0.05);见表7。
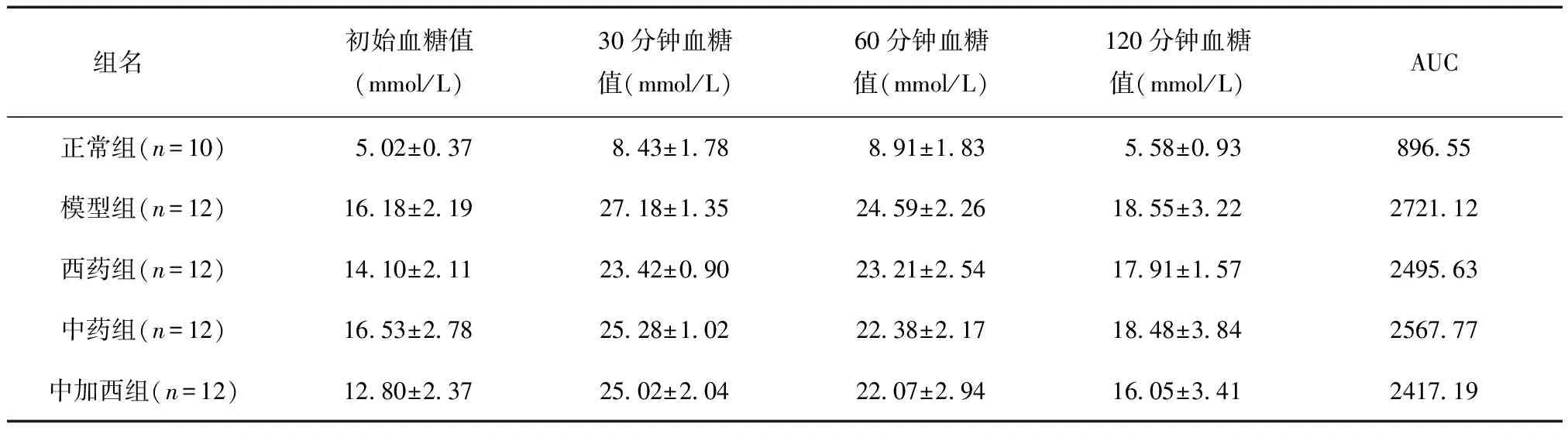
表7 给药后3周给药各组葡萄糖耐量试验结果
给药后6周,各组血糖变化AUC值有所变化,数据呈正态分布,相互独立,且方差齐,见表8。5组AUC值经方差分析,F=18.130,P=0.000<0.05,差异有统计学意义。与正常组相比,模型组、中药组及西药组予以葡萄糖后血糖变化AUC均高于正常组AUC(P<0.01),中加西组AUC较高(P<0.05);与模型组相比,用LSD-t两两比较,中药组AUC略低,P=0.0136<0.05,差异有统计学意义,西药组AUC略低,P=0.0136<0.05,差异有统计学意义,中加西组AUC低,P=0.000<0.01,差异有统计学意义。认为葛根芩连汤、西格列汀均可改善2型糖尿病大鼠的葡萄糖耐量,且两者联合使用效果更优。
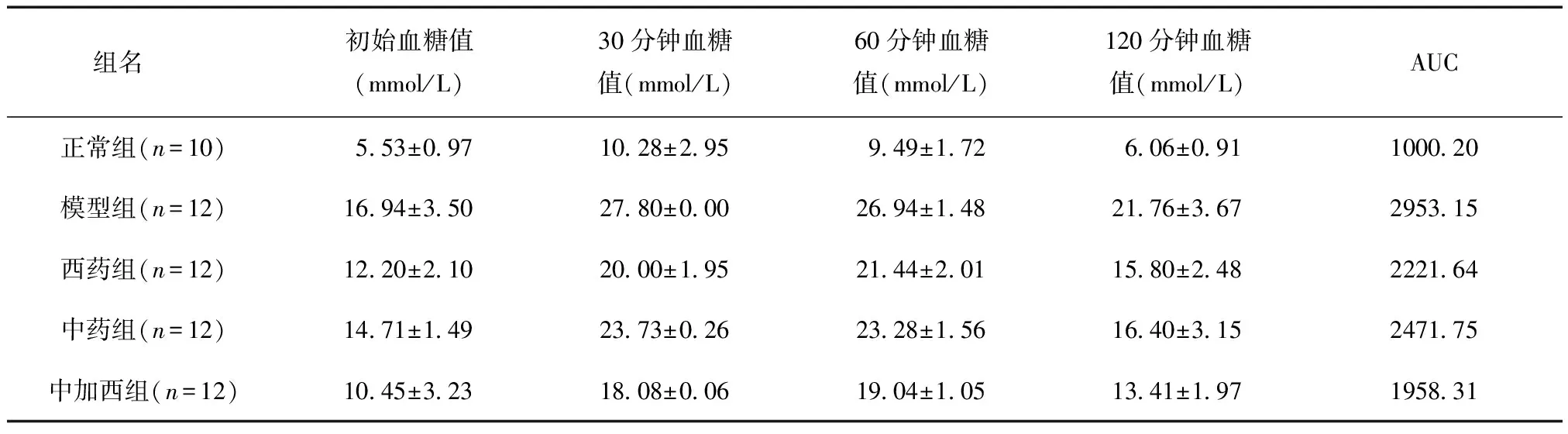
表8 给药后6周给药各组葡萄糖耐量试验结果
3 讨论
部分文献报道葛根芩连汤对于2型糖尿病有降低血糖及抗胰岛素抵抗作用,且其作用机理与西药磺脲类药物和双胍类药物相似[6-9]。西格列汀副作用较少,具有不增加患者体重,也不会使患者发生低血糖和水肿等优点[10],是安全且耐受良好的治疗2型糖尿病的药物。由于单药治疗时间较长,临床上常与磺脲类和胰岛素等药物联合使用[11-12]。
高脂饲料喂养加小剂量STZ注射诱导的2型糖尿病大鼠模型模拟了人类糖尿病的发病进程(包括胰岛素抵抗和胰岛β细胞功能障碍)。与自发性糖尿病鼠相比,动物来源丰富,实验成本低,因此广泛用于2型糖尿病药物的疗效评价[13]。
胰岛素抵抗作为2型糖尿病的一个重要发病机制,与糖尿病脂代谢紊乱、胰岛β细胞损伤、胰岛功能衰竭存在密切关系[14]。改善胰岛素抵抗是治疗和延缓2型糖尿病发生和发展的关键。许多文献报道葛根芩连汤中多种成分对胰岛素抵抗有改善作用[15-16],例如甘草醇提物对啮齿性动物具有降低血糖、减轻体重和降低血压的作用,同时该提取物还能激活过氧化体增殖物激活受体-γ[17-18],而过氧化体增殖物激活受体-γ是血糖和血脂代谢的核心受体[17];黄芪提取物能治疗糖尿病及糖尿病并发症[19],其中黄芪多糖治疗能通过蛋白酪氨酸磷酸酶1B/核转录因子-κB途径活化蛋白激酶B,上调葡萄糖载体4和抑制炎症因子进而增加胰岛素的敏感性改善胰岛素抵抗来调节血糖[20-23];黄连中的小檗碱能降低2型糖尿病大鼠血糖,抑制胰岛素抵抗,刺激胰岛β-细胞再生[24-27]。尽管许多文献证实葛根芩连汤有降糖作用,但本次实验研究中,葛根芩连汤降糖效果仍然不如西药西格列汀。
西格列汀是国内第一个上市的二肽基肽酶-4抑制剂,主要通过抑制胰高血糖素样肽-1的分解升高血液中胰高血糖素样肽-1的浓度而发挥抗糖尿病作用,剂量为1.0 mg/kg时能明显增加胰岛素和胰高血糖素样肽-1的分泌[28]。单药研究[29-30]显示西格列汀能显著改善β细胞的功能和胰岛素的敏感性,总体耐受良好,未发生低血糖事件。常与二甲双胍、胰岛素、磺酰脲类、噻唑烷二酮类联合用药,可增强疗效且不增加低血糖的风险,也不增加患者体质量。但其联合中药复方治疗2型糖尿病的研究较少。
本次实验研究中,葛根芩连汤联合西格列汀能够改善2型糖尿病大鼠体重,调节胰岛素耐量和葡萄糖耐量,进而改善胰岛素抵抗,降低2型糖尿病空腹血糖,其作用效果明显高于两药单独使用。从生物学角度分析,葛根芩连汤根据中药具有多靶点、多途径整合调节的作用特点能增强西格列汀降血糖、改善葡萄糖耐量、改善胰岛素耐量和控制体重,因而起到辅助作用。
实验过程中,中加西组大鼠无不良事件发生,且并发症少见。可见,葛根芩连汤联合西格列汀治疗2型糖尿病的疗效优于两者单独使用,且作用温和,无副作用,但其生物学机制还需要进一步探索。
[1]黄泰康,施诚.中药方剂现代研究大典[M].北京:科学技术出版社,1996.
[2]邢颖,郑策,甄健存.二肽基肽酶DPP-4抑制剂-西格列汀治疗2型糖尿病的安全性国内外文献分析[J].中国医院药学杂志,2012,32(6):480-481.
[3]吴晏,韩静,黄黎明,等.高脂喂养合并小剂量链脲佐菌素建立2型糖尿病大鼠模型[J].中国实验动物学报,2012,20(2):11-15.
[4]张金莲,张忠伟,王颖怡,等.葛根芩连汤对2型糖尿病大鼠肾脏的量效关系研究[J].江西中医学院学报,2012,24(4):61-64.
[5]潘秋,赵慧辉,陈建新,等.2型糖尿病实验大鼠表征及其证候特征研究[J].中华中医药杂志,2011,26(4):683-685.
[6]周艳,谭海荣,潘竞锵,等.葛根芩连汤对2型糖尿病大鼠的降血糖抗氧化作用[J].中国新医学,2003,2(6):17-18.
[7]潘竞锵,韩超,刘惠纯,等.葛根芩连汤降血糖作用的实验研究[J].中国新药杂志,2000,9(3):167-170.
[8]李颖萌,范雪梅,王义明,等.葛根芩连汤对2型糖尿病大鼠的治疗作用及其机制探讨[J].药学学报,2013,48(9):1415-1421.
[9]赵林华,姬航宇,冀博文,等.葛根芩连汤治疗糖尿病理论探讨[J].中华中医药杂志,2012,27(2):280-283.
[10]沈春莲,张凌云,陆少锋.西格列汀治疗2型糖尿病的疗效[J].现代医院,2013,13(6):28-29.
[11]王兴民,季海锋,李立伟,等.西格列汀治疗2型糖尿病近期降糖效果的临床观察[J].海峡药学,2012,24(1):93-94.
[12]胡洁,安富荣.西格列汀治疗2型糖尿病的临床研究进展[J].医药导报,2013,32(6):760-764.
[13]Srinivasan K, Viswanad B, Asrat L, et al. Combination of high-fat diet-fed and low-dose streptozotocin-treated rat: a model for type 2 diabetes and pharmacological screening [J].Pharmacol Res, 2005, 52(4): 313-320.
[14]Kahn SE, Hull R, Utzschneider KM. Mechanisms linking obesity to insulin resistance and type 2 diabetes [J]. Nature, 2006, 444(7121): 840-846.
[15]刘志霞.双益降糖方对2型糖尿病大鼠的作用及其机制初探 [D]. 唐山: 河北联合大学, 2011.
[16]王慧莲,王琦,尹春梅.大黄素和小檗碱改善HepG2细胞胰岛素抵抗的机制研究 [J].中国病理生理杂志, 2009, 25: 2044-2046, 2049.
[17]Weidner C, de Groot JC, Prasad A, et al.Amorfrutins are potent antidiabetic dietary natural products[J].Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(19):7257-7262.
[18]Mae T, Kishida H, Nishiyama T, et al. A licorice ethanolic extract with peroxisome proliferator-activated receptor-γ ligand-binding activity affects diabetes in KK-Ay mice, abdominal obesity in diet-induced obese C57BL mice and hypertension in spontaneously hypertensive rats[J].Journal of Nutrition, 2003, 133(11):3369-3377.
[19]Li C, Cao L, Zeng Q. Astragalus prevents diabetic rats from developing cardiomyopathy by downregulating angiotensin II type2 receptors' expression[J]. Journal of Huazhong University of Science and Technology, 2004, 24(4):379-384.
[20]Liu M, Wu K, Mao X, et al.Astragalus polysaccharide improves insulin sensitivity in KKAy mice: regulation of PKB/GLUT4 signaling in skeletal muscle[J]. Journal of Ethnopharmacology, 2010, 127(1):32-37.
[21]Mao XQ, Yu F, Wang N, et al.Hypoglycemic effect of polysaccharide enriched extract of Astragalus membranaceus in diet induced insulin resistant C57BL/6J mice and its potential mechanism[J]. Phytomedicine, 2009, 16(5): 416-425.
[22]Zhao M, Zhang ZF, Ding Y, et al.Astragalus polysaccharide improves palmitate-induced insulin resistance by inhibiting PTP1B and NF.kappaB in C2C12 myotubes[J].Molecules, 2012, 17(6): 7083-7092.
[23]Wu Y, Ou-Yang JP, Wu K, et al. Hypoglycemic effect of Astragalus polysaccharide and its effect on PTP1B[J]. Acta Pharmacologica Sinica, 2005, 26(3): 345-352.
[24]Chen C, Zhang Y, Huang C. Berberine inhibits PTP1B activity and mimics insulin action[J].Biochemical and Biophysical Research Communications, 2010, 397(3): 543-547.
[25]Jeong HW, Hsu KC, Lee JW, et al.Berberine suppresses proinflammatory responses through AMPK activation in macrophages[J].American Journal of Physiology, 2009, 296(4): E955-E964.
[26]Kim WS, Lee YS, Cha SH, et al.Berberine improves lipid dysregulation in obesity by controlling central and peripheral AMPK activity[J].American Journal of Physiology, 2009, 296(4): E812-E819.
[27]Lee YS, Kim WS, Kim KH, et al.Berberine, a natural plant product, activates AMP-activated protein kinase with beneficial metabolic effects in diabetic and insulin-resistant states[J].Diabetes, 2006, 55(8): 2256-2264.
[28]侯君,李聃丹,王维维,等.二肽基肽酶Ⅳ抑制剂在Ⅱ型糖尿病大鼠中的降糖作用的比较[J].华西药学杂志,2013,28(4):360-363.
[29]Mohan V, Yang W, Son HY, et al. Efficacy and safety of sitagliptin in the treatment of patients with type 2 diabetes in China, India, and Korea[J].Diabetes Res Clin Pract, 2009, 83(1): 106-161.
[30]Aschner P, Kipnes MS, Lunceford JK, et al. Effect of the dipeptidyl peptidase-4 inhibitor sitagliptin as monotherapy on glycemic control in patients with type 2 diabetes[J].Diabetes Care, 2006, 29(12): 2632-2637.
(本文编辑:黄凡)
ResearchontheeffectofGegenqinlianDecoctionontype2diabeticmodel
WUZhi-qian,HAOGai-mei,XUEXiao-xing,etal.
CollegeofBasicMedicine,BeijingUniversityofChineseMedicine,Beijing100102,China
WANGWei,E-mail:wangwei@bucm.edu.cn
ObjectiveTo explore the effect of Gegenqinlian Decoction, sitagliptin monotherapy or combination therapy on the blood glucose, insulin tolerance, glucose tolerance of rat model of type 2 diabetes, and initially reveal the biological mechanisms of treating type 2 diabetes Gegenqinlian Decoction.Methods58 high fat diet combined STZ-induced type 2 diabetic model, be given the treatment with water (normal group and model group), Gegenqinlian Decoction (Chinese medicine group), sitagliptin (western medicine group), sitagliptin Gegenqinlian Decoction joint (combination group), dynamic monitoring model animal body weight, fasting blood glucose (FBG), and the insulin tolerance tests and glucose tolerance tests of predose, after administration of 3 weeks and 6 weeks in each group.ResultsAfter 6 weeks administration, compared with the model group, Chinese medicine group FBG was lower (P<0.05), and has improvement in glucose tolerance (P<0.05); western medicine group improved weight loss (P<0.05), FBG was lower (P<0.05), and has both insulin resistance and impaired glucose tolerance improvement (P<0.05); combination group improved weight loss (P<0.05), FBG was significantly lower (P<0.01), insulin resistance and impaired glucose tolerance were improved significantly (P<0.01). The order of efficacy of each group were as follows: combination group>western medicine group>Chinese medicine group.ConclusionFor the monotherapy of Gegenqinlian Decoction or sitagliptin, western medicine group was more effective than the traditional Chinese medicine group, while its efficacy when used in combination was significantly better than the two drugs used alone, indicating Gegenqinlian may play a supplementary role to the efficacy of sitagliptin.
Gegenqinlian Decoction; Sitagliptin; Type 2 diabetes; Insulin tolerance; Glucose tolerance
国家科技重大专项“重大新药创制”专项(2009ZX09502-018);北京中医药大学创新团队项目(2011-CXTD-06);北京中医药大学在读研究生资助项目(2013-JYBZZ-XS-027)
100102 北京中医药大学基础医学院[武志黔(硕士研究生)、郝改梅(博士研究生)、薛晓兴(硕士研究生)、何洁(硕士研究生)、王伟],科研中心(吴晏、韩静)
武志黔(1988-),2011级在读硕士研究生。研究方向:中医药防治心血管疾病的药理研究。E-mail:flickerstar@yeah.net
王伟(1964-),博士,出站博士后,教授,博士生导师。研究方向:中医药防治心血管疾病的药理研究。E-mail:wangwei@bucm.edu.cn
R255.4
A
10.3969/j.issn.1674-1749.2014.03.001
2013-12-10)

