基于激发荧光断层成像的多肿瘤重建
倪英杰 , 赵建民, 朱信忠,, 张 倩, 安 羽, 徐 含
(1.浙江师范大学 数理与信息工程学院,浙江 金华 321004;2.西安电子科技大学 生命科学与技术学院,陕西 西安 710071;3.北京交通大学 计算机信息技术学院,北京 100044)
0 引 言
分子影像技术是对活体状态下的生物过程进行分子细胞水平的定性定量研究[1].光学分子影像是分子影像的重要组成部分,是基于光传输的成像方式.激发荧光断层成像属于光学分子影像,它是一种三维成像技术,通过获取的生物表面的荧光信号分布并利用光子传播的理论模型,可以对体内的荧光进行精确定位,并能重建出荧光强度分布[2-3].激发荧光断层成像近年来发展迅速,与其他传统活体成像技术比较,具有特异性好、灵敏度高、无放射性污染、结果直观、成像快速及成本低等优点,因此,被视为一种较为理想的小动物活体成像手段,并在生命科学等领域有着越来越广泛的应用[4-6].
不管在发达国家还是发展中国家,癌症一直是导致人类死亡的主要疾病之一.随着医学研究的不断发展,人们对癌症的了解越来越深入,很多不同类型的肿瘤通过早期的检测和及时的治疗都能够治愈,且研究发现原发肿瘤灶常常不止一处.因此,利用激发荧光断层成像早期诊断和定位多肿瘤具有重大意义.但是,传统激发荧光断层成像往往较多应用于数值模拟或活体单肿瘤,多肿瘤的重建得不到实现.
因此,笔者建立了小鼠在体双肿瘤模型,并搭建了FMT/micro-CT成像系统,获取了小鼠的肿瘤荧光信息及CT三维数据,最后利用一种基于有限元迭代收缩重建方法成功重建出小鼠的双肿瘤位置.相对于传统的单光源重建,本文实现了在体双肿瘤的重建,证明了激发荧光断层成像在多肿瘤重建方面的可行性,拓宽了激发荧光断层成像的应用范围.

图1 FMT/micro-CT成像系统
1 方 法
1.1 系统介绍
双肿瘤小鼠实验是基于FMT/micro-CT双模态系统完成的,系统如图1所示.图1中,1~8分别为半导体激光器、CCD探测器、X-ray射线源、X-ray平板探测器、电控旋转台、成像对象、光学镜头及发射滤光片.Micro-CT采集系统和激发荧光采集系统呈90°角垂直放置,其中电控旋转台为公用部分,并且是重合的交点,这样就构成了FMT/micro-CT的双模态系统.将二维荧光信号映射到基于Micro-CT划分的网格上,便建立起重建网格.
Micro-CT系统中包含了X-ray射线源、X-ray平板探测器、电控旋转台,负责获取生物体的解剖结构信息.其中X-ray射线源选用的是牛津仪器公司(Oxford Instruments, USA)的UltraBright型号,其采用金属钨作为阳极材料,焦斑范围为13~14 μm,电压变化范围是20~90 kV,最大输出功率为80 W,最大输出电流为2 mA.X-ray探测器选用的是日本滨松(Hamamatsu)公司的CMOS平板探测器,像素大小为50×50,有效像素尺寸为2 240×2 344.系统中采用NI(National Instruments)公司的采集卡完成X-ray平板探测器与计算机之间的数据转换.CT数据三维重建采用了基于GPU硬件加速的快速锥束重建算法.
光学采集系统包括半导体激光器、CCD探测器、镜头和滤光片,主要负责采集生物体表面逸出的发射荧光信号.其中光学探测器是一个科学级的CCD相机(美国普林斯顿仪器公司(Princeton Instruments) VersArray 1300 B),成像时芯片的制冷温度为-110 ℃,这是因为制冷CCD在450~700 nm波长范围内具有很高的量子转换效率,当CCD芯片温度降到-60 ℃时,暗电流可以忽略不计,因而具有很高的信噪比,从而获得最佳的图像质量.发射滤光片,半峰全宽为10 nm的带通滤光片,它的光学密度值(Optical Density)大于5,有良好的截止性能.激发光源为一个半导体激光器,中心波长为671 nm,激发时输出功率为22 mW,光斑直径为1 mm(用来模拟点状激发光源).此外,激光器的带宽小于0.1 nm,功率稳定性比较好.电控旋转台附带有一个控制驱动电路,主要功能是在采取数据时,确保实验对象在原位不动的情况下,能够360°采集荧光信息和结构信息,便于后期的重建.
1.2 双肿瘤小鼠建模
笔者建模使用的细胞是带有GFP(Green Fluorescent Protein)荧光标记的乳腺癌细胞MDA-MB-231,由协和医院提供,将细胞放入5%二氧化碳和恒温37 ℃的环境中培养.当培育的细胞数量足够多时,将6×106数量级的细胞分别注入小鼠的肝脏和左下肢皮下,5只雌性裸鼠(5~6周,北京大学动物中心)完成建模,并在建模完成4周后进行数据采集实验.
1.3 基于迭代收缩的重建算法
对于激发荧光成像而言,在原理上包含2个相关联的过程,即激发过程和发射过程.激发过程是指利用单色或窄带外源激发光照射成像物体的某些特定点或区域,这部分光通过成像物体表面进入到内部,并在物体内部形成一定的光强分布.发射过程是指成像物体内部的荧光团吸收了一定的激发光光能,并将吸收的能量部分地转化为光子释放出去,释放出去的这部分光叫做发射光(Emission Light),激发过程和发射过程可以用如下2个相耦合的扩散方程来描述[7-8]:
(1)
式(1)中:r∈Ω;Ω代表成像物体所占据的三维空间;下标x和m分别表示激发光和发射光;Φx,m代表光子密度;μax,am为光学吸收系数;Dx,m=1/3[μax,am+(1-g)μax,am]为扩散系数.对于激发过程中外源光的选择并不唯一,在本文的所有实验中,笔者均采用或假设采用单色稳态激光器产生的点状激光作为激发光源.式(1)中:Θδ(r-rl)表示点状激发光源;Θ表示光源的强度;ημaf(r)即是所要求解的未知荧光光源分布.
要解出式(1)比较困难,而研究发现早期阶段的肿瘤区域具有稀疏性,这就意味着荧光团也具有稀疏性,相关研究者已经证明通过加入L1范数能够得到良好的稀疏结果,且加入范数后的式子更容易获得最优值.而本文引用的重建方法是一种迭代收缩重建算法,这种方法的可行性已被验证过,并在国际期刊上发表[9].这种方法的目标是将L1范数约束推广到更一般的Lp范数(1≤p<2),使得重建方法的适用范围更广,然后运用迭代收缩的方法求解最优结果.下面给出加入了一般的Lp正则化约束的FMT重建问题的数学表达式:
(2)
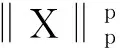
(3)
2 实验和结果
2.1 数据采集流程
1)小鼠腹腔注射150μL乌拉坦;
2)将小鼠放在鼠架上,并将鼠架固定在转台上;
3)采集光学图像,用激光器透射激发小鼠,小鼠内部的GFP荧光染料受到激发后产生发射荧光信号,经体内生物组织后由表面穿出,并通过特定的带通滤光片最终被CCD探测器捕捉.连续采集360°,每幅图旋转22.5°,共采集16幅荧光图像,每幅图像的曝光时间为0.5s,读出模式为2×2binning;
4)小鼠尾静脉注射造影剂碘海醇(1mL/kg),15min后进行Micro-CT扫描.下面需要将采集的光学图像和CT数据进行处理,并最终用于光源重建.
2.2 CT数据分割和网格剖分
小鼠的解剖结构信息通过对CT数据进行分割得到.实验中,CT采集的只是各个方向上的投影数据,而组织分割需要的是重建后的三维数据.因此,在分割之前,需要先进行CT投影数据的三维重建及几何校正等工作.
CT三维数据重建是通过3DMed实现的,3DMed是基于普通微机的三维医学影像处理与分析系统,系统包括数据获取、数据管理、二维读片、距离测量、三维可视化等功能.这些工具在仿真、工程、规划以及教学中的有限元网格方面有着广泛用途.CT三维数据重建结果如图2~图4所示.
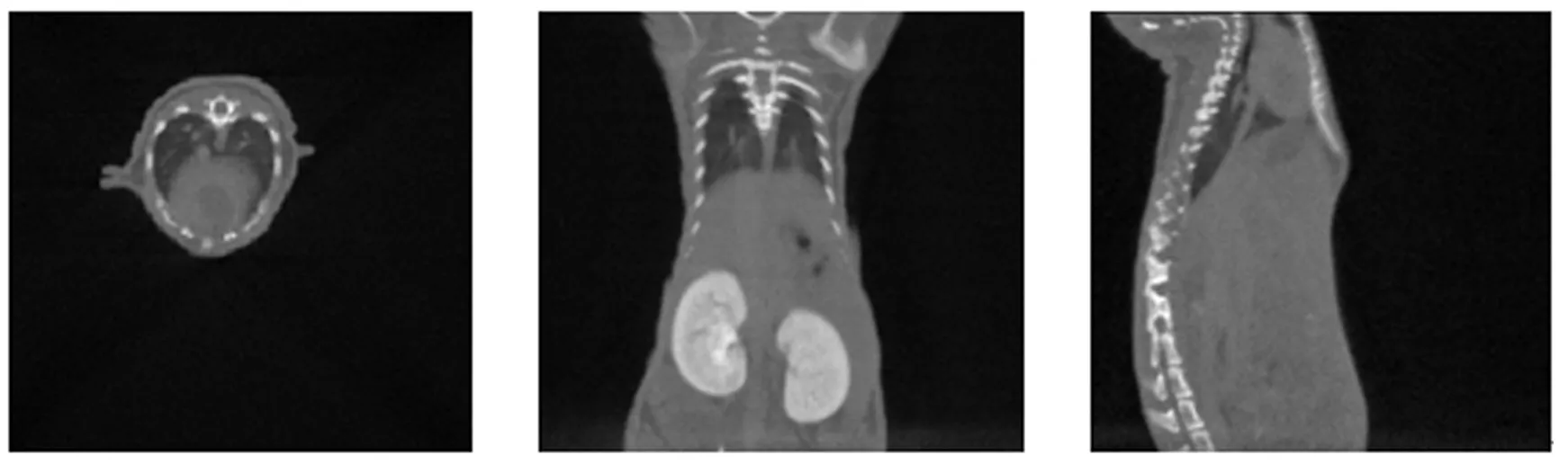
图2 x-y轴CT重建图 图3 y-z轴CT重建图 图4 x-z轴CT重建图
重建后的CT三维数据是RAW格式(一种未经处理的图像格式)的数据,它其实是通过很多张二维的切片叠在一起描述所扫描区域的三维结构.其中的尺寸规格其实就是指x,y,z方向上的切片数量.在图2~图4中,小鼠CT三维数据在3个方向上的切片数量分别是512,512,200.
小鼠的CT三维数据重建后,需要对各个器官进行分割,这里需要分割的器官有5种:肌肉、肺、心脏、肝脏及肾,各个器官的光学特性参数依照参考文献[10]计算.图5~图6为小鼠CT数据分割前后的效果图.
图5 分割前的CT数据图 图6 分割后的CT数据图
2.3 数据配准
配准的过程实际上就是将CCD上的二维荧光数据配准到micro-CT的三维体数据上.因此,首先将小鼠激发荧光图像与白光图像叠加,这里选取2个角度如图7~图8.之后采用最近点原理,对2个网格中表面上距离最近的点做匹配,从而得到重建所用网格表面上所用点的能量密度值.配准前后对比结果如图9~图10所示.
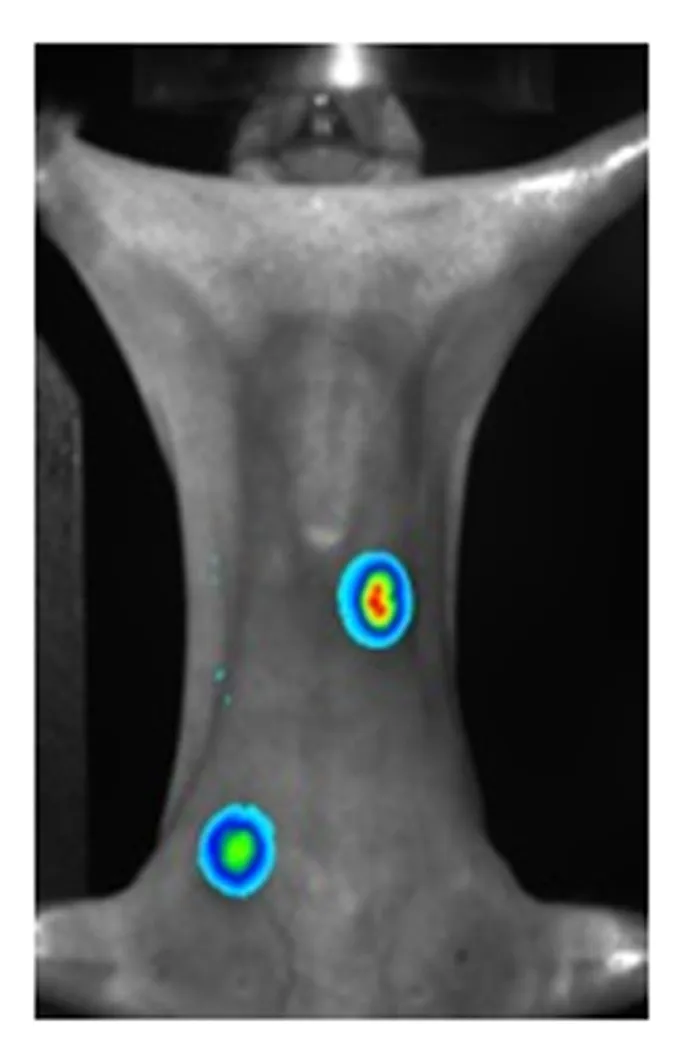
图7 0°叠加效果图 图8 90°叠加效果图
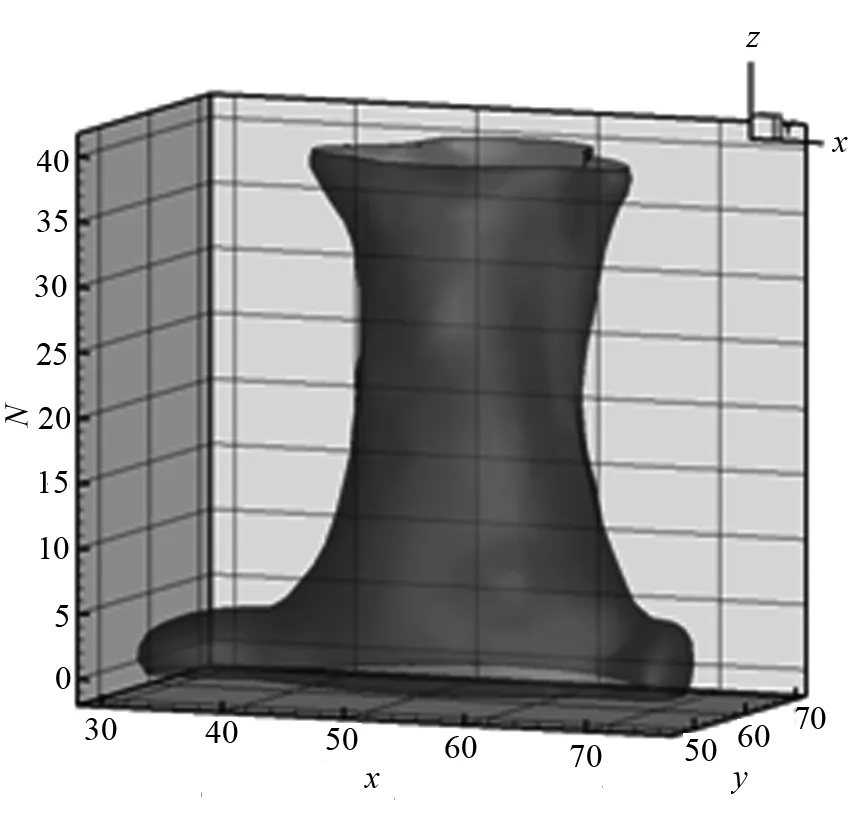
图9 配准前的结果图 图10 配准后的结果图
2.4 重建结果及对比
由于小鼠的骨骼三维几何机构过于复杂,因而,在重建中将小鼠头部和尾部去掉,只选用躯干中间光子出射能量较大的区域用于重建,并且实际上去掉的部分并不是肿瘤所在区域,去掉后进行重建有利于节省资源,提高重建效率.最终重建结果如图11所示.从图11中可以清楚地看出小鼠肝脏和左下肢两处光源被成功重建.为证明本重建结果的优势,将传统单光源重建结果与之相比较,图12所示为小鼠腹腔植入光源的重建结果[11].相对于传统的单光源重建,本实验实现了在体双肿瘤的重建,在实用性方面更具说服力,更重要的是它证明了激发荧光断层成像在多肿瘤重建方面的可行性,拓宽了激发荧光断层成像的应用范围.
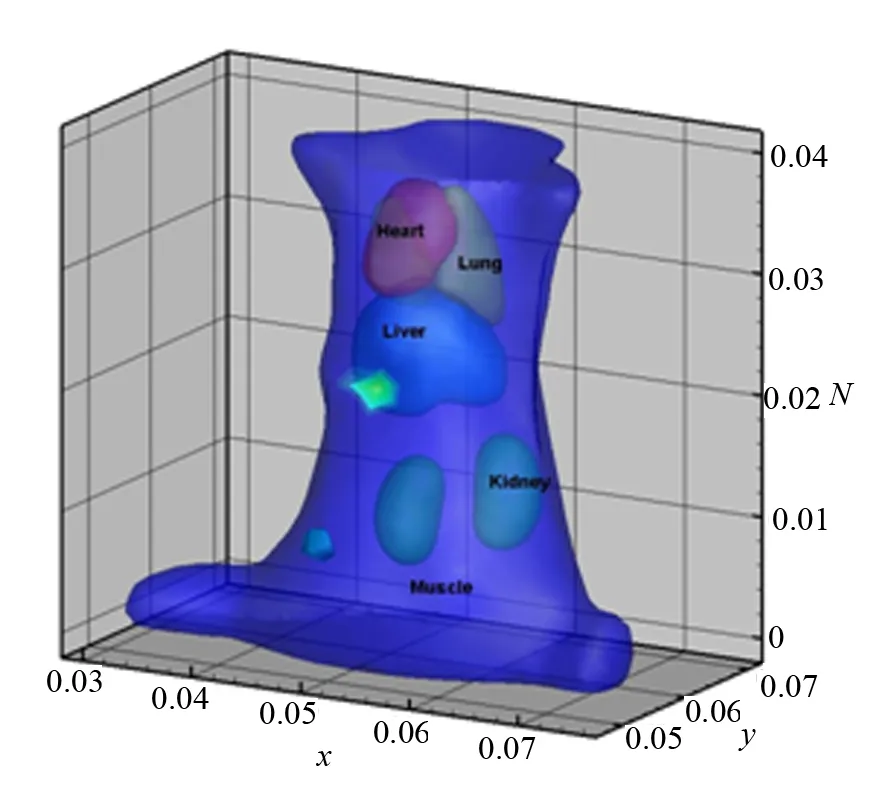
图11 双肿瘤重建结果 图12 传统单肿瘤重建效果
3 总 结
本文将带有GFP荧光标记的细胞注入小鼠体内,建立双肿瘤小鼠模型,利用FMT/Micro-CT系统获取小鼠肿瘤荧光信息和结构信息,通过分割、配准一系列数据处理过程,最后获得了双肿瘤的重建结果图;并将传统单光源重建结果与之比较,证明了激发荧光断层成像在多肿瘤重建方面的可行性,拓宽了激发荧光断层成像的应用范围.但本实验尚存在很多不足的地方,FMT的主要功能是获得光源的三维信息,本实验中为获得较好的荧光效果,光源的深度没有得到很好的保障,这是需要改进的地方;另外,本论文中的双光源重建过程是单个分开进行的,效率比较低.因此,在以后的研究中将在重建速度方面作进一步的改善.
[1]Weissleder R.Molecular imaging:Exploring the next frontier[J].Radiology,1999,212(3):609-614.
[2]Gao Feng,Zhao Huijuan,Tanikawa Y,et al.A linear,featured-data scheme for image reconstruction in time-domain uorescence molecular tomography[J].Optics Express,2006,14(16):7109-7124.
[3]Panasyuk G Y,Wang Zhengmin,Schotland J C,et al.Fluorescent optical tomography with large data sets[J].Optics Letters,2008,33(15):1744-1746.
[4]Ntziachristos V,Ripoll J,Wang L V,et,al.Looking and listening to light:the evolution of whole-body photonic imaging[J].Nature Biotechnology,2005,23(3):313-320.
[5]Douma S,Van Laar T,Zevenhoven J,et al.Suppression of anoikis and induction of metastasis by the neurotrophic receptor trkb[J〗.Nature,2004,430(7003):1034-1039.
[6]Tseng J C,Levin B,Hurtado A,et al.Systemic tumor targeting and killing by sindbis viral vectors[J].Nature Biotechnology,2003,22(1):70-77.
[7]Tan Yiyong,Jiang Huabei.DOT guided fluorescence molecular tomography of arbitrarily shaped objects[J].Med Phys,2008,35(12):5703-5707 .
[8]Joshi A,Bangerth W,Sevick-Muraca E M.Adaptive finite element based tomography for fluorescence optical imaging in tissue[J].Opt Express,2004,12(22):5402-5417 .
[9]Han Dong,Tian Jie,Zhu Shouping,et al.A fast reconstruction algorithm for fluorescence molecular tomography with sparsity regularization[J].Opt Express,2010,18(8):8630-8646.
[10]Alexandrakis G,Rannou F R,Chatziioannou A F.Tomographic bioluminescence imaging by use of a combined optical-pet (opet) system:a computer simulation feasibility study[J].Physics in Medicine and Biology,2005,50(17):4225.
[11]Xue Zhenwen,Ma Xibo,Zhang Qian,et al.An adaptive regularized method based on homotopy for sparse fluorescence tomography[J].Applied Optics,2013,52(11):2374-2384.

