新辅助化疗联合腹腔镜辅助D2近端胃癌根治术治疗近端进展期胃癌*
吴梅青 周旭坤 李 平 罗 毅 刘顺顺 李 栋
(新疆生产建设兵团农一师医院普外科,阿克苏 843000)
·临床论著·
新辅助化疗联合腹腔镜辅助D2近端胃癌根治术治疗近端进展期胃癌*
吴梅青 周旭坤**李 平 罗 毅 刘顺顺 李 栋
(新疆生产建设兵团农一师医院普外科,阿克苏 843000)
目的评价新辅助化疗联合腹腔镜治疗近端进展期胃癌的临床疗效。方法回顾性分析2009年2月~2013年2月36例近端局部进展期胃癌的临床资料。行2周期改良FOLFOX方案化疗,根据影像学资料观察病灶变化,有效者30例再化疗2周期。均于化疗结束后3周接受腹腔镜辅助D2近端胃癌根治术。结果新辅助化疗后原发病灶获完全缓解5例(13.9%),部分缓解17例(47.2%),疾病稳定8例(22.2%),疾病进展6例(16.7%);总有效率为61.1%(22/36)。手术均获成功,手术时间(275±50)min,术中出血量(130±40)ml,淋巴结清扫数目(23.3±7.6)枚;术后胃肠道功能恢复时间(3.7±1.8)d。术后肺部感染2例,术后5天误吸死亡1例。随访4~48个月,平均23.8月,复发率8.6%(3/35),病死率5.7%(2/35)。结论新辅助化疗联合腹腔镜治疗近端局部进展期胃癌安全有效,术前肿瘤降期明显,同时具有创伤小、术后恢复快等优点,但远期疗效尚需大样本长期观察。
新辅助化疗; 腹腔镜手术; 近端胃癌; 进展期
近年来,我国胃癌发病率呈逐年上升趋势,手术仍然是胃癌患者获得根治的惟一途径,但Ⅱ~Ⅳ期胃癌根治术后的局部区域复发率和远处转移率仍为50%~85%[1],故辅助治疗成为研究热点。2009年2月~2013年2月,我科运用新辅助化疗联合腹腔镜治疗近端局部进展期胃癌36例,现报道如下。
1 临床资料与方法
1.1 一般资料
本组36例,男22例,女14例。年龄36~72岁,平均54.8岁。均以上腹饱胀、隐痛、呃逆为主要症状就诊,病程2~6个月。行胃镜明确肿瘤位置:肿瘤位于贲门12例,胃底6例,胃底贲门18例。活检组织学分型:乳头状腺癌10例,管状腺癌16例,低分化癌4例,黏液腺癌3例,印戒细胞癌2例,未分化癌1例。TNM分期Ⅱ期10例,Ⅲa期20例,Ⅲb期6例。血癌胚抗原(CEA)均正常(正常值<2.5 μg/L)。
纳入标准:①心肺功能评估化疗、手术耐受良好;②病理学证实为胃癌;③按临床分期、术前胃镜、超声、CT均证实为进展期胃癌(以浸润深度、淋巴结转移和邻近脏器侵犯情况为准),无肝、肺、脑、骨等器官远处转移;④未经抗肿瘤治疗的初治者。
病例排除标准:①腹腔镜探查见腹腔广泛转移;②大面积浆膜层受侵;③肿瘤直径>10 cm。
1.2 方法
1.2.1 化疗方案 采用改良FOLFOX方案:奥沙利铂(OXA)130 mg/m2,静脉滴注2 h,第1天;亚叶酸钙(LV)40 mg/m2静脉滴注2 h后滴注氟尿嘧啶(5-FU)100 mg/m2,第1~5天。化疗前后常规使用止吐药昂丹司琼。患者可耐受的情况下每14天为1个周期。2个疗程复查一次胃镜及CT,观察肿瘤原发病灶变化,再决定下一步治疗方案:如影像学检查肿瘤原发病灶缩小明显,则再行2周期化疗后手术;如病灶有增大趋势,则提示肿瘤对化疗不敏感,直接手术,术后更换化疗方案。每周至少检查血常规2次,每周期前至少检查肝、肾功能1次,若白细胞<3×109/L或中性粒细胞<1.5×109/L,予以重组人粒细胞集落刺激因子支持。术前复查上腹部增强CT、胃镜及常规检查。化疗结束后3周手术。
1.2.2 手术方法 近端胃癌D2根治术:术前准备同常规开腹胃癌根治术。气管插管全身麻醉,取右倾、仰卧、分腿位,头高脚低20°~30°。术者站于患者左侧,2名助手分别站在患者右侧及双腿间。手术方式根据2002年版日本胃癌治疗规范[2]。脐下缘建立CO2气腹,压力为12 mm Hg(1 mm Hg=0.133 kPa),置入10 mm trocar作为观察孔;左肋缘下腋前线12 mm trocar为主操作孔,右肋缘下锁骨中线10 mm及腋前线5 mm分别为辅操作孔和把持孔,置入超声刀、把持钳等。行腹腔镜辅助近端胃癌根治术:超声刀从横结肠中部开始向左解剖游离大网膜至结肠脾曲,于胃网膜左动静脉根部分别用血管夹及钛夹夹闭切断,将胃牵向右侧显露脾胃韧带,贴近脾门暴露脾动脉并全程裸化至脾门处,清扫第11组淋巴结,继续切断胃短动静脉,并沿左肾上腺表面分离至食管膈肌裂孔处,清扫第2、4组淋巴结。将胃翻向上方,分离暴露胃左动静脉、肝总动脉、脾动脉,距起始部0.5 cm处分别用血管夹及钛夹夹闭后切断胃左动静脉,清扫第7、9、10组淋巴结,完全裸化食管腹腔段,于胃右动脉根部上钛夹后切断,清扫幽门上第5组淋巴结。沿肝下缘切断小网膜至贲门右侧,向下清扫贲门右第1组淋巴结,切断右迷走神经干同时向上裸化食管5 cm。做上腹正中切口5~6 cm,于贲门上方4 cm处用荷包钳钳夹切断食管,在食管断端做一荷包,将强生26 mm圆型吻合器钉钻放入食管并收紧荷包缝线,将胃提出腹腔外,距肿瘤5 cm处钳夹大弯侧胃体切断,10 cm直线型切割闭合器离断胃小弯侧胃体,开放大弯侧残端,生理盐水反复灌洗胃腔,置入26 mm圆型吻合器,行食管胃后壁吻合,闭合胃体大弯侧残端。术中快速冰冻食管切缘及胃切缘均无肿瘤细胞残留。
1.2.3 随访 采取肿瘤标准随访原则,术后3年内每3个月来院复查,3年后每6个月复查1次,包括癌胚抗原、腹部彩超或CT、胸部X线,每6个月复查胃镜。
2 结果
改良FOLFOX方案新辅助化疗后,原发病灶获临床完全缓解(complete response,CR)5例(13.9%),部分缓解(partial response,PR)17例(47.2%),疾病稳定(stable disease,SD)8例(22.2%),疾病进展(progressive disease,PD)6例(16.7%);总有效率(response rate,RR)61.1%(22/36)。化疗前后TNM分期见表1。
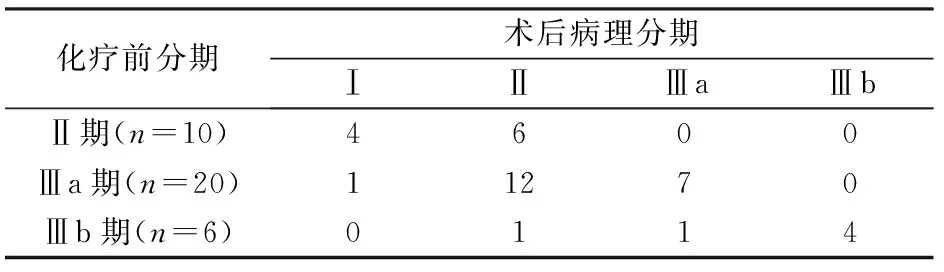
表1 化疗前后TNM分期
手术时间(275±50)min,术中出血量(130±40)ml,淋巴结清扫数目(23.3±7.6)枚,胃肠道功能恢复时间(3.7±1.8)d(排气、排便、肠鸣音恢复正常)。术后病理分期Ⅰ期5例、Ⅱ期19例、Ⅲa期8例、Ⅲb期4例。术后肺部感染2例,经积极抗感染、肺部理疗治愈;1例术后5天因食物反流误吸气管内窒息死亡。
35例术后2周开始化疗,对术前化疗方案有效的29例继续治疗4个周期,对术前化疗无效的6例更改治疗方案。截止到2013年6月,随访4~48个月,平均23.8月(<1年9例,1~2年11例,>2年15例),均未见切口及戳孔肿瘤种植转移。3例复发转移:1例Ⅲa期术后1年上腹部增强CT提示后腹膜淋巴结肿大转移,目前带瘤生存;1例Ⅲb期术后1年脊柱骨转移死亡;1例Ⅲa期术后2年CT发现肝转移死亡。复发率8.6%(3/35),病死率5.7%(2/35)。血CEA升高3例,其中1例(>60 μg/L)为后腹膜转移患者,另2例分别于术后1年、2年时复查,除CEA略偏高(2.5~8.3 μg/L)外,影像学检查未发现异常。
3 讨论
2008年,日本对于早期胃癌的治疗,除了传统的开腹手术,腹腔镜远端胃切除术成为另一种选择[3],Tokunaga等[4]的研究表明,经专业培训后腹腔镜胃癌根治术在术中失血量、清扫淋巴结数目及术后并发症发生率等方面,与传统开腹手术相比差异无统计学意义,越来越多的病例报道也证实浸润深度超过T2进展期患者接受腹腔镜胃癌根治术是安全、可行的[5]。近端胃手术操作空间狭小,腹腔镜辅助下手术视野相对开阔,本组手术时间(275±50)min,术中出血量(130±40)ml,淋巴结清扫数目(23.3±7.6)枚,但因术前TNM分期不同,术后复发率及死亡率不同。国内外大量试验结果亦证明,对于进展期胃癌不论是开腹或腹腔镜胃癌D2根治术后,其远期疗效并没有显著提高[6]。
近年来对胃癌综合治疗影响较大的当属MAGIC试验[7],包括英国、荷兰、德国、巴西等国的9个中心参加了该临床试验,入选病例为临床分期Ⅱ期以上可切除的胃癌和食管下段癌。共入选503例,胃癌占74%,随机分为围手术期化疗组(250例)与对照组(253例),结果表明围手术期化疗可使患者5年生存率从23%提高到36%。虽然其术前分期、病理分期、化疗后副反应不完全一致,但其样本量大,研究设计严谨,其结果依然真实可靠,所以NCCN指南将其作为Ⅰ类证据[8]。根据该项研究结果,提倡进行新辅助化疗的病例是T2(浸润肌层)以上、M0(无远处转移)的进展期胃癌病例,伴或不伴淋巴结转移。所以,我院将局部进展期的Ⅱ、Ⅲ期胃癌作为新辅助化疗的主要对象。目前国内外学者对术前新辅助化疗的研究显示,R0(radical resection,根治性手术切除)联合新辅助化疗,可显著提高R0手术切除率,有效杀灭微转移灶,减少术后复发转移,5年生存率增加,是胃癌多学科协作(multi-disciplinary team,MDT)治疗的重要组成部分[9]。本组治疗前Ⅱ期10例、Ⅲa期20例、Ⅲb期6例,术后病理分期Ⅰ期5例、Ⅱ期19例、Ⅲa期8例、Ⅲb期4例,新辅助化疗后4例Ⅱ期和1例Ⅲa期降至Ⅰ期,12例Ⅲa期和1例Ⅲb期降至Ⅱ期,1例Ⅲb期降至Ⅲa期,新辅助化疗总有效率(CR+PR)61.1%(22/36)。在对35例患者4~48个月的随访中,复发率8.6%(3/35),病死率5.7%(2/35),这可能亦与术前化疗降期有关。
腹腔镜胃癌根治术要严格掌握适应证,主要适用于Ⅰ、Ⅱ、Ⅲ期及部分Ⅳ期患者,其微创已得到公认:本组术后胃肠功能恢复时间(3.7±1.8)d。而对于化疗产生的不可避免的副反应学者们也做了大量的临床观察及动物实验,化疗后胃周组织脆性增加[10],但具有可逆性,21 d左右可基本恢复正常[11],故选择化疗后3周行手术治疗,术中需避免钝性分离及不当牵拉,以免术野出血点增多,导致视野不清。手术过程中需注意:在断开胃膈韧带时,尽量配合膈肌运动,以免损伤膈肌,导致气胸;在结扎胃短动脉时,操作轻柔,避免将脾脏浆膜撕裂导致出血。本组36例中,术后肺部感染2例,对症治疗后治愈,术后5天因误吸死亡1例,术后应将患者置于头高脚低半卧位,保持胃肠减压通畅或抑制胃肠液的分泌。
总之,我院开展胃癌综合治疗的几年来,得到不断的进步和完善[12]。新辅助化疗联合腹腔镜治疗近端局部进展期胃癌安全有效,从化疗前后的TNM分期看术前肿瘤降期明显,其远期疗效尚需长时间、大样本的临床观察。
1 孙秀娣,牧 人,周有尚,等.中国胃癌死亡率20年变化情况分析及其发展趋势预测.中华肿瘤杂志,2004,26(1):101-105.
2 Nakajima T.Gastric cancer treatment guidelines in Japan.Gastric Cancer,2002,5(1):1-5.
3 傅 红,黄 恺.日本胃癌治疗部分经验荟萃与解析(1).中国实用外科杂志,2012,32(9):700-702.
4 Bingener J,Michalek J,Winston J,et al.Randomized blinded trial comparing the cardiopulmonary effects of NOTES with standard laparoscopy in a porcine survival model.Surg Endosc,2008,22(6):1430-1434.
5 Ziqiang W,Feng Q,Zhimin C,et al.Comparison of laparoscopically assisted and open radical distal gastrectomy with extended lymphadenectomy for gastric cancer management. Surg Endosc,2006,20(11):1738-1743.
6 王亚旭,毕德利.影响胃癌术后复发及预后的相关因素分析.中国普通外科杂志,2011,20(4):334-337.
7 Cunningham D,Allum WH,Stenning SP,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer.N Engl J Med,2006,355(1):11-20.
8 National Comprehensive Cancer Network.NCCN Clinical Practice Guidelines in Oncology: gastric cancer.Version 1.2012.http://wenku.baidu.com/view/7017a729b4daa58da0114a3e.html
9 季加孚,武爱文.进展期胃癌的新辅助化疗.中华胃肠外科杂志,2008,11(2):110-111.
10 郑民华.我国腹腔镜胃肠肿瘤外科的发展方向.腹腔镜外科杂志,2008,13(1):1-3.
11 沈 策,刘 皓,左 强,等.短期化疗对兔腹主动脉顺应性的影响.第一军医大学学报,2005,25(11):1443-1445.
12 李 栋,周旭坤,李 平,等.腹腔镜进展期胃癌根治术66例报告.中国微创外科杂志,2011,11(9):773-775.
(修回日期:2013-11-27)
(责任编辑:王惠群)
NeoadjuvantChemotherapyCombinedwithLaparoscopy-assistedSurgeryforAdvancedProximalGastricCancer:aClinicalResearchof36Cases
WuMeiqing,ZhouXukun,LiPing,etal.
DepartmentofGeneralSurgery,NongyishiHospital,Aksu843000,China
ObjectiveTo evaluate the treatment effect of neoadjuvant chemotherapy combined with laparoscopic surgery on advanced proximal gastric cancer.MethodsWe retrospectively analyzed the clinical data of 36 patients with advanced proximal gastric cancer undergoing 2 courses of chemotherapy with FOLFOX regimen in our hospital from February 2009 to February 2013. Based on iconographic results, 30 cases showed effective results through gastroscopy and CT, and they
another two courses of chemotherapy. Radical gastrectomy was performed for all patients three weeks after chemotherapy.ResultsThe total effective rate of neoadjuvant chemotherapy was 61.1% (22/36). Clinical complete response (CR) occurred in 5 cases (13.9%), partial response (PR) in 17 cases (47.2%), stable symptoms (SD) in 8 cases (22.2%), and disease progressive (PD) in 6 cases(16.7%). All surgeries were successfully performed. The operative time was (275±50) min, the intraoperative blood loss was (130±40) ml and the number of lymph node dissected was (23.3±7.6). Postoperative gastrointestinal function recovery time was (3.7±1.8) d. Two patients suffered postoperative lung infection, and 1 died due to aspiration 5 days after the surgery. Patients were followed up for 4-48 months (average, 23.8 months). The recurrence rate was 8.6% (3/35) and the mortality rate was 5.7% (2/35).ConclusionsThe neoadjuvant chemotherapy combined with laparoscopic surgery for advanced proximal gastric cancer is safe and effective, especially in the early-stage tumor. It has the advantages of minimal invasion and rapid recovery. A large sample is still needed for the long-term effect of the procedure.
Neoadjuvant chemotherapy; Laparoscopic surgery; Proximal gastric cancer; Progressive stage
新疆生产建设兵团科技攻关资助项目(2009GG55)
R735.2
:A
:1009-6604(2014)02-0109-03
10.3969/j.issn.1009-6604.2014.02.004
2013-09-17)
**通讯作者(新疆生产建设兵团医院普外科,乌鲁木齐 830002),E-mail:zhouxukundoctor@sina.cn

