高产共轭亚油酸乳酸菌的筛选及培养条件的确定
甄妮,鹿保鑫
(黑龙江八一农垦大学食品学院,大庆 163319)
由于CLA 一般作为天然成分存在于食物之中,因此,国外对共轭亚油酸的研究起步较早。按照时间顺序,共轭双键的脂肪酸存在于反刍动物食品中这一结论被国外学者Booth[1]等人在1935年证实,这也是人类研究CLA 所取得的最早、最有价值的结论。到了90年代中期,随着试验证实CLA 具有抗击肿瘤的特性,引发了各国科研人员极大的研究兴趣。我国对CLA 研究及应用起步较晚,2002年作为我国“十五”期间重大科技项目之一奶牛现代集约饲养关键技术研究和产业化开发项目,CLA 被应用于二者当中[2]。随着人们饮食观念的不断提高,具有减肥塑身效用的CLA 功能食品得到了更多消费者的认可,从而带动了食品研究者和开发商的研究热情和生产需求[3]。从目前全球形势来看,生产CLA 功能性产品的市场在欧洲等发达国家已经接近饱和,市场份额已占85%以上[4],超过了全球平均水平;而亚洲市场因日本是唯一一个起步较早的国家,该国家生产的CLA 功能性产品已经占据了全亚洲近75%的份额[5],可再开发市场潜力较小。这给我国提供了一个千载难逢的发展机遇,预测我国在内的其他一些亚洲国家才是未来提高CLA 市场份额的新战场。因此,研究采用七种乳酸菌,分别对其产CLA 的能力进行比较,从中选出产量最高的菌株,并对CLA 的发酵条件进行优化,以共轭亚油酸最佳培养温度、培养时间、生长pH 为单因素,进行响应面优化分析,确定了菌种生长的最佳条件。
1 材料与方法
1.1 原料与试剂
实验所使用的菌株来自于微生物菌种保藏管理中心,德氏乳杆菌保加利亚亚种1.148 2、中国工业微生物菌种保藏管理中心嗜酸乳杆菌21 004、干酪乳杆菌20 266、植物乳杆菌20 022、乳酸乳球菌20 411、嗜热链球菌20 373、发酵乳杆菌22 537。
主要试剂:MRS 培养基。
1.2 主要仪器
LDZX-75KBS 立式压力蒸汽灭菌器;AR2140 电子天平;DRP-9082 电热恒温培养箱;微量移液器
1.3 方法
1.3.1 菌株的活化
将保存于冰箱的7 种乳酸菌接种于脱脂乳中,接种量为2%,混匀后放入37 ℃恒温培养中培养24 h,作为一代,吸取脱脂乳培养基中的菌液少许,转接入MRS 培养液体基中,37 ℃下静置培养24 h,活化两代后,接种于MRS 斜面中,4 ℃保存备用。
1.3.2 发酵方法
LA 乳化液的配制方法是将Tween-80 和LA分别取用1 mL,同时在冰浴条件下加入蒸馏水88.4 mL,进行超声波乳化,进行破碎,然后用无菌微孔滤膜0.22 μm 进行过滤除菌,最终获得CLA 溶液,其浓度为10 mg·mL-1。活化被保存好的菌株,菌种从MRS 固体斜面培养中挑取,并将其接种于37 ℃的MRS 液体培养基中静止培养24 h,再活化一次。培养液为两代活化以后的作为种子液,按照2%的接种量接种到装有10 mL 的MRS 培养基中,并放入乳化液,静止培育24 h 后,使底物浓度达到0.4 mg·mL-1。
1.3.3 CLA 标准曲线的制作
CLA 标准品准确称取2.5 mg,溶剂为正己烷,将其定容在25 mL 容量瓶内,待溶解后吸取0.05,0.1,0.15,0.2,0.25,0.3,0.35,0.4.0.45,0.5 mL 放入容量为10 mL 的容量瓶内,将正己烷定容至10 mL 后以获得CLA 不同的浓度,以正己烷作为参比在波长为233 nm 处测定吸收光值,将横坐标设为CLA(g·mL-1)浓度,纵坐标设为吸光值,进而绘制CLA 标准曲线。
1.3.4 发酵液中CLA 产量的检测
培养结束后,试管中的发酵液(5 mL)移入100 mL分液漏斗中,每管发酵液加入20 mL 正己烷振荡萃取,静置分层后放弃下层水相液体,加入等量蒸馏水振荡水洗,静置后弃去下层水相液体,水洗两遍后,萃取液移至干净小烧杯中,加入少量无水硫酸钠脱去萃取液中的水分和水溶性物质,干燥至无乳化层,可消除水溶性物质对紫外检测的干扰[6]。无水硫酸钠经105~110 ℃干燥3 h 后使用,将脱去水分和水溶性物质的止己烷萃取液移入25 mL 容量瓶中,加入正己烷定容,摇匀后进行紫外检测,不能及时检测的样品放入4 ℃,并在24 h 内完成检测。
以不接种的空白培养基为参比液,空白培养基和发酵培养基同一条件下作灭菌处理,并和接种后的发酵培养基同时培养,培养到预定时间后,空白培养基和发酵培养基试管同时取出进行萃取操作,空白培养基的萃取方法、条件和接种的发酵培养基相同。以空白培养基的正己烷萃取液为参比液,扫描后作为发酵培养基正己烷萃取液检测的工作基线存入紫外检测仪的计算机中。这样可消除底物亚油酸、培养基组分在正己烷萃取液中产生的紫外吸收,消除这些因素对紫外检测CLA 生成量产生的干扰,提高紫外检测CLA 生成量的数据精确度和可靠性。
以空白培养基正己烷萃取液的紫外区吸收为工作基线,对样品在200~350 nm 范围内扫描,观察在233 nm 处有无特征吸收峰。在233 nm 处有最大吸收,且吸收峰对称者表明其发酵液中有CLA 生成,读取233 nm 处的吸收值,根据紫外吸收标准曲线和稀释倍数计算发酵液中CLA 生成量。空白培养基与发酵培养基加入同量亚油酸,不接入菌种,其他步骤同发酵培养基。每次进行紫外检测时,先将紫外分光光度计开机预热30 min,仪器稳定后,再放入参比液和样品进行扫描检测,可提高检测精度和可靠性。
1.3.5 发酵温度对CLA 生产量的影响
将培养基选取为优化的MRS 培养基,将已经灭菌的容量为10 mL 的培养基试管接入2%的活化高产菌株,同时放入0.25%的亚油酸,在其他条件相同的情况下,将培养箱的温度设置为30~40 ℃之间,CLA 的产量在培养24 h 后测定。最佳培养温度根据CLA 的产量确定。
1.3.6 发酵时间对CLA 生产量的影响
将培养基选取为优化的MRS 培养基,将已经灭菌的容量为10 mL 的培养基试管接入2%的活化高产菌株,同时放入0.25%的亚油酸,在其他条件相同的情况下,将培养箱的温度设置为30 ℃并培养不同的时间,最终测出CLA 产量,根据菌株产CLA 量,来确定最佳培养时间。
1.3.7 初始pH 值对CLA 生产量的影响
将培养基选取为优化的MRS 培养基,将已经灭菌的容量为10 mL 的培养基试管接入2%的活化高产菌株,同时放入0.25%的亚油酸,在其他条件相同的情况下将初始的pH 值在培养基中调整为5~8 之间,温度定为37 ℃,培养24 h 测出共轭亚油酸的产量。最佳培养时间根据菌株产CLA 确定。最佳pH 值根据CLA 的产量确定。
1.3.8 确定培养条件各因素的交互影响
将培养pH 值、时间和温度作为以上单因素实验结果进行交互作用,将三种因素分别设置不同的水平,进行响应面法优化试验,以确定最佳条件的菌株产CLA 的培养条件,以及相互之间的关系及指标贡献率受各种因素的影响。
2 结果分析
2.1 共轭亚油酸菌株的高产筛选
将配制好的CLA 标准品在正己烷为参比的条件下,采用紫外分光光度计,测定其在233 nm 处的吸光值。标准曲线的横坐标为CLA 的浓度,纵坐标为CLA 的吸光值,CLA 紫外吸收标准曲线的线性回归方程为y=100.69x-0.000 3,从而确定CLA 的标准曲线如图1 所示。
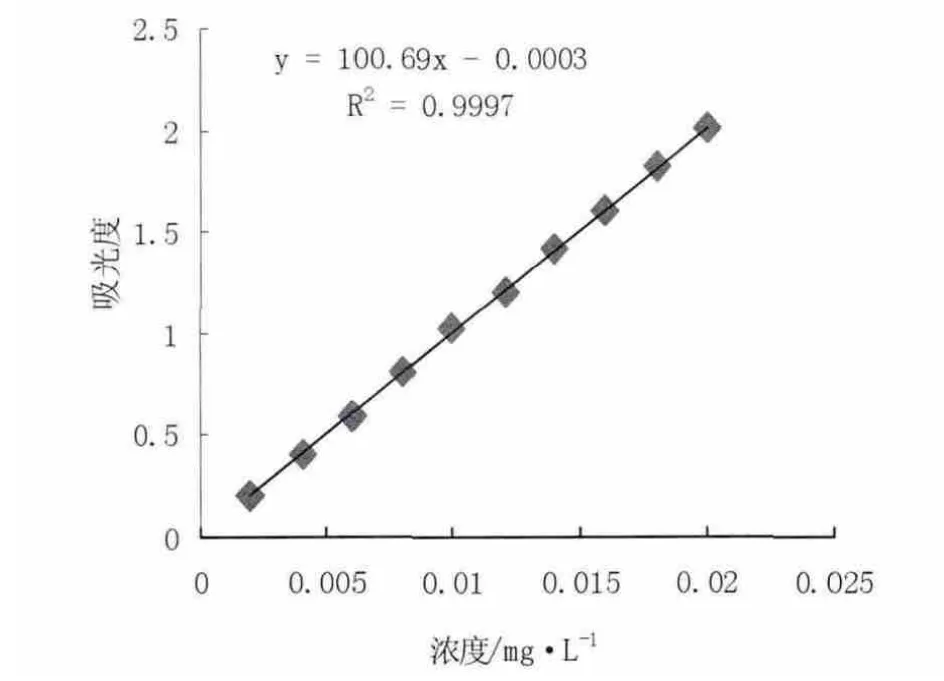
图1 共轭亚油酸标准曲线Fig.1 The standard curve of conjugated linoleic acid
通过紫外分光光度计的检测发现,实验中所选择的7 种乳杆菌中有5 种乳酸菌在233 nm 处有紫外吸收值。在10 mL 的发酵液中,CLA 的产量在0.25~0.6 mg 之间,其中德式乳杆菌保加利亚亚种CLA 产量最高,产量达到0.55 mg·mL-1,因此选用德式乳杆菌作为接下来实验的出发菌株。
2.2 菌株培养条件的优化
2.2.1 发酵温度对CLA 生产量的影响
将培养基选取为优化的MRS 培养基,将已经灭菌的容量为10 mL 的培养基试管接入2%的活化高产菌株,同时放入0.25%的亚油酸,在其他条件相同的情况下,控制发酵时间为24 h、初始pH 为7.0,调整培养箱温度为31、33、35、37、39 ℃,比较不同发酵温度对CLA 产量的影响,结果如图2 所示。

图2 培养温度对CLA 产量的影响Fig.2 The effects of culture temperature on CLA yield
由图2 培养温度对CLA 产量的影响可知,随着培养温度的增加,CLA 产量呈现先增大后降低的变化趋势,在培养温度为35 ℃时,CLA 产量有最大值0.267 mg·mL-1。故选择培养温度为35 ℃进行后续优化试验。
2.2.2 发酵时间对CLA 生产量的影响
将培养基选取为优化的MRS 培养基,将已经灭菌的容量为10 mL 的培养基试管接入2%的活化高产菌株,同时放入0.25%的亚油酸,在其他条件相同的情况下,在其他条件相同的情况下,控制发酵温度为35 ℃、初始pH 为7.0,调整培养时间为12、24、36、48、60 h,比较不同发酵温度对CLA 产量的影响,结果如图3 所示。
由图3 培养时间对CLA 产量的影响可知,随着培养时间的增大,CLA 产量呈现增大的变化趋势,当培养时间为36 h 时CLA 产量有最大值0.271 mg·mL-1,当培养时间进一步延长,CLA 产量并不继续增大,而呈现小幅的降低。这可能是因为CLA 的生物合成是一个动态的过程,生成的CLA 为生物氢化过程的中间产物,会被继续加氢生成油酸或硬脂酸,表现为CLA的产量呈缓慢降低的趋势[7]。
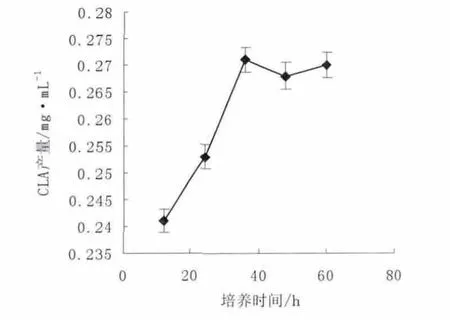
图3 培养时间对CLA 产量的影响Fig.3 The effects of incubation time on CLA yield
2.2.3 初始PH 值对CLA 生产量的影响
将培养基选取为优化的MRS 培养基,将已经灭菌的容量为10 mL 的培养基试管接入2%的活化高产菌株,同时放入0.25%的亚油酸,在其他条件相同的情况下,在其他条件相同的情况下,控制发酵温度为35 ℃、培养时间为36 h,调整初始pH 为5.0、6.0、7.0、8.0、9.0,比较不同发酵温度对CLA 产量的影响,结果如图4 所示。

图4 初始pH 对CLA 产量的影响Fig.4 The effects of initial pH on CLA production
由图4 初始pH 对CLA 产量的影响可知,随着初始pH 的增加,CLA 产量呈现先增大后降低的变化趋势,在初始pH 为7.0 时,CLA 产量有最大值0.276 mg·mL-1。故选择初始pH 为7.0 进行后续优化试验。
2.2.4 响应面优化试验
在单因素研究的基础上,选取温度、pH 和时间3个因素为自变量,以CLA 的产量为响应值,根据Box-Behnken 设计原理,设计响应面分析实验,其因素水平编码表见表1。
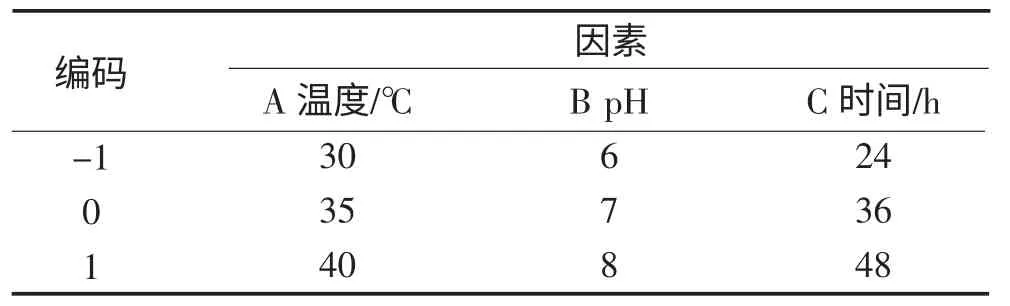
表1 因素编码表Table 1 The coding table of factors
实验应用响应面优化法进行条件优化。以A、B、C 为自变量,以CLA 的产量R 为响应值,响应面实验方案及结果见表2。

表2 实验设计及结果Table 2 The experimental design and results
CLA 的产量R 通过统计分析软件Design-Expert进行数据分析,建立二次响应面回归模型如下:R=0.29+0.008 375A-0.011B+0.009 125C-0.008 5AB-0.002 75AC+0.003BC-0.037A2-0.038B2-0.008 025C2CLA 的产量R 的回归与方差分析结果见表3。

表3 CLA 的产量的回归与方差分析结果Table 3 The regression and analysis of variance results in CLA production
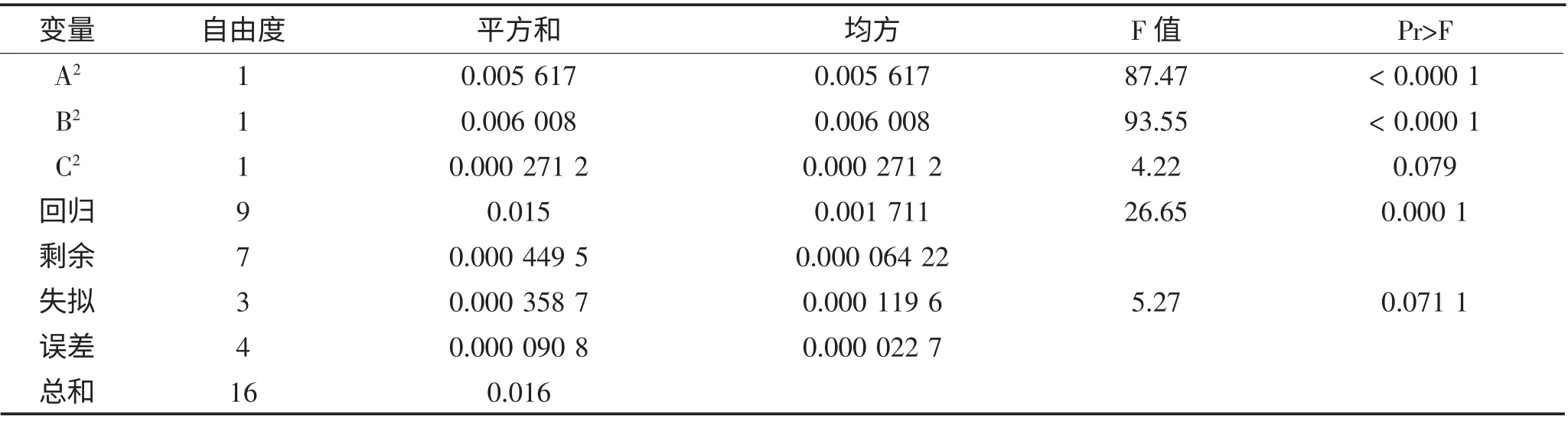
续表3 CLA 的产量的回归与方差分析结果Continued table 3 The regression and analysis of variance results in CLA production
由表可知,方程因变量与自变量之间的线性关系明显,该模型回归显著(P<0.000 1),失拟项不显著(P>0.05),并且该模型R2=97.16%,R2Adj=93.52%,说明该模型与实验拟合良好,自变量与响应值之间线性关系显著,可以用于该反应的理论推测。由F 检验可以得到因子贡献率为:B>C>A,即pH>时间>温度。
2.2.5 因素响应面分析
(1)pH 和温度对CLA 产量的影响

图5 pH 和温度对CLA 产量的影响响应面图Fig.5 pH and effects of temperature on CLA yield response surface graphs
(2)时间和温度对CLA 产量的影响

图6 时间和温度对CLA 产量的影响响应面图Fig.6 The time and temperature on CLA yield response surface graphs
(3)时间和pH 对CLA 产量的影响

图7 时间和pH 对CLA 产量的影响响应面图Fig.7 The effects of time and pH on CLA yield response surface graphs
应用响应面寻优分析方法对回归模型进行分析,寻找最优响应结果温度为36 ℃,pH 为7,时间为42 h,响应值CLA 产量最优值为0.290 mg·mL-1。
2.2.6 验证性实验
在响应面分析法求得的最佳条件下,即温度为36 ℃,pH 为7,时间为42 h,进行3 次平行实验,3 次平行实验CLA 的产量的平均值为0.292 mg·mL-1。说明响应值的实验值与回归方程预测值吻合良好。
3 结论
通过发酵试验,并以紫外可见分光光度计检测,发现在实验的7 种乳酸菌中有5 株菌发酵液的萃取液在233 nm 处有最大吸收峰。它们产CLA 的能力不等。其中德式乳杆菌发酵液中CLA 含量最高,达到0.055 mg·mL-1。将德式乳杆菌作为出发菌株并对对共轭亚油酸最佳培养温度、培养时间、生长pH 的确定,利用单因素和响应面优化分析,确定了菌种生长的最佳条件。在实验范围内培养条件对共轭亚油酸菌株生长的影响依次为PH>时间>温度。应用响应面寻优分析方法对回归模型进行分析,寻找最优响应结果为培养温度36 ℃,pH 为7,培养时间42 h,CLA产量最优值为0.290 mg·mL-1。
[1]Booth R G,Kon S K,Dan W J.A study of seasonal variation in butter fat.A Seasonal Spectroscopic Variation In the Fatty Acid Fraction[J].Biochem.J,1935,29:133-137.
[2]董明,齐树亭.乳酸菌发酵生产共轭亚油酸[J].中国油脂,2007,32(7):63-65.
[3]林淑英,宁正祥,郭清泉.共轭亚油酸在食品工业中的应用前景[J].中国油脂,2003,21(11):55-58.
[4]邵群,张慧,边际.功能性油脂—共轭亚油酸研究进展[J].食品科学,2002,23(2):164-166.
[5]张中义,胡锦蓉,刘萍,等.产共轭亚油酸乳酸菌的筛选及产物分析[J].中国农业大学学报,2004,9(3):5-8.
[6]杨春雨,曹龙奎.微波-氯化锂复合诱变筛选耐受高浓度丁醇菌株[J].黑龙江八一农垦大学学报,2013,25(5):59-63.
[7]刘晓华,曹郁生,陈燕.微生物生产共轭亚油酸的研究[J].食品与发酵工业,2003,29(9):69-72.

