氯吡格雷不良反应文献分析
黄 健,戴亦晖,郭 尧 (沈阳军区大连疗养院,辽宁 大连 116013)
氯吡格雷作为噻吩并吡啶类新型抗血小板药物,自2001年在国内上市以来,因其耐受性好、服药方便,临床应用广泛。因药物不良反应(adverse drug reactions,ADR)报道不断增多,其用药安全性备受关注。现将国内2001—2012年公开发表的35篇有关氯吡格雷ADR的文献报道进行统计分析,供参考。
1 资料与方法
1.1资料来源 通过检索维普数据库、万方数据库、中国医院知识仓库期刊全文库,收集2001—2012年所有氯吡格雷的ADR文献报道,剔除综述等非病例和重复病例报道,入选文献35篇,共46个病例。
1.2方法 对收集的病例按患者的性别、年龄、ADR发生时间、累及器官或系统与临床表现,进行统计分析。
2 结果
2.1患者基本情况 46例ADR病例中,男性37例(80.43%),女性9例(19.57%);年龄37~84岁,中位年龄67岁,61~70岁构成比最高(41.30%)、71~80岁构成比次高(32.61%),见表1。
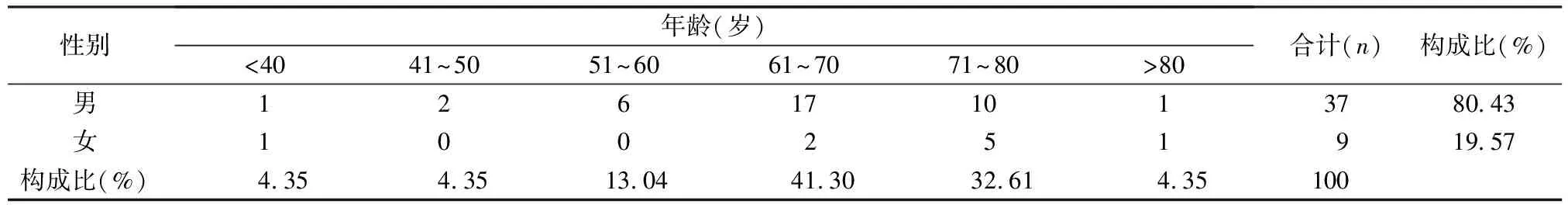
表1 46例氯吡格雷ADR病例性别与年龄分布
2.2ADR出现时间 ADR发生的时间范围较广,多集中于连续用药30 d内(73.91%),发生时间最快为用药开始后1 d(皮疹2例,白细胞减少1例),最迟为连续用药至2年(便秘1例),见表2。

表2 46例氯吡格雷ADR发生时间分布
2.3累及器官或系统及其临床表现 涉及血液、消化道、心、肝、皮肤、眼睛、关节、肌肉等多器官、多系统,临床表现复杂多样,发生例数位居前三位的依次是:血液系统20例(43.48%)、胃肠道系统6例(13.04%)、出血5例(10.87%)。有2例因ADR致急性再生障碍性贫血并发休克死亡,见表3。

表3 ADR累及器官或系统与临床表现
注:表内括号中数字为病例数
3 讨论
本组资料显示,46例发生ADR的患者中男、女均有,男性占多(80.43%);多分布于中老年人群,其中60岁以上患者占78.26%。氯吡格雷主要用于预防动脉粥样硬化血栓形成事件和急性冠脉综合征的患者,ADR的发生具有明显的年龄及性别偏向性。氯吡格雷本身为无活性的前体药物,在体内经氧化代谢为活性硫醇代谢物,可选择性不可逆地与血小板表面二磷酸腺苷受体结合而产生药理活性[1]。而高龄患者肾脏排泄功能、肝脏代谢功能及血浆蛋白含量均有所改变,同时多伴有慢性疾病且常同服几种药物,成为ADR的高发人群。
由表2可知,ADR病例在用药后各时间段均有分布,这与患者个体差异、配伍用药及术后情况等多种因素密切相关。但还是可以看到,ADR发生时间多分布于用药后30 d内(73.91%)。尽管如此,连续用药>180 d仍有4例ADR报告(8.7%)。鉴于行支架术的患者术后均联合阿司匹林服用氯吡格雷,疗程1~12个月或更长[2],本组资料提示在氯吡格雷长期用药过程中始终需要关注可能发生的ADR。
早在2000年,搜索WHO乌普萨拉监测中心(UMC)数据库资料就发现氯吡格雷与粒细胞减少症相关,还可引起血小板减少症及血小板减少性紫癜等血液系统不良反应,但其确切的发生机制不明[3]。由表3显示,46例中有2例患者死亡,1例连续用药17 d未按医嘱定时回院监测血常规,致急性再生障碍性贫血并发休克死亡[4],另一例术后连续用药21 d发现全血白细胞减少(考虑再生障碍性贫血)并发休克死亡[5],以上2例报道十分少见,应受到高度关注。氯吡格雷导致的白细胞减少及(或)血小板减少虽然少见,但由于用药时间长,特别是随着冠心病介入治疗的广泛开展,应用氯吡格雷的患者数量在不断增加,因此临床上应警惕血液系统不良反应的发生。医务人员应定期观察患者血常规的变化,发现异常及时停药,并应用提升白细胞及(或)血小板的药物治疗,在与其他减少血细胞的药物合用时,应缩短复查血常规的间隔[6]。出血和胃肠道反应属于氯吡格雷常见的ADR,为安全起见应定期监测凝血机制,特别是与其他抗血栓药合用时,一旦发生出血事件,应考虑终止抗血小板治疗[7];对长期抗血小板治疗的患者应监测胃肠道并发症, 定期行便潜血检查[8]。46例ADR报道中出血和胃肠道反应的例数明显少于白细胞减少等低发生率的血液系统ADR例数,此现象可能由于常见的ADR更能引起常规重视而被加以防范,而罕发ADR更具报道价值所致。表3还显示出一些罕见ADR,如便秘、迟发变态反应、可逆性味觉丧失等,亦须引起重视。随着氯吡格雷适应证范围的逐渐扩大,临床用药时除进行常规监测外,还应注意防止发生、合理应对这些潜在的不良反应。
近年有研究表明,氯吡格雷抗血小板作用主要依赖细胞色素450系统(主要是CYP2C19)的活化作用,CYP2C19的多态性、CYP2C19介导的药物相互作用是影响氯吡格雷疗效和安全性的重要因素[9]。FDA已于2010年3月12日批准警告患者药物活化功能受损可能导致药物无效[10]。与此同时,强代谢者则可能产生过多的活性代谢产物,导致出血事件的发生。因此,通过基因检测根据遗传差异进行个体化用药,能够在基因水平上减少不良反应,为促进氯吡格雷合理化用药提供了一种可行途径[11],值得医务人员深入关注。
综上所述,应加强氯吡格雷用药后不良反应的监测,及时掌握人群用药后ADR的发生情况,分析ADR的发生规律,研究防范措施,减少ADR的危害。
【参考文献】
[1] 贾国强,张信红. 新型的ADP受体拮抗剂——硫酸氢氯吡格雷[J]. 药物与临床,2002,17(5) :52.
[2] 昊 辉,杨 俊,丁家望,等. 氯吡格雷在经皮冠状动脉介入术围手术期中的应用现状[J]. 中国临床药理学与治疗学,2007,12(12):1354.
[3] 张 英.氯吡格雷致粒细胞缺乏症[J].药物不良反应杂志,2002,4(5) :352.
[4] 田 丰,周玉珍,杭爱荣,等.氯吡格雷引起再生障碍性贫血死亡一例[J]. 中国介入心脏病学杂志, 2010,18(2):107.
[5] 王志清,高华强,周 晔,等. 氯吡格雷相关的致死性全血细胞减少1例报告[J]. 第二军医大学学报,2010,31(12):1389.
[6] 王福经,李青山. 氯吡格雷引起急性再生障碍性贫血一例[J]. 齐鲁药事,2004,23(3):58.
[7] 张金彦. 氯吡格雷致血液系统异常及防治措施[J]. 中国医院药学杂志, 2008,28(2):167.
[8] 孙 沂,樊宏伟,张振玉. 氯吡格雷对胃肠道的损害及其防治[J]. 世界华人消化杂志, 2009,17(18):1849.
[9] 吴 洋. 分子诊断的新进展——基因因素导致的氯吡格雷抵抗探讨[J]. 航空航天医学杂志, 2012,23(8):995.
[10] 黄红娟,卢新政. 2010美国心脏病学会基金会/美国心脏学关于氯吡格雷的应用警告概述[J]. 心血管病学进展, 2011,32(3):448.
[11] 李 彦,胡永芳,周宏灏. 基因检测在氯吡格雷抗血小板治疗中的意义[J]. 中国临床药理学杂志, 2012,28(9):694.

