Bmi-1和PCNA在宫颈病变中的临床意义与关系
唐晓琳,郑 捷,杨永秀
(1.兰州大学第一临床医学院,兰州 730000; 2.甘肃省第三人民医院妇产科,兰州 730020; 3.兰州大学第一临床医院妇产科,兰州 730000)
宫颈癌是最常见的妇科恶性肿瘤,严重威胁妇女的生命健康与生活质量。近40年来,宫颈细胞学筛查法的普遍应用,使得宫颈癌的发生率及死亡率明显降低,但鉴于其有假阴性等局限性,可能造成宫颈癌的漏诊、误诊等,故可靠的生物性肿瘤标记物对宫颈癌的诊断更重要。B细胞特异的莫洛尼白血病毒插入位点1基因(B-cell specific moloney murine leukemiavirus insertionsite 1,Bmi-1)是一种癌基因,具有调节干细胞自我更新和细胞增殖的作用[1]。目前,Honig等[2]研究发现Bmi- 1 在卵巢癌、子宫内膜癌、宫颈癌和乳腺癌等妇科肿瘤中高度表达,推断Bmi-1与肿瘤的发生密切相关。增殖细胞核抗原( proliferating cell nuclear antigen, PCNA) 又称周期蛋白, 其合成与表达和细胞增殖周期密切相关,是判断细胞增殖活性可靠指标[3]。本实验采用免疫组化SP法检测Bmi-1和PNCA在宫颈不同病变中的表达情况,探讨两者在宫颈癌变过程中的意义及相互作用。
1 资料与方法
1.1 一般资料 所用病例标本搜集甘肃省第三人民医院病理科和兰州大学第一临床医院病理科2011-2013年度已被病理证实的宫颈组织蜡块,其中宫颈正常组(10例)、CIN I组(15例)、CIN II-III组(21例)及宫颈鳞癌组(30例),年龄26~61岁,平均43.5岁(低于40岁的13例,高于40岁的17例),且各标本均未做化学、免疫及放射治疗。临床分期(按国际妇产科联盟FIGO标准分期):I-II期 15例,III-IV期 15例;病理分级:高分化鳞癌10例,中分化鳞癌9例,低分化鳞癌11例;淋巴结有转移12例,淋巴结无转移18例。
1.2 试剂 鼠抗人 Bmi-1 单克隆抗体、鼠抗人 PCNA 单克隆抗体、羊抗鼠IgG、 S-P试剂盒及DAB显色剂均购自购于福州迈新公司。免疫组化SP法严格按照试剂盒要求进行操作,用已知阳性切片作阳性对照,PBS代替第一抗体作阴性对照。其中Bmi-1和PNCA的工作浓度均为1∶50。
1.3 检测标准 Bmi-1阳性表达定位于细胞核和细胞质, 呈棕黄色(见图1~3)。PNCA阳性表达定位于细胞核,呈棕黄色(见图4~6)。空白阴性对照的细胞不显色。根据阳性细胞百分比和染色轻度判断结果:着色强度:无色(-)为0分、浅黄色(+)为1分、黄色(++)为2分、棕色及深棕色 (+++)定为3分;阳性细胞数<10%为0分,10%~25%为1分,26%~50%为2分,>50%为3分。两项相加后分4级:0~1分为(-),2分为(+),3~4分为(++),>5分为(+++)。
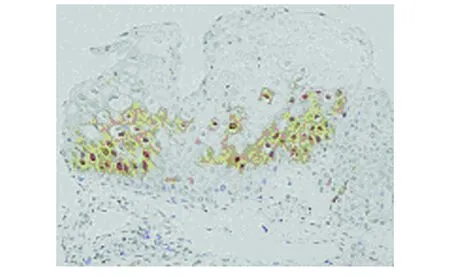
图1 Bmi-1在 CIN I中的阳性表达(SP法,400×)

图2 Bmi-1在 CIN III中的阳性表达(SP法,200×)

图3 Bmi-1在宫颈癌中的阳性表达(SP法,400×)
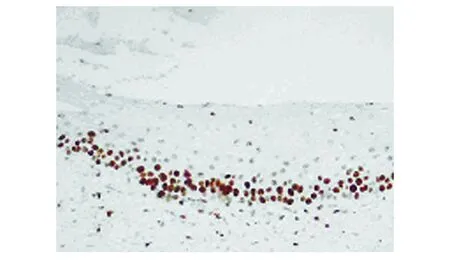
图4 PCNA在 CIN I中的阳性表达(SP法,200×)
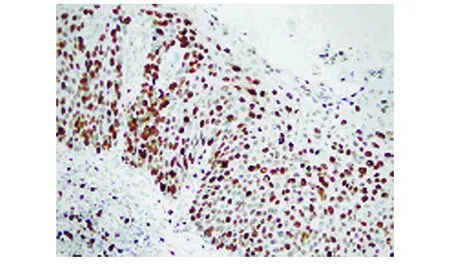
图5 PCNA在 CIN III中的阳性表达(SP法,400×)

图6 PCNA在宫颈癌中的阳性表达 (SP法,400×)
1.4 统计学方法 应用SPSS 13.0软件进行统计学分析,率的比较采用卡方检验或Fisher确切概率法,等级资料采用非参数秩和检验,相关性检验采用Spearman秩相关性分析。以P<0.05为有统计学意义。
2 结 果
2.1 Bmi-1的表达 Bmi-1的阳性表达定位于细胞核和细胞质, 呈棕黄色。 Bmi-1在宫颈正常组,CIN I组,CIN II-III组及宫颈癌组中的阳性表达率逐次呈递增趋势,分别为:0%、13.3%、42.9%、66.7%。四组组间比较,总P<0.05。宫颈癌组阳性表达率比宫颈正常组,CIN I组及CIN II-III组高。其中正常组与CIN I组间比较,差异无统计学意义(P>0.05);其余各组间比较,差异均有统计学意义(P<0.05, 数据见表1)。

表1 Bmi-1在宫颈不同病变中的表达情况 (n,%)
2.2 Bmi-1与临床分期相关性 Bmi-1在宫颈癌中的表达与临床分期相关。I-II期的阳性表达率低于III-IV期的阳性表达率,差异有统计学意义(P<0.05)。有淋巴结转移的阳性表达率高于无淋巴结转移的,差异有统计学意义(P<0.05),但与病理分期和年龄无关(P>0.05)。见表2。

表2 Bmi-1与宫颈癌临床病理关系
2.3 PCNA的表达 PCNA在宫颈正常组、CIN I组、CINⅡ-Ⅲ组及宫颈癌组的阳性表达率分别为10.0%、 46.7%、85.7%、96.7%。宫颈癌组比正常宫颈组、CIN I组及CINⅡ-Ⅲ组阳性表达率高,差异有统计学意义(P<0.05)。其中各组之间比较差异有统计学意义(P<0.05)(表3)。

表3 PCNA在宫颈不同病变中的表达情况 (n,%)
2.4 PCNA阳性表达率相关性 PCNA表达与临床分期、病理分级和有无淋巴结转移有关。III-IV期的阳性表达率高于I-II期的阳性表达率(P<0.05);低分化和中分化的阳性表达率高于高分化组(P<0.05);有淋巴结转移的阳性表达率高于无淋巴结转移的(P<0.05),但与年龄无关(P>0.05)(表4)。

表4 Bmi-1与宫颈癌临床病理关系
2.5 Bmi-1和PCNA在宫颈癌上的相关性 根据我们的数据,在宫颈癌中,Bmi-1和PCNA的表达无相关性。数据结果r<0.001,P=1.000(表5)。

表5 Bmi-1和PCNA在宫颈癌中的表达的相关性
3 讨 论
近年来,宫颈癌的发生率和死亡率虽明显降低,但其的发病率却呈年轻化趋势,且以中晚期患者为多, 预后差[4]。而宫颈癌发生的原因除了与人乳头状瘤病毒感染、多产、初产年龄、性行为、经济状况、吸烟、长期使用避孕药等因素有关外[5],还可能与肿瘤相关基因有密切关系。
人类Bmi-1基因定位于第 10 号染色体短臂1区3带(10p13),含 10 个外显子和 10个内含子,外显子编码含 326 个氨基酸的蛋白质,分子质量为36.9KU[6]。研究发现,Bim-1与多种肿瘤发生相关,其在肿瘤发生中的作用机制是由于它可负性调P16INK4a和P19arf这两种抑癌基因转录产物的表达,从而调节细胞的增殖和衰老,而其在肿瘤中高表达可能与其上调人端粒酶逆转录酶(hTERT)的转录,致使端粒酶活性增高,从而阻止细胞的衰老,导致细胞“永生化”[7-8]。本次研究结果显示:Bim-1的阳性表达率在宫颈病变中依次呈递增趋势,宫颈癌组阳性表达率明显比其他组阳性表达率高,宫颈正常组无阳性表达,且CIN II-III组明显比CIN I组阳性表达率高(P<0.05)。从而可以为上述解释提供参考依据。
另外,III-IV期宫颈癌Bmi-1的阳性表达率明显高于I-II期的阳性表达率(P<0.05);且有淋巴结转移的Bmi-1阳性表达率明显高于无淋巴结转移的阳性表达率(P<0.05)。说明Bim-1阳性表达率的多少除了可提示宫颈病变的严重程度和级别外,还可提示宫颈癌的浸润程度与预后等情况。
PCNA参与真核细胞 DNA合成, 随细胞周期的变化而变化, 是一种评价细胞增殖状态的常用指标[9]。本文结果显示:PCNA在宫颈正常组、CIN I组、CINⅡ-Ⅲ组及宫颈癌组的阳性表达率明显呈递增趋势(P<0.05),且阳性细胞表达百分比显著高于同组Bmi-1的阳性细胞百分比;而PCNA在宫颈癌中的阳性表达率与临床分期、病理分级和有无淋巴结转移均相关, III-IV期宫颈癌PCNA的阳性表达率亦明显高于I-II期的阳性表达率(P<0.05);低分化和中分化的PCNA阳性表达率明显高于高分化组(P<0.05);有淋巴结转移的PCNA阳性表达率明显高于无淋巴结转移的阳性表达率(P<0.05)。
肿瘤的发生、发展由于多因素,多基因共同作用的结果。研究结果提示:Bim-1和PCNA在宫颈病变中的表达情况及与宫颈癌临床特征的关系中表达趋势基本一致,但两者在宫颈癌中的表达率却无相关性(P>0.05)。这也提示我们:Bim-1与PCNA在肿瘤形成过程中可能是独立参与的,原因可能是由于它们不同的作用机制造成的,更深层次的研究两者在肿瘤形成过程中的作用机制及其作用靶点,将是一个新的研究方向。
参考文献
[1] Park I K, Qian D, Kiel M,etal. Bmi-1 is required for maintenance of adult self-renewing haematopoietic stem cells[J].Nature, 2003, 423(6937):302-305.
[2] Honig A, Weidler C, Häusler S,etal. Overexpression of polycomb protein Bmi-1 in human specimens of breast, ovarian, endometrial and cervical cancer[J].AnticancerRes, 2010, 30(5):1559-1564.
[3] Leland H, Michael B K. Cell cycle control and cancer[J].Science, 1994,266(5192):1821.
[4] 倪风云, 张梅月. 子宫颈癌发病年轻化临床回顾性分析[J].实用诊断与治疗杂志, 2004, 18(4):337.
[5] Rostad B, Schei B, Da Costa F. Risk factors for cervical cancer in Mozambican women[J].IntJGynecolObstet, 2003, 80(1): 63.
[6] 高 翔, 张淑兰. Bmi-1基因在妇科肿瘤中的研究进展[J].国际生殖健康/计划生育杂志, 2011, 5(30): 258-261.
[7] Cui H, Hu B, Li T,etal. Bmi-1 is essential for the tumorigenicity of neuroblastoma cells[J].AmJPathol, 2007, 170(4):1370-1378.
[8] Kim R H, Kang M K, Shin K H,etal. Bmi-1 cooperates with human papillomavirus type 16 E6 to immortalize normal human oral keratinocytes[J].ExpCellRes, 2007, 313(3):462-472.
[9] Xu J, Morris G F. P53-mediated regulation of proliferating cell nuclear antigen expression in cells exposed to ionizing radiation[J].MolCellBiol, 1999, 19(1):12-20.

