干旱胁迫对北美红栎幼苗生理特性的影响1)
苏寒之 金建邦 祝遵凌
(南京林业大学,南京,210037)
干旱胁迫对北美红栎幼苗生理特性的影响1)
苏寒之 金建邦 祝遵凌
(南京林业大学,南京,210037)
采用盆栽控水法设置5种干旱胁迫梯度,研究干旱胁迫对1年生北美红栎幼苗生理特性的影响。结果表明:在干旱胁迫下,北美红栎幼苗叶片的叶绿素a和叶绿素b质量分数呈下降趋势,而w(叶绿素a)∶w(叶绿素b)呈现上升趋势,说明叶绿素b比叶绿素a更容易受到破坏。可溶性糖质量分数也呈先升高再降低的趋势。随着干旱胁迫强度的增加及持续时间的延长,在土壤田间持水量15%(W1)和土壤田间持水量30%(W2)梯度下的细胞膜相对透性增大,相对电导率增大,膜脂过氧化产物丙二醛(MDA)质量摩尔浓度增加。同时超氧化物歧化酶(SOD)、过氧化物酶(POD)的活性先升高后下降,而在土壤田间持水量60%(W4)下的各生理生化指标变化趋势不明显。复水后,各指标均基本恢复至对照水平。
北美红栎;干旱胁迫;生理指标
北美红栎(QuercusrubraL.),又名美国红橡树、红槲栎,壳斗科栎属落叶阔叶乔木。原产美国东部及加拿大东南部,分布于亚洲、非洲、欧洲和北美洲。其树形高大,树干笔直,新叶红色,夏季叶片深绿而有光泽,秋季叶色变红,已广泛应用于草地、公园、高尔夫球场和街道两侧[1]。近年来我国开始大量引种栽培北美红栎,用于城市绿化及植被的恢复。目前,国内外关于北美红栎的研究主要集中在引种栽培试验[2-3]、扦插繁殖[4]、生物学、遗传学特性[5-6]及园林用途[7]等方面,而关于抗逆性的研究仅见北美红栎对盐胁迫的响应机制的研究[8-9]。
水分在植物生长、发育的过程中,有着不可替代的重要角色,它是原生质的主要成分、很多代谢的反应物、各种生理生化反应和植物对物质吸收运输的介质。在水分胁迫的情况下,植物各器官的生长发育都受到限制,生理代谢活动在其水分代谢失去平衡的时候而紊乱,严重时会使植物体死亡[10]。我国干旱半干旱地区的面积逐年增加,非干旱区日趋减少的降水量也会加重旱灾的影响。因此,研究植物生长的耐旱特性,尤其是生理生化特性,筛选出抗旱性较强的植物种类,对改善城市生态、干旱地区造林及植被恢复具有重要的意义。本文以1年生北美红栎的幼苗为研究对象,对持续性干旱胁迫期间叶片叶绿素质量分数、可溶性糖质量分数、相对电导率及丙二醛(MDA)质量摩尔浓度及超氧化物歧化酶(SOD)、过氧化物酶(POD)活性的变化进行研究,以探讨北美红栎对干旱胁迫的生理适应性,为北美红栎今后的栽培应用及抗性品种的选育提供理论依据数据。
1 研究区概况
南京市属亚热带季风气候,四季分明,雨量充沛,年平均温度为15.7 ℃,最高气温43 ℃,最低气温-16.9 ℃。年平均降水时间117 d,年降水量1 106.5 mm,年平均风速3.5 m/s,年均相对湿度76%。每年6月下旬到7月中旬为梅雨季节。无霜期237 d左右。
2 材料与方法
2.1 试验处理
将采购于中国林木种子公司的北美红栎种子,于2012年2月进行低温沙藏,3月将种子单粒播试验田内。自播种之日起,进行浇水、除草、施肥等常规田间养护管理。6月将生长良好长势大致一致的北美红栎幼苗移栽到高18 cm、底径8 cm的塑料容器中,V(园土)∶V(泥炭)=1∶1混合后作栽培基质。
干旱处理于2012年7月中旬开始,控水方法采用Hsiao T C的水分梯度法[11],设置5种水分胁迫处理,每个处理3次重复,每重复30株,采用完全随机试验设计方法。测定的田间持水量为23.8%。植物5个水分处理梯度划分为:土壤田间持水量15%(W1);土壤田间持水量30%(W2);土壤田间持水量45%(W3);土壤田间持水量60%(W4)和土壤田间持水量75%(CK)。用称质量法监测土壤含水量,使各处理土壤含水量稳定在设计范围内。控水一周,待土壤水分自然干至设定的标准后,每隔7 d取样低温保存待测,取样时间集中在早上07:00—08:00,采样部位为2~3轮完整的功能叶,擦净表面污物,将样品低温保存。复水处理于持续干旱胁迫28 d后进行。
2.2 生理指标的测定方法
叶片叶绿素的测定参照李合生[12]的方法;可溶性糖质量分数的测定参照邹琦的蒽酮显色法测定[13];叶片原生质膜透性的测定参照谭常[14]的相对电导率方法测定;MDA质量摩尔浓度测定采用硫代巴比妥酸法[15]测定。超氧化物歧化酶活性(SOD)采用氮蓝四唑(NBT)光化还原法测定[13];过氧化物酶(POD)活性的测定采用愈创木酚法测定[12]。
2.3 数据分析
试验数据采用Excel 2007和SPSS18.0进行方差分析和LSD多重比较。
3 结果与分析
3.1 干旱胁迫对北美红栎叶绿素的影响
在植物进行光合作用的时候,叶绿素是参与其中的主要色素,它有吸收光能并将其传递转化成电能的作用。在干旱胁迫下,植株叶面积减少、叶绿素不稳定对植物的光合作用产生很大的影响。同时,叶绿素是叶色的重要组成成分,所以叶片中叶绿素质量分数,对研究植物的生长及光合作用具有重要意义。
由表1—表3可知,随着干旱胁迫的加剧和时间的延长,北美红栎叶片叶绿a和叶绿素b均有明显下降,总体来说叶绿素b的质量分数随干旱胁迫的变化规律与叶绿素a的变化规律基本相似。叶绿素a和叶绿素b在W1、W2、W3梯度下的变化趋势均较显著。第14天叶绿素a比处理前下降了41.3%;叶绿素b比处理前下降了55.9%。叶绿素a和叶绿素b均在干旱胁迫第28 d时达到最低值,在W1、W2、W3、W4的处理下叶绿素a的质量分数比同期对照组下降了44.6%、38.3%、30.6%、18.4%;在W1、W2、W3、W4的处理下叶绿素b的质量分数比同期对照组下降了58.8%、51.8%、38.4%、23.5%。复水时,北美红栎幼苗叶绿素a质量分数均基本恢复正常,而叶绿素b的质量分数在W1梯度下略高。w(叶绿素a)∶w(叶绿素b)出现上升的趋势,说明叶绿素b比叶绿素a更容易受到破坏。同时,在W1、W2、W3梯度下w(叶绿素a)∶w(叶绿素b)也较高,说明北美红栎在受到胁迫时通过提高w(叶绿素a)∶w(叶绿素b)的值以保证对光能的充分利用,提高转化率,增强体内的代谢活动。
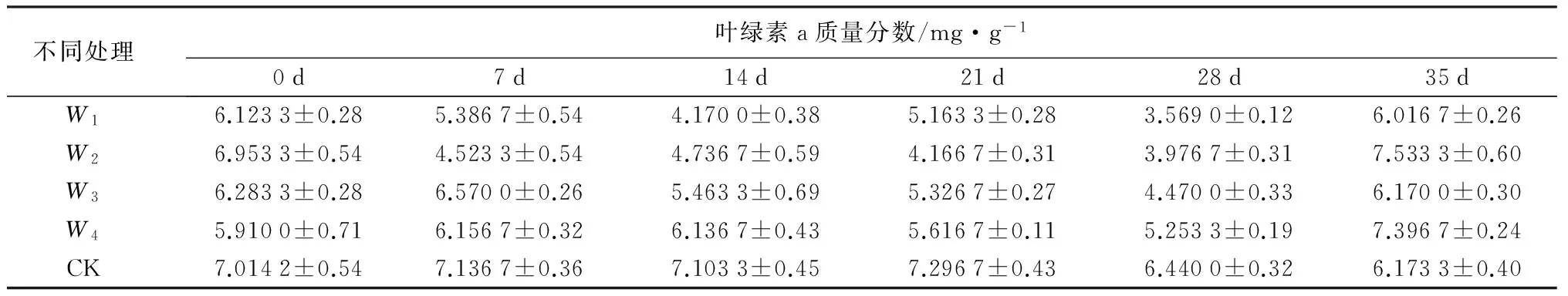
表1 干旱胁迫及复水对北美红栎幼苗叶片叶绿素a质量分数的影响
注:表中数据为平均值±标准差;W1为土壤田间持水量15%;W2为土壤田间持水量30%;W3为土壤田间持水量45%;W4为土壤田间持水量60%;CK为土壤田间持水量75%。
3.2 干旱胁迫对北美红栎可溶性糖的影响
可溶性糖是渗透调节的重要物质之一,干旱胁迫使植物体内可溶性糖大量积累,从而降低细胞体内的渗透势,增加植物的吸水能力,维持细胞膨压、叶片气孔开放以及保证光合作用顺利进行,使植物能够正常生长。
在干旱胁迫下,北美红栎幼苗叶片可溶性糖变化趋势如表4所示。可溶性糖质量分数有明显的上升趋势,在21 d达到峰值再下降。不同梯度的干旱胁迫的可溶性糖质量分数显著高于对照,叶片中的可溶性糖质量分数的积累由大到小程度:W1、W2、W3、W4、CK,可溶性糖的积累主要在干旱胁迫前14天。干旱胁迫处理14 d时北美红栎幼苗叶片可溶性糖分别比处理前上升了62.9%、81.9%、46.2%、16.8%。在可溶性糖积累峰值的第21 d,W1、W2、W3和W4比同组对照组上升了94.9%、69.4%、35.3%、20.8%。在W1梯度下,北美红栎的可溶性糖质量分数变化比较明显,而在W3、W4梯度下,可溶性糖质量分数的趋势变化比较平缓。干旱处理前期,其可溶性糖质量分数变化均不显著,而在胁迫14、21 d各处理之间存在极显著差异(p<0.01)。在胁迫21 d后,北美红栎叶片的可溶性糖有个下降的过程,可能是由于光合速率下降,有机物合成速率降低所致。28 d时W1下降的最为显著,其质量分数只比同期对照组高了33.5%。复水之后,北美红栎叶片可溶性糖恢复到对照组的水平。而对照组在处理期间可溶性糖质量分数变化不明显。

表2 干旱胁迫及复水对北美红栎幼苗叶片叶绿素b质量分数的影响
注:表中数据为平均值±标准差;W1为土壤田间持水量15%;W2为土壤田间持水量30%;W3为土壤田间持水量45%;W4为土壤田间持水量60%;CK为土壤田间持水量75%。

表3 干旱胁迫及复水对北美红栎幼苗叶片w(叶绿素a)∶w(叶绿素b)的影响
注:表中数据为平均值±标准差;W1为土壤田间持水量15%;W2为土壤田间持水量30%;W3为土壤田间持水量45%;W4为土壤田间持水量60%;CK为土壤田间持水量75%。

表4 干旱胁迫及复水对北美红栎幼苗叶片可溶性糖质量分数的影响
注:表中数据为平均值±标准差;W1为土壤田间持水量15%;W2为土壤田间持水量30%;W3为土壤田间持水量45%;W4为土壤田间持水量60%;CK为土壤田间持水量75%。
3.3 干旱胁迫及复水对北美红栎质膜相对透性和丙二醛质量摩尔浓度的影响
质膜相对透性:植物细胞膜有选择透性且对维持细胞内环境的稳定和保持细胞正常代谢有重要的作用。在水分亏缺的情况下,自由基的大量积累引起的膜脂过氧化作用,破坏了细胞膜的结构,使其透性增大后细胞内的电解质外渗,导致植物细胞的相对电导率增大。所以,相对电导率的变化是鉴定植物在逆境胁迫下受伤害的指标之一[16]。
由表5可知,在干旱胁迫下,北美红栎幼苗叶片相对电导率变化呈上升趋势,在W1梯度下变化趋势较明显。在干旱处理14 d时分别比处理前上升了50.6%、51.6%、47.6%、22.2%,此时不同处理对北美红栎叶片相对电导率影响存在极显著差异(p<0.01)。干旱处理第28天时,积累最多的W1和W2分别比处理前上升了59.6%、48.4%。说明W1、W2处理对植物的损伤比较大。从28 d开始复水,其电导率均恢复到正常水平,与同期对照组差别不大,说明北美红栎幼苗叶片的细胞膜透性对水分的亏缺和充足反应灵敏。

表5 干旱胁迫及复水对北美红栎幼苗叶片相对电导率的影响
注:表中数据为平均值±标准差;W1为土壤田间持水量15%;W2为土壤田间持水量30%;W3为土壤田间持水量45%;W4为土壤田间持水量60%;CK为土壤田间持水量75%。
丙二醛(MDA)质量摩尔浓度:植物在水分胁迫下,自身体内活性氧的产生和清除系统的平衡被打破,而发生膜脂过氧化作用,MDA是其最要的产物之一。所以,MDA在细胞内的质量摩尔浓度常会作为判断植物在逆境下膜脂过氧化的重要指标。由表6可知,北美红栎1年生幼苗叶片的MDA质量摩尔浓度随着胁迫程度的增加和时间的延长积累的越多。干旱胁迫14 d时上升趋势最明显,W1、W2、W3、W4分别比处理前上升了42.9%、49.7%、42.3%、31.7%。随着处理的时间越来越长,丙二醛积累的量在28 d达到最高,W1、W2、W3、W4比同组的对照分别上升了37.8%、40.7%、28.4%、19.3%,方差分析表明,不同处理对北美红栎叶片MDA质量摩尔浓度的影响存在极显著差异(p<0.01)。胁迫28 d之后进行了为期一周的复水,复水后的北美红栎小苗MDA基本恢复到胁迫前的质量摩尔浓度。表明干旱胁迫下北美红栎的细胞膜受到活性氧的伤害,其受伤害的程度与干旱的程度和时间的延长有很大关系。

表6 干旱胁迫及复水对北美红栎幼苗叶片MDA质量摩尔浓度的影响
注:表中数据为平均值±标准差;W1为土壤田间持水量15%;W2为土壤田间持水量30%;W3为土壤田间持水量45%;W4为土壤田间持水量60%;CK为土壤田间持水量75%。
3.4 干旱胁迫对北美红栎2种酶活性的影响
3.4.1 SOD酶活性
SOD作为植物体内第一道抗氧化防线,是植物在生长代谢中重要的酶。在干旱胁迫下,酶系统能够清除植物体内积累的多余的自由基,维持活性氧代谢的平衡,从而使植物在一定程度上能够忍耐、减缓或抵抗逆境胁迫[17]。
北美红栎一年生幼苗SOD活性在不同土壤干旱程度和时间延长的情况下的变化趋势如表7所示。W1是土壤水分亏缺最大的情况,其SOD变化的趋势也最显著,前14天上升的十分明显达到了峰值,21 d下降的也最快;W2则在21 d的时候达到峰值,但整体趋势与W1变化的趋势相似;W3和W4则整体趋势都相对平缓。14 d的时候W1与W3达到峰值,其SOD的含量分别比处理前上升了40.4%、60.8%。而在21 d时W2、W4分别达到峰值,其SOD的含量分别比处理前上升了46.5%、27.4%。SOD整体呈先升后下降再上升的趋势,先上升是抵抗干旱胁迫产生的自由基,后期SOD活性降低可能是严重水分胁迫下活性氧产生量高,植株的膜系统受到了伤害,导致保护酶系统失调,而后又通过自身调节作用SOD含量又升高。在21 d的时候,干旱胁迫最严重的W1比14 d峰值下降了53.4%。复水一周后,W3、W4的SOD含量慢慢恢复正常水平,而W1、W2仍明显高于对照组。
3.4.2 POD酶活性
POD是植物体内广泛分布的一种活性氧清除酶,不仅可以催化H2O2分解为H2O和O2,还可以使过氧化物转变为正常的脂肪酸,来缓解脂质过氧化物的积累而引起的细胞伤害[18-19]。因此,POD也是植物体内保护活性氧对细胞膜系统伤害的重要保护酶。
干旱胁迫下北美红栎的幼苗叶片各个处理的POD活性随着干旱程度加剧基本呈上升趋势如表8所示。干旱胁迫开始时与同期对照组变化不大,W1在14 d的时候POD上升幅度最大比对同期照组上升了46.2%,显著高于对照组,但在21 d的时候比14 d下降了22.6%,复水后POD活性上升至于对照组持平。而W2则在干旱胁迫21 d的时候达到峰值,比同期对照组上升了34.2%,存在极显著差异(p<0.01),复水后POD上升可能是由于胁迫的解除使其活性大大提高以清除H2O2避免其进一步对细胞膜系统产生伤害。在W3、W4梯度下的变化趋势较W1、W2梯度下的小,也在胁迫21 d的时候达到峰值,分别比同期对照组上升了20%、8.4%,随后活性又降低。复水之后基本恢复正常水平,其POD的值与对照组基本持平。干旱处理组POD活性在处理期间变化幅度比较大,CK在处理期间变化较小。

表7 干旱胁迫及复水对北美红栎幼苗叶片SOD活性的影响
注:表中数据为平均值±标准差;W1为土壤田间持水量15%;W2为土壤田间持水量30%;W3为土壤田间持水量45%;W4为土壤田间持水量60%;CK为土壤田间持水量75%。

表8 干旱胁迫及复水对北美红栎幼苗叶片POD活性的影响
注:表中数据为平均值±标准差;W1为土壤田间持水量15%;W2为土壤田间持水量30%;W3为土壤田间持水量45%;W4为土壤田间持水量60%;CK为土壤田间持水量75%。
4 结论与讨论
本文对北美红栎一年生幼苗叶片的叶绿素研究表明,叶绿素a和叶绿素b的质量分数有不同程度的下降。这可能是由于在土壤水分亏缺的情况下,叶绿素合成能力下降,也可能是由于植株体内积累大量的H2O2进入叶绿体中而引发其膜脂过氧化,从而损害了叶绿体膜结构和功能,使叶绿素分解较快。叶绿素质量分数的下降也表明植株光合能力下降,同时CO2进入叶片受阻。这与桑子阳[20]等人研究的干旱胁迫对红花玉兰(Magnoliawufengensis)和邹春静[21]等人研究的沙地云杉(Piceamongolica)中的叶绿素质量分数的变化类似。北美红栎叶绿素质量分数与其他抗旱性较弱的树种相比,其降低的幅度相对较小,说明其抗旱性较强。复水之后大量的H2O2被清除且叶绿素的合成能力升高,同时叶绿素的质量分数也升高。在叶绿素下降的情况下,植株的叶色由深绿变成浅绿伴随发黄,但叶色泛黄表现的不明显。在复水之后,叶片的颜色也全部变回到处理前的深绿。
本研究中干旱胁迫使叶片中的可溶性糖大量积累,其积累的量由大到小顺序为W1、W2、W3、W4。随着干旱时间的增加,W1梯度下的可溶性糖增加的幅度也最大,相比较而言W4梯度下的可溶性糖质量分数上升的趋势比较平缓且含量也比在W1梯度下少很多。可溶性糖质量分数的增加是为了维持细胞膨压,使植物能够维持正常的生命活动。夏尚光[22]等人在研究水分胁迫对榆树(Ulmuspumila)幼苗的影响时得出胁迫的时间延长会使可溶性糖质量分数增加。胡晓健[23]等人在研究干旱胁迫对马尾松(Pinusmassoniana)的影响时也得到类似结论。在胁迫第21 d后,北美红栎叶片的可溶性糖有个下降的过程,可能是由于光合速率下降,有机物合成速率降低所致。北美红栎幼苗叶片的可溶性糖质量分数在复水之后恢复至正常值,可能是由于植物体本身比较抗旱。因为如果植株本身的抗旱性较弱,渗透调节有相当大的局限性,它不能完全维持植物的全部生理过程,需要和细胞膜质透性、抗氧化酶等共同作用来调节土壤水分亏缺对植物的伤害,使其能够正常生长。
本试验通过测定土壤在不同干旱梯度下北美红栎叶片相对电导率,比较其膜透性增加的程度,根据差异性来判断不同梯度在胁迫不同时间下幼苗叶片细胞膜稳的定性。北美红栎幼苗叶片的电导率在W1、W2梯度下上升的趋势最显著,说明其膜质透性最大,细胞膜的稳定性最差;W3梯度下的北美红栎的幼苗叶片的电导率也有一定量的积累,程度比在W1梯度下轻;而在W4梯度下,其电导率的上升趋势平缓且不显著,比较而言细胞膜的稳定最好这与陈文荣等[26]研究的蓝莓(Vaccniumuliginosum)对干旱胁迫的响应结论一致。复水之后所有植株的电导率指标都回落到与对照组相平衡的状态则不仅说明复水后植物叶片细胞膜系统得到修复,而且说明北美红栎抗旱性较好。
北美红栎的叶片的丙二醛的质量摩尔浓度与细胞膜相对透性变化的趋势一致。由于干旱胁迫程度的加剧,细胞的膜脂过氧化的程度也加剧,MDA质量摩尔浓度持续积累,导致了膜的结构和稳定性被破坏,膜的透性增加。这与张文辉等[24]研究干旱胁迫对栓皮栎(Quercusvariabilis)保护酶的影响和杨玉珍[25]等干旱胁迫对香椿(Toonasinensis)苗木的影响结果相似。
本研究中SOD活性整体呈先上升后下降再上升的趋势,但在不同土壤含水量的梯度上,其上升的峰值表现在不同的时期。在重度胁迫时间较长的情况下,大量积累的活性氧消耗了SOD,从而使其活性下降,经过植物自身的调节之后,SOD活性又上升。这与刘世鹏[27]等研究的干旱胁迫对枣树(Zizyphusjujuba)幼苗和李云飞等[28]对紫叶矮樱(Prunus×cistenena‘Pissardii’)的抗氧化酶活性的影响的结果相似,整体呈先上升后下降的趋势。北美红栎小苗在复水之后,W1、W2梯度下的SOD的含量仍高于对照组,可能是植物体内的活性氧物质没有完全清除,也可能是由于水分太多导致。而W3和W4梯度下的SOD均回复到原始状态。当然不同的植物SOD活性的变化也不同,抗旱性较弱的植物可能由于干旱胁迫程度较重而导致细胞受损而很难恢复,所以认为北美红栎有一定的抗旱性,其耐旱性与SOD的活性呈正相关。
孙景宽等[29]在研究干旱对沙枣(Elaeagnusangustifolia)幼苗和孙存华等[30]对藜(Chenopodiumalbum)酶活性的影响时,得出POD的活性有先上升再下降的趋势。北美红栎在不同水分胁迫梯度下,其POD的活性在不同时间达到峰值,W1在14 d达到峰值,而W2在21 d达到峰值。复水后的POD基本恢复正常,其中含量比对照组略高的,可能是由于H2O2含量下降所致。POD整体的变化趋势与SOD有协同作用,使活性氧的含量降低,从而植物体可以进行正常的生命活动。在水分胁迫下,保护酶活性的变化因植物种类、胁迫方式、胁迫强度和时间长度的不同而不同,整个保护酶系统抵御干旱的能力也是由几种酶协同作用而决定的。
[1] 罗玉兰,张冬梅.优良彩叶树北美红栎[J].园林,2006(2):33.
[2] 黄利斌,李晓储,朱惜晨,等.北美栎树引种试验研究[J].林业科技开发,2005,19(1):30-34.
[3] 乔艳辉,王太明,吴德军,等.北美红栎的播种育苗技术及园林应用[J].山东林业科技,2007(1):80-80.
[4] 丁彤,黄成林.北美红栎扦插繁殖技术的研究[J].安徽农业大学学报,2012,39(4):507-513.
[5] Daubree J B. Genetic and phenological differentiation between introduced and natural population ofQuercusrubra[J]. Ann For Sci,1993,50:271-280.
[6] Kremer A, Petit R J. Gene diversity in natural populations of oak species[J]. Ann For Sci,1993,50:186-202.
[7] 吴媛,包志毅.栎属植物资源及其在园林中的应用前景[J].北方园艺,2008(7):174-177.
[8] 王改萍,朱振贤,彭方仁.盐胁迫对7种造林树种生长量及生理特性的影响[J].江西农业大学学报,2008,30(6):1066-1072.
[9] 彭方仁,朱振贤,谭鹏鹏,等.NaCl胁迫对5个树种幼苗叶片叶绿素荧光参数的影响[J].植物资源与环境学报,2010,19(3):42-47.
[10] 胡新生,王世绩.树木水分胁迫生理与耐旱性研究进展及展望[J].林业科学,1998,34(2):77-89.
[11] Hsiao T C. Plant responses to water stress[J]. Annual Review of Plant Physiology,1997,24:519-570.
[12] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[13] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[14] 谭常.电解质外渗百分率的测定[M]//上海植物生理协会.植物生理实验手册.上海:上海科学技术出版,1985.
[15] 张志良,翟伟菁. 植物生理学实验指导[M].3版.北京:高等教育出版社,2003.
[16] 周静,汪天,崔键,等.红壤水分条件对柑橘叶片质膜透性以及活性氧代谢和保护酶活性的影响[J].土壤,2009,41(2):236-242.
[17] McCord J M, Fridovich I. Superoxide dismutase an enzymic function for erythrocuprein (hemocuprein)[J]. J Biol Chem,1969,244(22):6049-6055.
[18] Peng M, Kuc J. Peroxidase generated hydrogen peroxide as a source of antifungal activity in vitro and on tobacco leaf disks[J]. Physiology and Biochemistry,1992,82:696-699.
[19] Martinez C, Baccou J C, Bresson E, et al. Salicylic acid mediated by the oxidative burst is a key molecule in local and systemic responses of cotton challenged by an avirulent race ofXanthomonascampestrispvmalvacearum[J]. Plant Physiology,2000,122(3):757-766.
[20] 桑子阳,马履一,陈发菊.干旱胁迫对红花玉兰幼苗生长和生理特性的影响[J].西北植物学报,2011,31(1):109-115.
[21] 邹春静,韩士杰,徐文铎,等.沙地云杉生态型对干旱胁迫的生理生态响应[J].应用生态学报,2003,14(9):1446-1450.
[22] 夏尚光,张金池,梁淑英.水分胁迫下3种榆树幼苗生理变化与抗旱性的关系[J].南京林业大学学报:自然科学版,2008,32(3):131-134.
[23] 胡晓健,喻方圆,刘建兵,等.干旱胁迫对不同种源马尾松苗木针叶内可溶性糖含量的影响[J].南京林业大学学报:自然科学版,2009,33(5):55-59.
[24] 张文辉,段宝利,周建云,等.不同种源栓皮栎幼苗叶片水分关系和保护酶活性对干旱胁迫的响应[J].植物生态学报,2004,28(4):483-490.
[25] 杨玉珍,彭方仁,岑显超,等.干旱胁迫下不同种源香椿苗木的生理生化变化[J].南京林业大学学报:自然科学版,2008,32(1):24-28.
[26] 陈文荣,曾玮玮,李云霞,等.高丛蓝莓对干旱胁迫的生理响应及其抗旱性综合评价[J].园艺学报,2012,39(4):637-646.
[27] 刘世鹏,刘济明,陈宗礼,等.模拟干旱胁迫对枣树幼苗的抗氧化系统和渗透调节的影响[J].西北植物学报,2006,26(9):1781-1787.
[28] 李云飞,李彦慧,王中华,等.土壤干旱胁迫及复水对紫叶矮樱生理特性的影响[J].河北农业大学学报,2008,31(6):78-82.
[29] 孙景宽,夏江宝,田家怡,等.干旱胁迫对沙枣幼苗根茎叶保护酶系统的影响[J].江西农业大学学报,2009,31(5):879-884.
[30] 孙存华,李扬,贺鸿雁,等.藜对干旱胁迫的生理生化反应[J].生态学报,2005,25(10):2556-2561.
Effects of Drought Stress on Physiological Characteristics ofQuercusrubraSeedlings/
Su Hanzhi, Jin Jianbang, Zhu Zunling
(Nanjing Forestry University, Nanjing 210037, P. R. China)//Journal of Northeast Forestry University.-2014,42(8).-34~39
With five levels of drought stress, we investigated the effects of drought on physiological characteristics on one-year-old potted seedlings ofQuercusrubra. The contents of chlorophyll a and b were downtrend, while the ratio of chlorophyll a and b was increasing trend. Chlorophyll b was easier to damage than chlorophyll a. The soluble sugar contents showed the trend of increasing firstly and then reducing again. With the increasing of drought stress intensity and duration extension, the relative permeability of cell membrane, relative conductivity and malondialdehyde (MDA) of the membrane lipid peroxidation product increased at W1 and W2 levels. While the superoxide dismutase (SOD) and peroxidase (POD) activity increased firstly and then decreased, but the variation tendency of every physiological and biochemical indicators was not obvious at W4 levels. Each index recovered to the control level after rewatering.
QuercusrubraL.; Drought stress; Physiological characteristics
1) 江苏省“青蓝工程”资助项目;江苏高校优势学科建设工程资助项目(PAPD)。
苏寒之,女,1987年3月生,南京林业大学风景园林学院,硕士研究生。
祝遵凌,南京林业大学艺术设计学院,教授。E-mail:zhuzunling@aliyun.com。
2013年10月18日。
S718.43
责任编辑:潘 华。

