加拿大杨茎段愈伤组织诱导及不定芽分化研究
花阳景,林碧瑜,张智勇,游佳琪,刘希华
(三明学院资源与化工学院,福建 三明 365004)
加拿大杨茎段愈伤组织诱导及不定芽分化研究
花阳景,林碧瑜,张智勇,游佳琪,刘希华
(三明学院资源与化工学院,福建 三明 365004)
以加拿大杨茎段为外植体探讨不同激素处理对愈伤组织诱导及不定芽形成的影响。研究表明,在外植体消毒中,以0.1%升汞处理4.5m in时间效果最好,以MS培养基+0.15mg·L-1TDZ+0.1mg·L-1NAA+1.0mg·L-16-BA的愈伤组织诱导率最高达60%。丛生芽诱导最佳培养基为MS培养基+0.15mg·L-1TDZ+0.125mg·L-1NAA+1.25mg·L-16-BA,丛生芽诱导率达86.7%。
加拿大杨;愈伤组织;不定芽;组织培养
加拿大杨(Populus canadensis Moench)又称加杨、欧美杨,属于杨柳科(Salicaceae),是美洲黑杨和欧洲黑杨杂交种。其生长迅速,繁殖容易,适应性较强,既可以成片造林,又能做“四旁”栽植,全国各地均有种植,生长快速[1]。木材质软而轻,是优良的纤维用材树种[2],因其树冠阔,叶片大而有光泽,宜作行道树、庭荫树、公路树及防护林等,又因其孤植、列植均适宜,故是常见的绿化树种,也是“四旁”绿化和营造农田林网的重要树种之一[1]。近年来,加拿大杨应用前景看好,但是由于受到母种材料的短缺,还有繁殖季节较短的限制,常规的扦插繁殖已经很难满足生产中对种苗的需求。在全国范围内的退耕还林及退耕还草的形势下,加拿大杨已经呈现出供不应求的趋势。加拿大杨的组培再生体系的研究却未见报道。本研究是通过对加拿大杨茎段的愈伤组织诱导和不定芽的分化研究,目的是解决加拿大杨在生产中种苗不足的问题,加速实现加拿大杨工厂化育苗,完善加拿大杨的组培快繁体系。同时通过愈伤组织的诱导分化研究,为加拿大杨的遗传改良和遗传转化等研究工作奠定基础。
1 材料与方法
1.1 试验材料
试验材料来自于三明学院的加拿大杨树上当年生枝条。
1.2 试验方法
1.2.1 外植体处理与培养
2012年8月~10月之间,选取三明学院的加拿大杨当年生枝条,于中午时分,采取健康的枝条,从自茎尖开始剪成约2 cm左右的茎段。外植体处理的过程是:洗洁精洗净,浸泡30 min→0.1%的多菌灵浸泡3 0min→流水冲洗2.0 h→75%酒精处理30 s→0.1%升汞溶液处理→无菌水冲洗5遍。
接种时,将芽以形态学下端接入培养基,芽原基接触培养基。每瓶植入一个芽段。做好标记,放在培养室中培养,光强2000 lx,光照时间12h·d-1,温度(25±1)℃。每隔2~3 d观察一次,清出污染的组培瓶以减少污染,观察记录结果。
1.2.2 升汞处理对外植体诱导的影响
为比较0.1%升汞的处理时间对外植体的影响,采用4种升汞处理时间(2.5,3.5,4.5,5.5min)。每个处理20瓶,3次重复。
1.2.3 愈伤组织诱导培养基的选择
将茎段接种到以MS为基本培养基,以NAA、6-BA、TDZ 3种不同浓度的激素组合做为探讨因素,激素配比采用L9(34)正交试验设计,设计如表1,培养基中含3%的蔗糖、8 g的琼脂,pH值为6.0。每组处理20瓶,3次重复,1个月后观察愈伤组织生长情况并统计诱导率。

表1 茎段愈伤组织诱导培养因素与水平表
1.2.4 丛生芽的诱导与分化
以MS为基本培养基,加入0.15 mg·L-1TDZ、3%的蔗糖和8g的琼脂,pH值为6.0。以双因素完全随机设计来分析6-BA(0.75、1.25mg·L-1)和NAA(0.075、0.125 mg·L-1)两种浓度的激素组合对不定芽分化的影响。将大小相近的愈伤组织分别接在4种培养基上,每个处理接种30块愈伤组织,3次重复。每隔一个月继代一次。30 d后观察愈伤组织和丛生芽生长状况,统计各处理丛生芽诱导率。
1.3 统计方法与数据分析
观察愈伤组织及丛生芽产生的时间,愈伤组织以及丛生芽生长状况,形态以及颜色等。对相关试验结果统计,拍照。统计愈伤组织诱导率,丛生芽诱导率。
出愈率(%)=产生的愈伤组织数/接种的外植体数×100
丛生芽诱导分化率(%)=丛生芽分化数/转接愈伤组织数×100
芽分化数=丛生芽个数/转接愈伤组织数
采用唐启义的DPS数据处理系统统计分析数据[3]。

表2 升汞处理时间对出愈率的影响
2 结果与分析
2.1 升汞消毒处理时间对出愈率的影响
升汞的处理时间对外植体的生长会产生一定的影响,假如处理时间过长,外植体会受到伤害甚至是死亡,处理时间过短则杀菌消毒不彻底,外植体在培养过程中容易染菌。结果表明,第1(2.5 min)与第2(3.5 min)处理组大部分为细菌污染,第3(4.5 min)与第4(5.5 min)处理组则多为真菌污染。由表2可以得当0.1%升汞的时间超过5.5 min后,无菌率明显提高,消毒效果明显,但出愈率则相对最低,说明外植体开始受到升汞的毒害作用。但随着0.1%升汞处理时间的减少,无菌率也相对降低,这样出愈率也较低。综合0.1%升汞的不同处理时间的无菌率和出愈率,发现第3处理组即0.1%升汞处理4.5 min,无菌率相对较高,达到70%,出愈率也达到60%。
升汞处理时间低于3.5 min,外植体所引起的污染多是细菌所引起的污染,外植体杀菌时间不够彻底。在4.5 min这段时间内,灭菌效果则较好,污染率低,出愈率超过5.5 min,因此0.1%升汞处理时间以4.5 min为最佳。
2.2 不同激素配比对愈伤组织诱导研究
采用正交试验来分析不同的激素种类与浓度对愈伤组织诱导的影响。诱导结果如表3。

表3 不同激素浓度对愈伤组织诱导的影响
由表3的统计结果可以看出,茎段愈伤组织所用的三种植物激素6-BA,NAA,TDZ不同配比的培养基中,茎段愈伤组织最高诱导率可以达到60.0%。因此,对于茎段外植体的最佳诱导培养基为MS培养基+1.0mg·L-16-BA+0.1mg·L-1NAA+0.15mg·L-1TDZ,长出的愈伤组织如图1和图2,大小约为3.30cm2,为嫩绿色,致密状愈伤组织,在转接培养后,调整激素后,能诱导出不定芽。而第1组即,MS培养基+0.5mg·L-16-BA+0.05mg·L-1NAA+0.05mg·L-1TDZ,愈伤组织诱导率仅16.7%,而且面积也比较小,大小仅2.53 cm2,且为土黄色,絮状,在经过转接培养2个月后,愈伤组织逐渐消亡。

表4 方差分析表
对正交试验的各因素进行分析,K代表每个因素试验结果的总和,从表3中的K值大小可以看出,愈伤组织诱导培养中的各因素最优组合是A2B2C3,而这一组合正好在这个正交试验表中出现,即MS培养基+1.0mg·L-16-BA+0.1mg·L-1NAA+0.15mg·L-1TDZ。从R值(代表每个因素3个水平的K值的全距)大小可以看出,3个因素对出愈率影响的主次关系为:C→A→B,各处理的较优因子依次为:C3,A2,B2。同时本研究对出愈率进行方差分析(表4),仅C因素(TDZ)达到显著。

图1 愈伤组织诱导

图2 愈伤组织诱导
2.3 不同激素浓度对丛生芽诱导分化培养
由表5可知,对于加拿大杨通过愈伤组织进行丛生芽的诱导培养中,第4处理组的丛生芽诱导率最高,高达86.7%,且丛生芽长较好(图4)。培养基为MS培养基+0.15mg·L-1TDZ+1.25mg·L-16-BA+0.125mg·L-1NAA。愈伤组织接种于分化培养基15d后,愈伤组织上长出嫩绿的小芽,愈伤组织整体变得更致密,基部靠近培养基的部分变红,如图3。经过1个月的培养后,芽开始生长分化,芽生长最高为2.5 cm,如图4。对双因素进行方差分析(表6),结果表明,NAA因素达到显著差异,而6-BA则不显著。
表5 激素浓度对丛生芽的诱导分化培养

表6 方差分析表
3 讨论
在普通的自然条件下,在8~10月份进行外植体取材,其组织培养的污染率低[4]。同时,采取外植体时必须保证前3 d以上的天气晴朗,避免雨天所带来的真菌,细菌污染。本研究通过0.1%升汞不同消毒时间,得出0.1%升汞时间在4.5 min时,无菌率相对较高,达到70%,出愈率也达到60%。
以茎段为外植体的愈伤组织诱导分化培养中,最佳培养基为MS培养基+1.0mg·L-16-BA+0.1mg·L-1NAA+0.15mg·L-1TDZ,长出的愈伤组织大小约为3.30 cm2,为嫩绿色,致密状愈伤组织,在转接培养后,调整激素后,能诱导分化出不定芽。作为建立再生体系的前提及基础,愈伤组织的诱导非常关键。其形成一般分为3个阶段:诱导期、分裂期和形成期[5]。加拿大杨茎段则采用6-BA、NAA以及TDZ 3种激素搭配诱导愈伤组织的产生,NAA能够诱导茎段脱分化形成愈伤组织,形成绿色致密状的愈伤组织,加入TDZ可促进丛生芽的分化,形成的芽体生长迅速。TDZ是一种新型具有细胞分裂素活性的一类物质,是一种苯基脲衍生物,商品名为塞苯隆。在各种细胞分裂素类物质当中,TDZ的作用最明显,通常最小的用量就能起到明显的效果[6]。
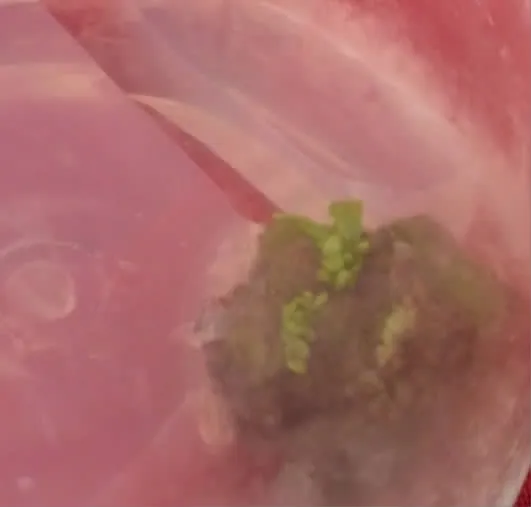
图3 不定芽诱导分化

图4 不定芽诱导分化
在加拿大杨丛生芽的诱导培养中,采用MS+0.15mg·L-1TDZ+1.25mg·L-16-BA+0.125mg·L-1NAA这个配比的培养基丛生芽诱导率最高,高达86.7%,且丛生芽生长较好。在6-BA、NAA以及TDZ的协调作用下,成功诱导出丛生芽。器官的形成是由生长素与细胞分裂素的相互之间的比率所决定的,不是由绝对物质浓度决定的[5]。同时,在加拿大杨丛生芽芽诱导过程中,低浓度的TDZ也起到了促进作用。贾小明等人[7]在新疆杨(P.alba L.var.pyramidais)和河北杨(P.hopeiensis Huet Chow)茎段再生过程中都发现了TDZ的浓度对丛生芽分化有重要影响。较低浓度的TDZ有利于丛生芽的分化,较高浓度的TDZ则抑制丛生芽的分化。
[1]王金华.加拿大杨栽培技术及应用[J].现代农村科技,2013(17):55.
[2]C XU E,黄海,夏新兴.加拿大杨木P-RC APMP浆及其漂白硫酸盐浆的协同效应[J].国际造纸,2006,25(6):16-19.
[3]唐启义,冯明光.实用统计分析及其DPS数据处理系统[M].北京:科学出版社,2002:49-265.
[4]刘希华,曾淑兰,丁昌俊,等.雷公藤以芽繁芽组织培养研究[J].西南林学院学报,2009,29(1):35-38.
[5]刘希华,毛玲榕,邢建宏.雷公藤愈伤组织诱导与悬浮培养不定芽诱导[J].三明学院学报,2010,27(6):577-580.
[6]王关林,方宏筠.高活性细胞激动素TDZ在植物组织培养中的应用[J].植物学通报,1997,16(1):77-80.
[7]贾小明,樊军锋,王娟娟.河北杨和新疆杨离体叶片诱导不定芽研究[J].西北农林科技大学学报:自然科学版,2006,34(12):109-115.
(责任编辑:朱联九)
Callus Induction and Adventitious Bud Regeneration from the Stem of Populus Canadensis
HUA Yang-jing,LIN Bi-yu,ZHAN Zhi-yong,YOU Jia-ji,LIU Xi-hua
(College of Resources and Chemical Engineering,Sanming University,Sanming 365004,China)
Taking the stem of Populus canadensis as amaterial,the effect for callus induction and bud differentiation w ith different phytohormone was studied.The result showed that the time effect for the explants dealing w ith 0.1%Hgcl2 about 4.5 m in was the best.Themost suitable formula for induction of callus was MS+0.15mg·L-1TDZ+0.1mg·L-1NAA+1.0mg·L-16-BA,callus induction rate was 60%.Themost suitable formula for shoot-inducing medium was MS+0.15mg·L-1TDZ+0.125mg·L-1NAA+1.25mg·L-16-BA,Multiple shoot clumps induction ratewas86.7%.
Populus canadensis;callus;adventitiousbud;tissue culture
S792.112
A
1673-4343(2014)02-0079-05
2014-01-20
福建省大学生创新项目(201311311024);福建省科技厅重点项目(2011N 0030);福建省教育厅科技项目(JA11249)。
花景阳,男,福建安溪人,大学生。通讯作者:刘希华,男,福建闽清人,博士,副教授。研究方向:生物技术。

