响应面法优化紫苏多糖的水提工艺
,*
(1.黑龙江大学生命科学学院微生物黑龙江省高校重点实验室,黑龙江哈尔滨 150080;2.黑龙江大学生命科学学院食品科学与工程系,黑龙江哈尔滨 150500)
紫苏,别名赤苏、白苏、香苏等,学名Perilla frutescens,为唇形科一年生草本植物,具有特异的芳香,原产中国,我国华北、华中、华南、西南地区均有野生种和栽培种[1]。据医学临床研究,其茎、叶及种子可入药;茎叶有镇痛、镇静[2]、解热作用,可治疗感冒、缓解鱼蟹中毒等[3]:种子(果实)有镇咳、祛痰、平喘及发散精神沉闷之效[4]。近些年来,紫苏因其特有的活性物质及营养成分,在抗凝血、抗血栓、调血脂、调节免疫功能、抗肿瘤、抗氧化等方面都具有显著的药理作用[5-7],而且紫苏油中还有大量的α-亚麻酸,成为一种备受世界关注的活性物质[8],经济价值十分显著。俄罗斯、日本、韩国、美国、加拿大等国对紫苏属植物进行了大量的商业性栽种,开发出了食用油、药品、淹渍品、化妆品等几十种紫苏产品[9]。迄今为止,国内外对于紫苏籽的利用多用于产品开发,而对活性物质的提取研究却鲜见报道。
本实验利用微波提取速度快的特点,对微波法水提紫苏籽中的多糖进行了研究,为紫苏多糖的进一步研究奠定了理论基础。
1 材料与方法
1.1 材料与仪器
紫苏籽:哈尔滨市同泰药店。
甲醇、氯仿、无水乙醇、葡萄糖、苯酚、浓硫酸:天津市科密欧化学试剂有限公司,分析纯;WG800微波炉:中国格兰仕微波炉电器有限公司;UV 1810紫外分光光度计:中国普析通用仪器有限公司;H-1650台式离心机:湖南湘仪离心机有限公司;WND-200中药粉碎机:浙江伟能达有限公司。
1.2 方法
1.2.1 紫苏籽的预处理
由于紫苏籽中含有较多油脂,为了减小油脂对多糖提取率的影响,首先要进行预处理去除油脂。方法是将紫苏籽称重后粉碎,加入石油醚150 mL、水100 mL浸泡紫苏粉末,静置4 h后分层,上层为石油醚提取液,下层为含水的脱脂紫苏。
1.2.2 多糖含量的测定
多糖含量的测定采用苯酚-硫酸法[10]。得到线性回归方程Y=0.015X-0.033,R=0.994,葡萄糖标准溶液浓度为0.4 mg/mL。
1.2.3 紫苏多糖提取率的单因素实验
紫苏多糖提取单因素试验过程中,微波功率设5个水平分别为 800、640、480、320、160 W,微波提取时间设 5 个水平分别为 0.5、1.0、1.5、2、2.5 min,液料比设 5个水平分别为 10 ∶1、15 ∶1、20 ∶1、25 ∶1、30 ∶1,分别进行单因素试验测定紫苏多糖提取率,每个试验均设3个重复,取平均值。微波功率的设定参考牟番松等方法[11] 。
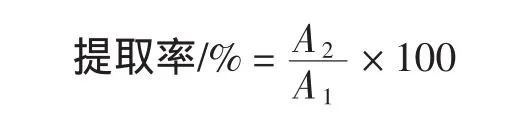
式中:A1为紫苏籽鲜质量;A2为紫苏多糖干质量。
1.2.4 响应面法对微波提取条件的优化
综合单因素试验结果,参照张大皓等[12]方法,通过Plackett-Burman试验统计分析,确定试验的主因素和后续实验的中心点条件,然后在最陡爬坡实验的基础上,设计实验因素及水平,应用Box-Behnken中心组合进行三因素三水平的试验设计(取a=2),通过响应面法对紫苏籽中多糖的微波提取条件进行优化。
1.3 数据统计分析
利用Design Expert7.0软件中的多元线性回归分析程序,拟合二阶多项式方程。并对回归方程的系数进行显著性比较(F检验),研究微波功率及提取时间,液料比对紫苏多糖提取率的影响,再根据响应面数据分析优化提取率。
2 结果与讨论
2.1 紫苏多糖提取率的单因素实验
2.1.1 液料比对紫苏多糖提取率的影响
选取微波功率为640 W,提取时间为2 min,选择5种不同的液料比,结果(如图1)所示,随着液料比的增大,提取率会明显的提高,但当液料比大于25∶1时,紫苏多糖提取率增加的幅度不大,而且由于液料比过大会造成溶剂用量显著增加,因此,本试验选择液料比为25∶1。
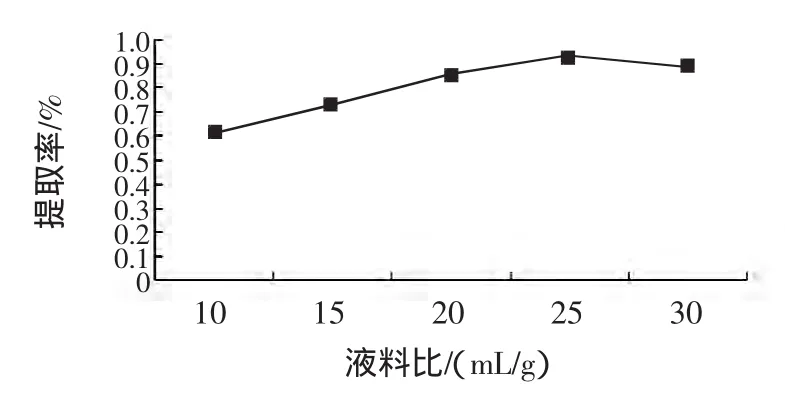
图1 不同液料比对提取率的影响Fig.1 Effect of liquid/material ratio on the extraction ability
2.1.2 微波功率对紫苏多糖提取率的影响
选取液料比为25∶1(mL/g),微波提取时间2 min,考察5种不同微波功率的影响,结果(如图2)所示,改变微波功率对紫苏多糖提取率影响较大。紫苏多糖随着微波功率的增加呈现一个先上升后下降的趋势。根据姚菁华等[13]的分析,微波加热使细胞内液态水气化产生压力,冲破细胞膜和细胞壁形成微小孔洞,有利于细胞内紫苏多糖的溶出;微波功率过大,细胞受热加剧,部分紫苏多糖的结构会破坏。故本试验选择提取微波功率为480 W左右。
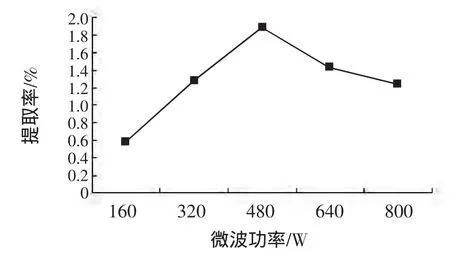
图2 不同微波功率对提取率的影响Fig.2 Effect of mircowave power on the extraction ablity
2.1.3 微波提取时间对紫苏多糖提取率的影响
选定液料比为25∶1(mL/g),微波功率为480 W,考察5种不同微波提取时间的影响。结果(如图3)所示,在1.5 min内随着提取时间的延长,提取率随之增加。1.5 min后紫苏多糖得率出现缓慢下降,这主要是由于微波在1.5 min内对细胞膜的破坏作用较大,溶出物多,提取率也高。超过1.5 min后,紫苏多糖提取率呈下降趋势,因此选择微波提取时间为1.5 min左右。
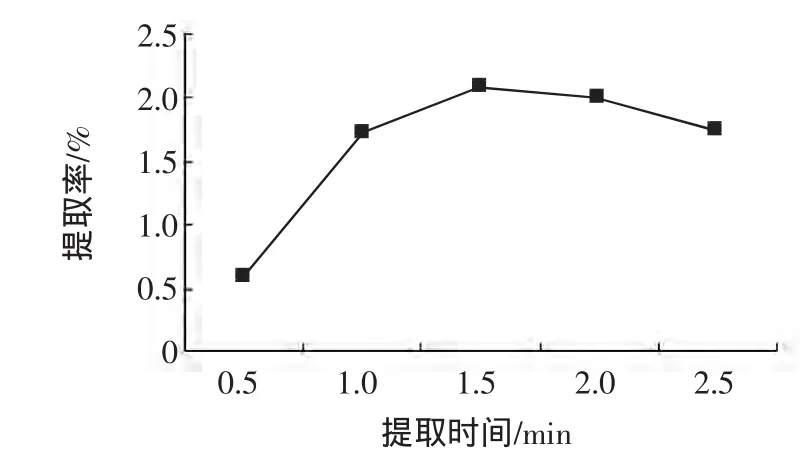
图3 不同提取时间对提取率的影响Fig.3 Effect of extracting time on the extraction ability
2.2 响应面试验设计方案
首先,在单因素试验基础上,以紫苏多糖提取率(Y)为响应值,进行分式析因设计,确定了提取率的主要影响因子为液料比,达到了极显著的水平,用最陡爬坡路径逼近最大响应区域实验,采用Design expert程序中心组合试验分析法(Box-Behnken)设计试验,以 X1=(Z1-480)/160,X2=(Z2-1.5)/0.5,以 X3=(Z3-25)/5为自变量,实验因素水平见表1。响应面分析实验中17个试验点分为两类:其一是析因点,自变量取值在X1、X2、X3所构成的三维顶点,共有12个析因点;其二是零点,为区域中心点,零点试验重复5次,用来估计试验误差,响应面分析方案及实验结果见表2。
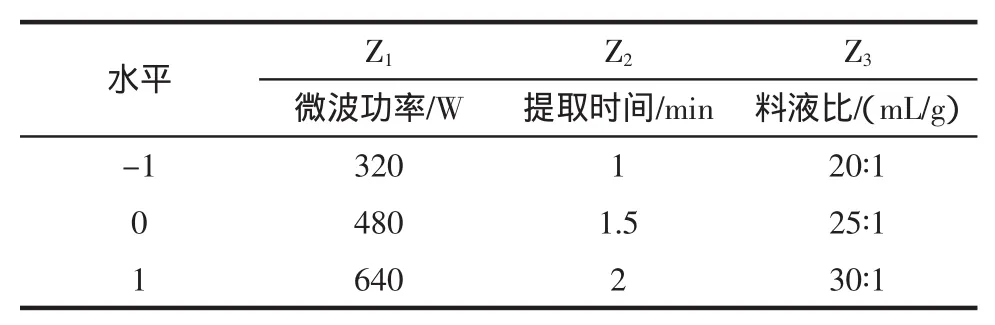
表1 分析因子及水平表Table 1 Levels and factors of analysis

表2 响应面分析方案与试验结果Table 2 The experiment design and results of RSM
2.3 响应面试验数据处理分析
利用Design expert软件对表2数据进行回归拟合分析,分析结果如表3。经回归拟合后,确立如下回归方程预测模型:
Y(%)=-10.9+0.018 7 X1+4.72X2+0.402 X3-0.001 59X1X2+0.000 046 9X1X3-0.014X2X3-0.000 020 6X12-1.14X22-0.007 58X32

表3 回归分析结果Table 3 Results of regression analysis
从表3中可以看出,此模型P<0.05,响应面回归模型达到显著水平。影响紫苏多糖提取率的因素主次因素为 X3>X1>X2,模型中 X1X2、X12、X22和 X32对提取率的影响极显著(P<0.05)。从该模型的R2=0.969来看,此模型与实际试验拟合较好,可用该回归方程代替试验真实点对实验结果进行分析,但是试验失拟性小于0.1,说明实验数据与模型存在不相符的区域,会造成模型部分区域拟合失真。
2.4 交互作用分析
为进一步考察3个因素两两之间交互作用对紫苏多糖提取率的影响,对其响应面曲线进行分析。图4(A)、(B)、(C)直观的给出了两两因素交互作用对提取率影响的响应面图。可以看出,X1(微波功率)对响应值的影响较大,表现为曲线比较陡,这与回归分析的结果吻合。
2.4.1 微波功率和提取时间的交互作用
由图4可知,响应曲面的坡度相对平缓,表明响应值(提取率)对微波功率和提取时间的改变并不那么敏感,但是可以看出在响应面有两个角坡度较陡,说明微波功率和提取时间的适宜范围较窄,大致可以看出,当微波功率在360 W~580 W,提取时间在1.12 min~1.81 min之间时对提高提取率最有利,其预测提取率为1.97%。
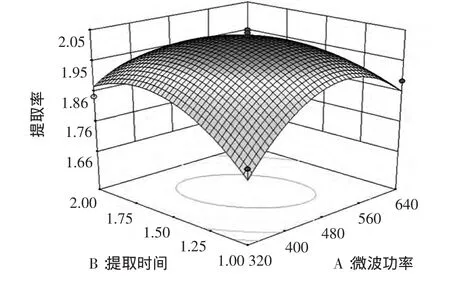
图4 紫苏多糖提取率与微波功率和提取时间之间的响应面图Fig.4 The peak response area of the interactive effects of microwave power and duration time on the extraction ability of polysaccharide
2.4.2 微波功率和液料比的交互作用
由图5可知,响应曲面的坡度相对较陡,表明响应值(提取率)对微波功率与液料比的变化较敏感。从响应曲面可以看出,液料比变化对紫苏多糖提取率的影响更大,当微波功率在360 W~580 W、液料比在23.7~30之间对提高提取率最有利,提取率预测值为2.0%。
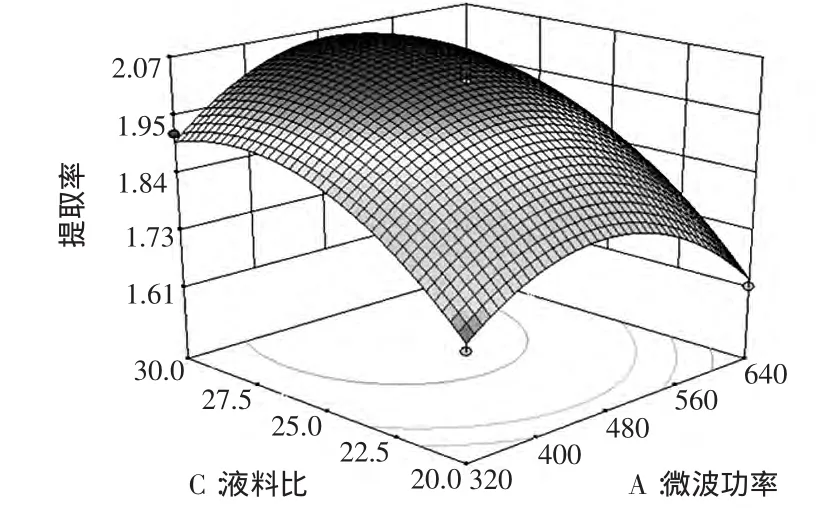
图5 紫苏多糖提取率与微波功率和液料比之间的响应面图Fig.5 The peak response area of the interactive effects of microwave power and liquid/material ratio on the extraction ability of polysaccharide
2.4.3 提取时间和液料比的交互作用
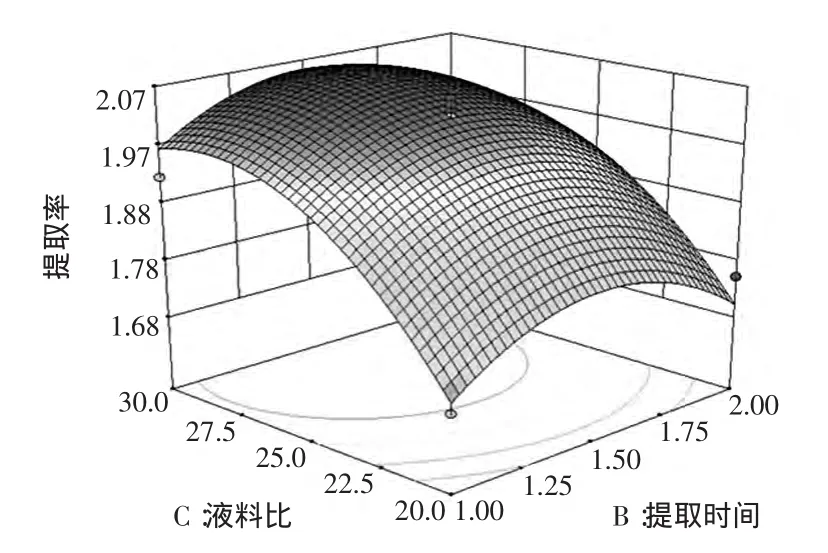
图6 紫苏多糖提取率与提取时间和液料比之间的响应面图Fig.6 The peak response area of the interactive effects of duration time and liquid/material ratio on the extraction ability of polysaccharide
由图6可知,响应曲面坡度相对较陡,表明响应值(提取率)对提取时间和液料比的交互作用较敏感。从等高线看,液料比的变化对响应值的影响较大。当提取时间在1.12 min~1.81 min、液料比在23.7~30之间时对提高提取率最有利,提取率预测值为2.01%。
2.5 最优工艺参数的验证
由Design expert分析,最大响应值(Y)=1.99时,X1,X2,X3对应的编码值分别为 X1=610,X2=1.31,X3=28.5,说明紫苏多糖的最佳提取条件为:微波功率610 W,微波提取时间 1.31 min、液料比 28.5∶1,紫苏多糖的提取率为1.99%。在最佳提取工艺条件下进行提取验证试验,重复3次,取平均值,紫苏多糖的提取率为2.02%,与优化目标值非常接近。
3 结论
采用响应面分析法对紫苏籽中多糖的水提工艺进行了优化,首先运用Placket-t Burman法确定出液料比为最重要的影响因素;然后通过最陡爬坡实验确定了因素水平,最后采用Box-Behnken设计和SAS软件分析确定了最优的提取工艺为:微波功率610 W,微波提取时间1.31 min,液料比28.5∶1,紫苏多糖的提取率为1.99%。而朱建飞等[14]利用传统正交试验方法得到的紫苏多糖提取率最大为8.6%,提取时间为4 h,这比本实验的提取率时间长,改用微波提取方法后,提取时间大大缩短,但提取率降到1.99%,降低了不少。曾哲灵等[15]通过响应面法优化了玫瑰茄红色素的提取工艺,张君萍等[16]利用响应曲面法优化沙葱籽多糖提取工艺,都取得了不错的试验效果。本试验通过响应面法优化紫苏多糖的提取率,同样取得了优化的紫苏多糖的水提工艺。
[1] 韩丽,李福臣,刘洪富,等.紫苏的综合开发利用[J] .食品研究与开发,2004,25(3):24-26
[2] M Aritomi,T Kumori,T Kawasaki,et al.Cyanogenic glycosides in leaves Perilla frutescens var.acuta[J] .Phytochemistry,1985,24(10):2438-2439
[3] 顾文娟,朱陈珏.紫苏药理作用研究进展[J] .黑龙江畜牧兽医,2006(8):26-28
[4] 张卫明,石雪萍.紫苏全草营养成分测定[J] .食品研究与开发,2009,30(2):132-135
[5] 余大书,刘志刚,韩杰才.紫苏油抗氧化性研究[J] .哈尔滨工业大学学报,2001,33(5):658-660
[6] 蒲海燕,李影球,李梅.紫苏的功能性成分及其产品开发[J] .中国食品添加剂,2009(2):133-137
[7] 陶国琴,李晨.α-亚麻酸的保健功效及应用[J] .食品科学,2000,21(12):141-143
[8] Y Koezuka,G Honda,M Tabata.Genetic control of the chemical composition of volatile oils in Perilla frutescens[J] .Original Research Article,1986,25(4):859-863
[9] M Aritomi,T Kumori,T Kawasaki,et al.Genetic control of phenylpropanoids in Perilla frutescents[J] .Phytochemistry,1986,25(9):2085-2087
[10] 林海禄,彭雪娇,罗明标,等.微波辅助提取八角茴香中莽草酸的工艺研究[J] .食品工业科技,2007,28(3):137-139
[11] 牟番松,罗猛,付玉杰,等.正交实验优化长春碱微波辅助提取工艺[J] .化学工程,2008,36(7):62-65
[12] 贺寅,王强,钟葵.响应面优化酶法提取龙眼多糖工艺[J] .食品科学,2011,32(2):79-83
[13] 姚菁华,肖雷,李慧蓉,等.响应面法优化莽草酸微波辅助提取工艺[J] .北京化工大学学报:自然科学版,2009,36(增刊):14-17
[14] 朱建飞,白绍文,陈楠,等.紫苏饼粕多糖水提工艺研究[J] .安徽农业科学,2011,39(1):266-267
[15] 曾哲灵,郝纯青,吕伟,等.响应面法优化玫瑰茄红色素提取工艺[J] .食品科学,2010,31(26):47-51
[16] 张君萍,侯喜林,董海艳,等.响应曲面法优化超声波提取沙葱籽多糖工艺[J] .食品科学,2011,32(2):98-102

