发酵产物对灰绿曲霉β-葡萄糖苷酶活力的影响
许鑫琦,任跃明,马素娟,龙敏南,陈清西*
(1.厦门大学生命科学学院,福建 厦门361102;2.国家药典委员会 北京100061;3.厦门大学能源研究院,福建 厦门361102)
纤维素是自然界中分布最广、含量最为丰富的一类多糖,是理想的生物质能源,能够水解天然纤维素的纤维素酶,是一个复杂的多酶体系.一般认为纤维素酶包含3种主要水解酶[1]:外切葡聚糖酶(CBH,EC 3.2.1.91)、内切葡聚糖酶(EG,EC 3.2.1.4)和β-葡萄糖苷酶(BG,EC 3.2.1.21).纤维素被内切酶和外切酶水解成纤维二糖和低聚寡糖后,由BG将以上产物水解产生葡萄糖.BG普遍存在于植物、微生物和哺乳动物的肠道中,微生物中的木霉(Trichodermakoningii)、青霉(Penincilliumaurantiogriseum)、黑曲霉(Aspergillusniger)以 及 米 曲 霉 (Aspergillus oryzae)等真菌来源的BG利用方便,其酶学性质被广泛地研究,对纤维素酶的应用起到了有利的支撑.BG在纤维素酶体系内含量少,酶活力低,是制约纤维素降解速率的关键酶,因此BG决定了纤维素糖化过程的最终效率.Xin等[2]研究发现,在废纸产乙醇发酵过程中,加入BG后,促进糖化并降低了内切酶和外切酶所受到的反馈抑制,进而加速纤维素的降解和提高乙醇产量,这说明在纤维素利用体系中,增加BG用量的必要性.近些年,BG 的分子生物学研究不断深入[3-4],包括木霉及米曲霉和黑曲霉等丝状真菌,以及极端微生物如嗜热菌[5]来源的BG也越来越受到关注,BG的克隆表达增加了BG的工业来源,有利于解决纤维素发酵产糖过程中所遇到的瓶颈.除了能源,在其他领域,BG一直受到了国内外学者的紧密关注[6],如食品、天然产物提取、医疗以及日用化工[7]等领域BG也得到了有效的应用.
本文从自行筛选的灰绿曲霉菌株(Aspergillus glaucusXC-9)的纤维素发酵液中,分离纯化出BG,研究了乙醇等发酵产物对其催化活性的影响.
1 材料与方法
1.1 实验材料
灰绿曲霉(Aspergillusglaucus)是由实验室筛选得到的、能够降解纤维素的曲霉菌株[8].BG由实验室分离纯化.
1.2 实验方法
BG的分离纯化:灰绿曲霉发酵液先用质量分数为30%(NH4)2SO4沉淀除杂蛋白,再用70%(NH4)2SO4沉淀BG,离心收集沉淀,溶于适当体积的0.02mol/L pH 5.0HAc-NaAc缓冲液中.选用Sephadex G-100凝胶进行柱层析,柱床为1.5cm×65cm,洗脱液为0.02 mol/L pH 5.0HAc-NaAc(含0.1moL/L NaCl),流速为1mL/min,自动收集器收集洗脱液,合并活力峰,接着进行Phenyl Sepharose Fast Flow疏水层析,柱床为1.6cm×20.0cm.疏水层析洗脱 A液为含0.4mol/L NaCl的0.1mol/L pH 7.8Tris-HCl缓冲液,B液为0.1 mol/L pH 7.8Tris-HCl缓冲液;高盐上样,A 液冲平后,用200mL A液和200mL B液进行线性梯度洗脱,洗脱流速0.5mL/min,自动收集器收集样品,每管收集5mL.检测洗脱液的蛋白浓度和酶活力,合并活力峰.进行native-PAGE电泳,考马斯亮蓝染色,检测确定所制备的BG为电泳单一纯.
酶活力测定参考文献[9]:50μL酶液加入200μL 0.2mol/L pH 3.6HAc-NaAc缓冲液和250μL 1%(质量分数)水杨素底物,60℃水浴45min后,再加入2mL 3,5-二硝基水杨酸试剂(DNS)显色液终止反应.沸水浴5min后立即冷却,在酶标仪上测A540吸光值.通过标准曲线查得葡萄糖含量.以产生的还原糖量表示酶活力.酶活力定义为在上述条件下每分钟水解底物产生1μg葡萄糖所需要的酶量.
发酵产物对BG抑制作用研究:在BG测活力体系里加入不同量的发酵产物(乙醇,乳酸和乙酸)后,按BG测活力方法测定活力,3次重复试验,以发酵产物浓度对BG剩余活力作图,考察抑制BG活力的浓度效应.
发酵产物抑制机理测定:在测活力体系里,在一定发酵产物浓度下,改变 BG 质量浓度(0.1,0.2,0.3,0.4和0.5μg/mL),按测活力方法测定 BG 的酶活力,用酶活力(μmol/min)对酶质量浓度(μg/mL)作图,得到一组直线,根据直线的位置关系判断各发酵产物抑制机理.
发酵产物抑制类型判断:向测活力体系中加入不同体积的发酵产物,在每个浓度溶液中改变底物的浓度,测定酶促反应的初速率(v),以1/v对1/[cS]双倒数作图,分析比较效应物下BG的表观米氏常数Km和最大反应速率Vmax,根据双倒数曲线图判定发酵产物抑制类型,再以Vmax或Km对发酵产物浓度作图,测定3个发酵产物的抑制常数KI.
含乙醇的反应体系中BG最适反应温度的变化及BG分子内源荧光测定:向BG测活体系加入不同量乙醇,在不同温度下测定酶活力,分析比较乙醇体积分数与BG反应温度的关系.取一定量酶分别在不同体积分数乙醇溶液(0%、12%、16%、18%、20%,pH 3.6)中60℃水浴15min,冷却后在VARIAN紫外/可见分光光度计检测BG内源荧光图谱,荧光发射峰扫描范围300~405nm,激发波长为280nm.
2 实验结果
2.1 发酵产物对酶活力的影响
在BG最适反应条件下(pH 3.6,60℃),向测活体系中加入不同体积的乙酸、乙醇和乳酸,研究不同浓度发酵产物对酶催化水解底物的活力影响.酶剩余活力与之依赖关系结果见图1.随着各种产物浓度的增大,酶活力迅速下降.乙醇、乙酸、乳酸对酶活力有不同程度抑制,抑制强度依次为乳酸>乙酸>乙醇,其半抑制浓度 (IC50)分别为0.09,0.34和4.4mol/L.
2.2 发酵产物对酶活力的抑制机理
为判断以上3种物质对BG的抑制机理是否为可逆抑制,分别在含不同浓度乙酸、乙醇和乳酸的测活力体系中,固定底物水杨素浓度为5.0mmol/L,改变酶的加入量,测定不同浓度发酵产物对酶活力的影响.以酶活力对加入酶量作图,都得到了一组通过原点的直线(图2),说明三者对BG的抑制作用都表现为可逆过程,即发酵产物抑制了酶分子的活性,并未减少有活力的酶量,从而降低BG的催化效率.

图1 3种发酵产物对BG活力效应Fig.1 Inhibition of fermention products on BG

图2 3种发酵产物对BG活力的影响为可逆抑制Fig.2 Reversible inhibition of three fermention products on BG
在BG最适反应体系中(pH 3.6,60℃),加入不同体积的乙醇、乙酸或乳酸,在每个浓度的溶液中改变底物的浓度,测定酶促反应的初速率(v),以1/v对1/[cS]作图,结果如图3~5所示.双倒数作图均得到一组相交于横轴的直线(图3(a),4(a)和5(a)).说明乙醇、乙酸及乳酸对BG不影响米氏常数(Km),只影响最大反应速率(Vm),抑制机理表现为非竞争性类型,可以同时与游离酶(E)和结合酶(ES)结合,且结合常数相同.以不同浓度效应物下测定的1/Vm对效应物浓度作图为一条直线,直线的斜率为1/(Vm·KI)(图3(b),4(b)和5(b)),从而求得发酵产物对BG 的抑制常数分别为乙醇26% (4.25mol/L)、乙酸2% (0.315 mol/L)和乳酸0.7% (0.083mol/L).
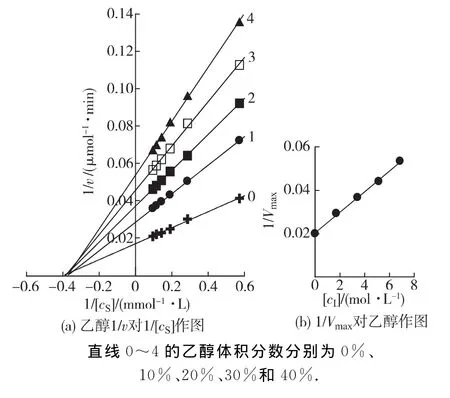
图3 在不同体积分数乙醇的反应体系中BG水解水杨素Lineweaver-Burk曲线Fig.3 Lineweaver-Burk plots for the hydrolysis of salicin by BG in different concentrations of ethanol
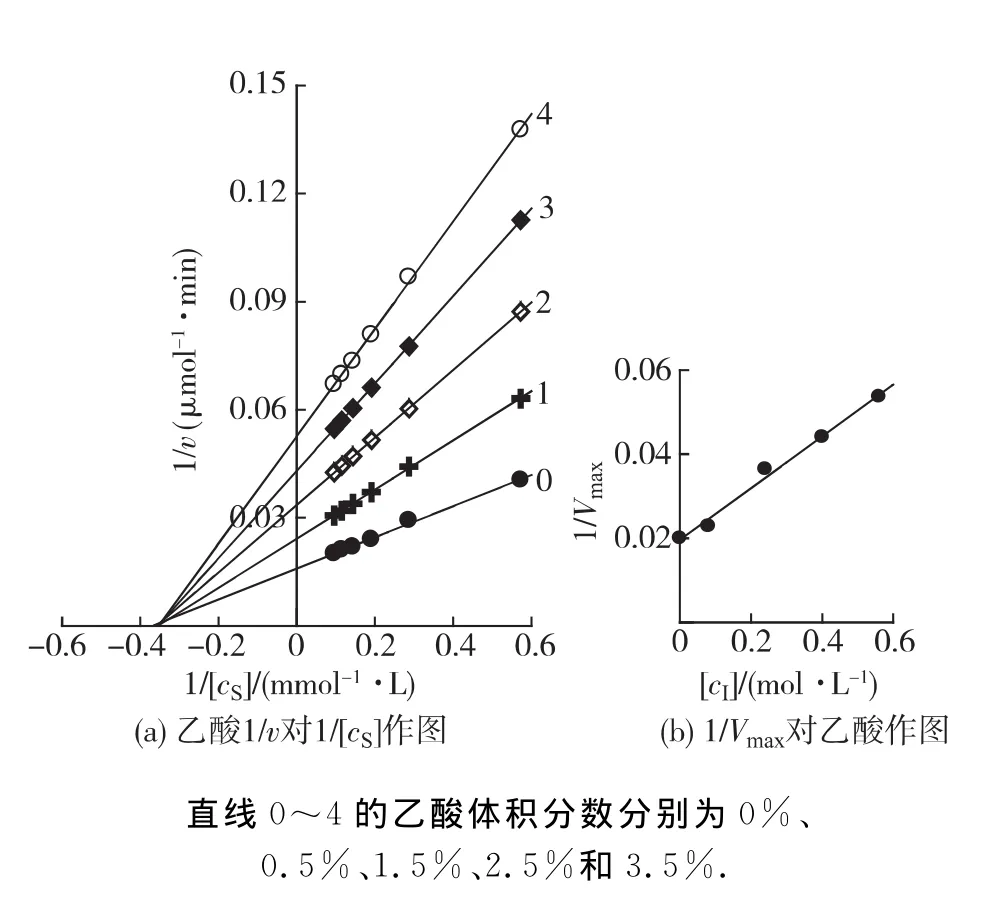
图4 在不同体积分数乙醇的反应体系中对BG水解水杨素Lineweaver-Burk曲线Fig.4 Lineweaver-Burk plots for the hydrolysis of saliciny BG in different concentrations of acetic acid
2.3 乙醇对BG反应温度和酶分子内源荧光光谱影响
测定了不同体积分数乙醇对BG催化反应温度的影响,结果如图6所示.随着乙醇浓度的增加,BG催化活力随之下降的同时,BG水解底物的最适温度逐渐减小,无乙醇存在下为60℃,当乙醇升至20%(体积分数)时,BG的最适温度已降到了50℃,说明乙醇体积分数的增加可降低BG最适反应温度.当反应体系温度小于55℃,乙醇低于16%时,BG酶活力都高于无乙醇情况下的活力.
最适反应条件(60℃,pH 3.6)保存15min后,BG在不同体积分数乙醇溶液的荧光发射光谱变化结果见图7.在280nm激发下,天然酶内源荧光在338 nm处有特征发射峰,当乙醇体积分数小于12%时,BG内源荧光强度随乙醇的增加而下降,未发生红移;当乙醇体积分数超过12%并继续增加时,其强度随着乙醇体积分数上升而增强,当乙醇体积分数达20%时,荧光强度增加了50%,但未发生红移,酶分子高级结构还未被完全破坏.
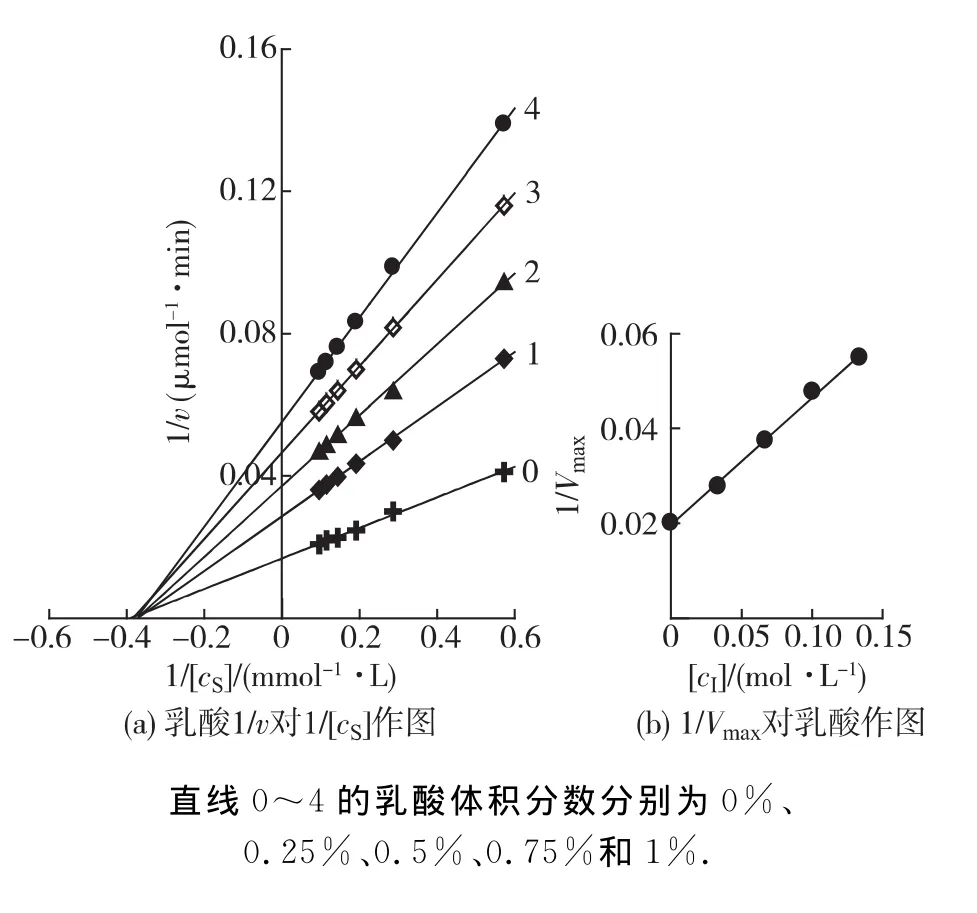
图5 在不体积分数乳酸的反应体系中BG水解水杨素Lineweaver-Burk曲线Fig.5 Lineweaver-Burk plots for the hydrolysis of salicin by BG in different concentrations of lactic acid
3 讨 论
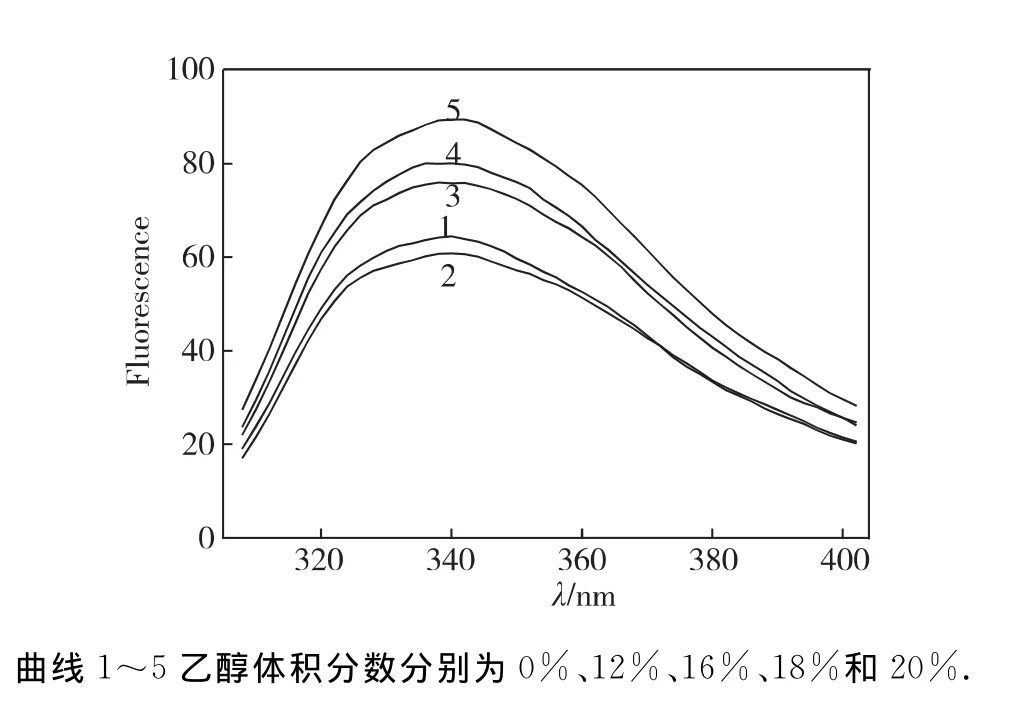
图7 pH3.6不同体积分数乙醇溶液60℃处理15min后BG荧光发射光谱Fig.7 Fluorescence emission spectra of BG after incubating in different concentration of ethanol solutions(pH3.6)for 15min
本文研究发现发酵产物乙醇、乙酸、乳酸对BG活力有不同程度抑制,其IC50分别为4.4,0.34和0.09 mol/L,抑制强度依次为乳酸>乙酸>乙醇,乙醇IC50明显大于前两者,表明该菌株的BG更适合于纤维素发酵产乙醇,而且同Aspergillusoryzae[10]产BG相比,乙醇耐受性更高.三者抑制BG均表现为可逆非竞争性抑制,一方面说明发酵产物以非共价键与酶蛋白中的必需基团结合,除去发酵产物后而可使酶重新恢复活性,另一方面,证明乙醇等3种物质不结合在酶活性中心的底物结合部位上,而是结合在其以外的必需基团上,所以并不降低酶对底物的亲和力,但能阻止酶的催化作用.3种物质具有相近的烃骨架,乙醇不像乙酸和乳酸都可解离出H+,降低酶所处环境的pH,只是单纯靠氢键与酶分子发生反应,故抑制作用较后两者弱.而且,乳酸含有一个羟基和羧基,综合了乙醇和乙酸的作用,作用比另两者更强,体现为IC50比乙醇和乙酸低,BG对其耐受度比乙醇或乙酸低.该结果另一方面验证羧基化合物比中性羟基化合物更能抑制灰绿曲霉BG活力,故在无氧发酵中应注意控制氧化程度,避免过度产酸.
BG在含乙醇的催化反应体系中,荧光强度显著增大,即分子构象改变,酶分子在乙醇溶液中的构象变化主要表现为酶分子的主肽链从紧密的构象趋于松散状态,从有序的二级结构变成无规则线团.可能是因为乙醇介入酶分子中,改变酶分子所处环境的介电常数,同时引起肽链伸展,构象改变,使得Tyr和Trp残基所处微环境的极性降低;此外,Tyr残基形成的氢键遭到了破坏,处于淬灭状态的Tyr残基荧光得以恢复,使其量子率增加,于是荧光强度增大[11].当乙醇体积分数为20%时,荧光强度显著增加,但吸收峰波长没有观察到显著的红移,说明酶分子的整体构象尚未完全变性,此时BG还有较大活力.BG在不同量乙醇和不同反应温度的酶活力变化,可能是乙醇和温度对酶分子综合作用的结果.一方面酶的最适反应温度是活性中心活化与分子变性共同作用的结果,一定量乙醇存在时,由于乙醇作用,随着温度上升,酶分子失效加速,故BG合适反应温度比无乙醇时更低.另一方面,温度较低(<55℃)时,若乙醇体积分数较低(<20%),乙醇分子使酶蛋白内的次级键减弱,酶分子活性中心更加舒展,柔性增加,底物与酶结合更容易,酶催化效率相应地增加;但如果乙醇体积分数较高(20%),乙醇对酶分子的破坏作用占主导,即使温度降低,酶活力仍然不及前者.
葡萄糖是纤维素酶水解纤维素的最终产物,但在真菌培养或者工业生产中,葡萄糖常常会在适宜的条件下继续发酵产酸或乙醇,这些发酵产物会对纤维素酶产生反馈抑制,影响酶的活力,以上研究为发酵进程的控制,控制发酵工艺提供了理论基础.
[1]Sang J H,Yong J Y,Hyen S K.Characterization of a bifunctional cellulase and its structural gene [J].J Biol Chem.,1995,270(43):26012-26019.
[2]Xin Z,Yinbo Q,Peiji G.Acceleration of ethanol production from paper mill waste fiber by supplementation withβ-glucosidase[J].Enzyme Microb Technol,1993,15:62-65.
[3]Bhatia Y,Mishra S,Bisaria V S.Microbialβ-glucosidases:cloning,properties,and applications[J].Crit Rev Biotechnol,2002,22(4):375-407.
[4]蒋西兰,李文利.纤维素乙醇基因工程研究进展[J].中国生物工程杂志,2009,29(7):127-133.
[5]陈卫红,李多川.嗜热子囊菌光孢变种β-葡萄糖苷酶的基因克隆、表达及酶学性质的研究分析[J].应用与环境生物学报,2009,15(4):549-554.
[6]Michael E H,Mark F R,Charles E W.Cellulase for commodity products from cellulosic biomass[J].Curr Opin Biotech,1999,10:358-364.
[7]潘利华,罗建平.β-葡萄糖苷酶的研究及应用进展[J].食品科学,2006,27(12):803-806.
[8]徐昶,龙敏南,邬小兵,等.高产纤维素酶菌株的筛选及产酶条件研究[J].厦门大学学报:自然科学版,2004,43(1):107-111.
[9]Ma S J,Leng B,Xu X Q,et al.Purification and characterization ofβ-1,4-glucosidase fromAspergillusglaucus[J].Afr J Biotechnol,2011,10(84):19607-19614.
[10]叶海梅.米曲霉FZ58β-葡萄糖苷酶固体发酵优化及酶学特性的研究[D].福州:福建师范大学,2008.
[11]王悦,谢晓兰,王勤,等.乙醇对南美白对虾 N-乙酰-β-D-氨基葡萄糖苷酶活力与构象的影响[J].厦门大学学报:自然科学版,2004(增刊1):28-31.

