白藜芦醇对糖尿病大鼠视网膜中SIRT1基因表达的干预作用
张笃贞 张涤 孙鹏 王冬兰
白藜芦醇对糖尿病大鼠视网膜中SIRT1基因表达的干预作用
张笃贞 张涤 孙鹏 王冬兰
白藜芦醇;糖尿病视网膜病变;SIRT1;p53
目的观察白藜芦醇(Resveratrol,Res)对链脲佐菌素(streptozotocin,STZ)诱导的糖尿病大鼠视网膜中沉默信息调节因子(silent mating type information regulation 2 homolog 1,SIRT1)基因表达的影响,探讨其对糖尿病视网膜病变可能的作用机制。方法随机选择15只正常大鼠为正常对照组(NC组),STZ成功诱导糖尿病模型大鼠57只,用随机数字表法分为糖尿病模型(DC)组、Res低剂量给药(RL)组、Res高剂量给药(RH)组,每组各19只。各组分别选择不同剂量Res灌胃12周,苏木精-伊红染色观察大鼠视网膜组织病理学改变,免疫组织化学染色检测抗癌基因p53蛋白表达,RT-PCR检测SIRT1、p53 mRNA在大鼠视网膜中的表达情况。结果HE染色结果显示:NC组视网膜结构层次清晰;DC组较NC组视网膜变薄,结构破环,神经节细胞数目减少;RL组较DC组略有改善;RH组视网膜结构基本正常。免疫组织化学染色结果显示:DC组、NC组、RL组、RH组大鼠p53阳性细胞核数目分别为(103.857 1±8.071 1)个、(9.142 9±2.035 4)个、(63.714 3±6.750 7)个、(15.751 4±1.988 1)个,各组间差异均有统计学意义(均为P<0.05)。DC组、NC组、RL组、RH组SIRT1 mRNA相对表达量分别为 1.234 6±0.026 0、1.499 3±0.098 8、1.269 7±0.0280、1.392 1±0.053 1,DC组均低于RL组、RH组、NC组,各组间两两比较差异均有统计学意义(均为P<0.05)。DC组、NC组、RL组、RH组p53 mRNA相对表达量分别为1.503 4±0.081 3、0.952 0±0.110 2、1.429 3±0.110 0、1.027 1±0.088 7,DC组均高于RL、RH、NC组,各组间两两比较差异均有统计学意义(均为P<0.05)。结论Res对糖尿病大鼠的视网膜损害具有一定的保护作用,其机制可能与Res促进视网膜中SIRT1的表达从而抑制视网膜的细胞凋亡有关。
[眼科新进展,2014,34(4):322-325]
糖尿病是影响全身各组织器官血管功能并引发其病变的内分泌疾病,严重影响人类健康[1]。而糖尿病性视网膜病变(diabetic retinopathy,DR)是糖尿病最常见、最严重的微血管并发症之一。白藜芦醇(Resveratrol,Res)目前已被国内外学者广泛应用于糖尿病肾病的研究中,但有关其对DR的干预作用及其机制的相关报道尚少。而Res对DR大鼠沉默信息调节因子(silent mating type information regulation 2 homolog 1,SIRT1)的干预作用,国内外研究者均未涉及。本实验以Wistar大鼠为研究对象,建立链脲佐菌素(streptozotocin,STZ)诱导的DR模型,观察Res对SIRT1 mRNA表达的影响,旨在进一步探讨DR的发病机制及Res对DR早期的保护作用。
1 材料与方法
1.1实验动物清洁级Wistar大鼠80只(长春亿斯动物实验中心),雌雄各半,鼠龄为(55±5)d,体质量160~220 g。
1.2主要药品及试剂Res(西安冠宇生物技术有限公司);STZ、二甲基亚砜(DMSO,美国Sigma公司);p53一抗(武汉博士德生物有限公司);Trizol、DEPC(大连宝生物有限公司);RT-PCR试剂盒(Fermentas公司);DNA marker(北京博迈德生物技术有限公司);Taq PCR Master Mix试剂(北京百泰克生物技术有限公司);血糖仪及血糖试纸(德国罗氏公司)。
1.3糖尿病动物模型的建立与分组所有大鼠适应性喂养1周后,应用随机数字表法留取15只为正常对照(NC)组,剩余65只大鼠单次腹腔注射60 mg·kg-1STZ以建立糖尿病动物模型,注射时用pH 4.2的0.1 mol·L-1枸橼酸缓冲液溶解STZ至10 g·L-1。3 d后鼠尾静脉采血测空腹血糖,血糖浓度≥16.7 mmol·L-1者即为糖尿病动物模型造模成功。剔除血糖<16.7 mmol·L-1的3只大鼠以及5只死亡大鼠。将造模成功后57只大鼠纳入实验,用随机数字表法随机分为糖尿病模型(DC)组、Res低剂量给药(RL)组、Res高剂量给药(RH)组,每组各19只。自造模成功后第2天起,RL组以Res混悬液(20 g·L-1Res+0.022 g·L-1DMSO)20 mg·kg-1·d-1灌胃,RH组以Res混悬液(100 g·L-1Res+0.022 g·L-1DMSO)100 mg·kg-1·d-1灌胃,NC组、DC组以等量DMSO溶液灌胃,持续12周。
1.4取材处理在末次给药次日处死大鼠,左眼采用石蜡包埋组织化学技术,对各组切片行组织病理学及免疫组织化学染色,光学显微镜下观察视网膜组织病理学改变及P53蛋白表达情况。4 ℃取右眼视网膜组织,组织匀浆和液氮中保存备用,各组样本行SIRT1、p53 mRNA复合逆转录-聚合酶链反应(reverse transcriplion-polymerase chain reaction,RT-PCR)检测。
1.5指标测定
1.5.1组织病理学及免疫组织化学检测大鼠左眼浸泡于40 g·L-1多聚甲醛溶液中24 h,经脱水、浸蜡、切片后制成4 μm厚大鼠视网膜组织切片,经苏木精-伊红染色,光学显微镜下观察各组大鼠视网膜组织形态学改变。按照SP及DAB显色试剂盒步骤进行免疫组织化学染色,一抗为兔抗大鼠p53抗体(1100稀释),二抗为生物素羊抗兔lgG(1100稀释),DAB显色,苏木精-伊红复染,中性树胶封片。光学显微镜下观察p53蛋白表达情况,以视网膜细胞核内出现黄色或棕黄色颗粒为阳性,每张切片在阳性表达区域选择5个无重叠高倍视野,采用双盲法平均计数阳性细胞核数。
1.5.2RT-PCR法测定SIRT1、p53mRNA表达按照试剂盒说明Trizol法提取总RNA,琼脂糖凝胶电泳法检测RNA完整性,用DU-800紫外分光光度计检测RNA含量。选取OD值1.8~2.2的总RNA(500 ng)为模板进行反转录,反转录条件:42 ℃ 60 min,70 ℃ 5 min,4 ℃结束。以β-肌动蛋白(β-actin)为内参,行RT-PCR反应。PCR反应体系:Master Mix 12.5 μL,上、下游引物各1.0 μL,反转录产物 1.0 μL,灭菌蒸馏水9.5 μL (PCR引物见表1)。

表1 各基因的PCR引物Table 1 PCR primers of each gene
PCR扩增条件(最佳退火温度):95 ℃预变性2~5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,循环30~35次;72 ℃延伸10 min,4 ℃结束。
PCR 产物5 μL行溴化乙啶(ethidium bromide,EB)配制的20 g·L-1琼脂糖凝胶电泳,120 V电泳30 min。凝胶成像系统(Quantity One)进行数据分析,以各组中cDNA扩增产物的条带与β-actin条带灰度值比值表示mRNA 表达水平。

2 结果
2.1组织病理学及免疫组织化学检测HE染色结果显示(图1):NC组大鼠视网膜基本结构层次分明,细胞排列紧密、整齐;DC组较NC组大鼠视网膜各层厚度变薄,内核层尤为明显,内界膜断裂,神经节细胞水肿,数目减少,细胞排列不规则;RL组较DC组略有改善;RH组大鼠视网膜组织结构基本正常,较DC组明显改善。免疫组织化学染色结果显示(图2):NC组大鼠仅视网膜神经节细胞层细胞核内可见黄色或棕黄色颗粒,P53蛋白阳性细胞核数为(9.142 9±2.035 4)个; DC组大鼠视网膜神经节细胞层、内核层及外核层细胞核内均出现黄色或棕黄色颗粒,P53蛋白阳性细胞核数为(103.857 1±8.071 1)个,较NC组明显增多;RL组大鼠视网膜神经节细胞层、内核层细胞核内可见黄色或棕黄色颗粒,P53蛋白阳性细胞核数为(63.714 3±6.750 7)个,较DC组有所改善;RH组大鼠P53蛋白主要在视网膜神经节细胞层表达,内核层可见极少量黄色或棕黄色颗粒,P53蛋白阳性细胞核数为(15.751 4±1.988 1)个,较DC组、RL组明显减少;各组间两两比较差异均有统计学意义(均为P<0.05)。
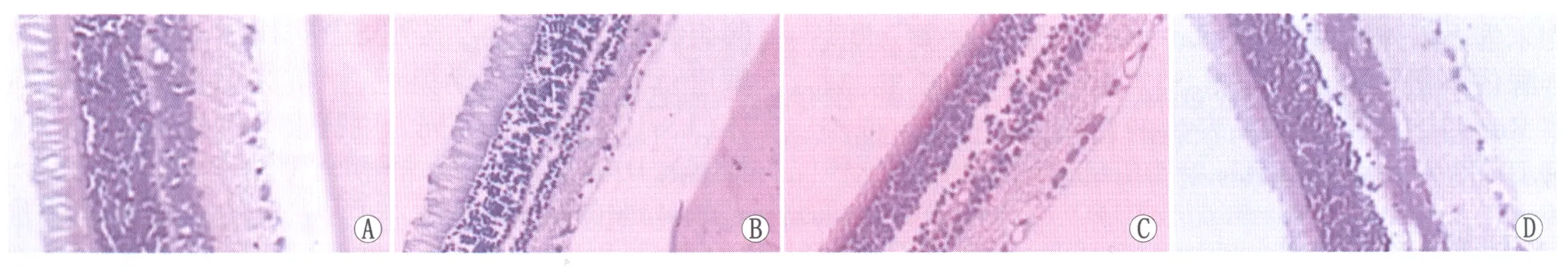
Figure 1 Pathological changes of rats retina in different groups (HE, ×100). A: Group NC; B: Group DC; C: Group RL; D: Group RH 各组大鼠视网膜组织病理变化情况(HE,×100)。A:NC组;B:DC组;C:RL组;D:RH组

Figure 2 Expression of p53 in rats retina of different groups detected by immunohistochemical staining (×400). A: Group NC; B: Group DC; C: Group RL; D: Group RH 免疫组织化学法检测各组大鼠视网膜中p53的表达情况(×400)。A:NC组;B:DC组;C:RL组;D:RH组
2.2RT-PCR检测NC组、DC组、RL组、RH组大鼠视网膜中SIRT1/β-actin的相对灰度值分别为1.499 3±0.098 8、1.234 6±0.026 0、1.269 7±0.028 0、1.392 1±0.053 1,DC组大鼠视网膜中SIRT1 mRNA的表达较NC组、RL组、RH组明显降低,各组间两两比较差异均有统计学意义(均为P<0.05)。NC组、DC组、RL组、RH组大鼠视网膜中p53/β-actin的相对灰度值分别为 0.952 0±0.110 2、1.503 4±0.081 3、1.429 3±0.110 0、1.027 1±0.088 7,NC组、RL组、RH组大鼠视网膜中p53 mRNA的表达较DC组降低,各组间两两比较差异均有统计学意义(均为P<0.05,见图3)。
3 讨论
DR的发病基础是视网膜血管微循环障碍,其最早出现的病理变化是周细胞缺失,基本病理改变为血-视网膜屏障破坏及新生血管形成[2]。大量研究表明,周细胞的缺失与细胞凋亡密切相关[3],曾有文献报道,DR也存在神经细胞的凋亡[4]。本实验也表明,STZ诱导的糖尿病大鼠模型可出现神经节细胞的水肿及数目减少、视网膜的结构破坏等DR早期病理学改变。而氧化应激、糖基化终产物生产增加及蛋白激酶C的激活均可诱导视网膜细胞凋亡,导致DR。由于视网膜细胞膜中含有大量多不饱和脂肪酸,耗氧量及葡萄糖氧化作用最多,因此相对于其他组织来说,视网膜组织对氧化应激反应更敏感。目前认为氧化应激可导致周细胞及神经细胞的凋亡,已经成为防治DR的重要靶点。

Figure 3 Relative expressions of SIRT1 and P53 mRNA compared with β-actin mRNA in rats retina of different groups 各组大鼠视网膜中SIRT1 mRNA、p53 mRNA较β-actin mRNA的相对表达量
SIRT1是烟酰胺腺嘌呤二核苷酸(NAD+)依赖的第Ⅲ组组蛋白去乙酰化酶,广泛存在于多物种之中,在转录沉默、染色质稳态、DNA损伤后修复、延长细胞周期中起着重要作用[5]。SIRT1具有调节多种可控制代谢及内分泌信号的转录因子,包括p53[6]、核因子-κB(NF-κB)[7]、叉头转录因子O亚家族(forkhead O subfamily,FOXO)[8]、过氧化物酶体增生物激活受体γ(peroxisome prolifer-active activated receptor gamma,PPAR-γ)[9]、PPAR-γ共激活物1-α(peroxisome proliferative activated receptor gamma coactivator 1-α,PGC1-α)[10]等。p53是SIRT1的生理性底物之一,SIRT1可通过使抑癌基因p53特异位点的赖氨酸残基发生去乙酞化作用从而负性调节其活性[11]。Luo等[12]发现SIRT1 能使促凋亡因子p53蛋白的lys382去乙酰化,抑制p53与靶DNA顺式原件结合,减少由p53诱导的氧化应激反应及DNA损伤导致的细胞凋亡,从而使视网膜细胞的存活率升高。野生型SIRT1的过量表达可以逆转辐射诱导的p53乙酰化,并且降低p53靶蛋白p21的水平,有降低大鼠视网膜周细胞凋亡及延长视网膜细胞寿命的可能[12-13]。本研究结果显示,高糖状态下大鼠视网膜中SIRT1 mRNA的表达明显减少,P53蛋白及mRNA水平的表达均明显增多,表明在DR早期SIRT1、p53的平衡状态已受到破坏,其表达量的变化进一步诱导了DR病情的发展。
Res是非黄酮类多酚化合物,广泛存在于葡萄、花生、虎杖、藜芦等植物中[14],是SIRT1的天然激动剂[8,10]。Res具有降低血脂、抗血小板聚集、诱导肿瘤细胞凋亡、提高免疫功能、降低脂质过氧化、促进抗氧化防御作用等生理活性[15]。研究发现,啮齿类动物能量限制的情况下,其肝脏、胰腺、肌肉、大脑及脂肪组织中的SIRT1表达增高[16-17]。有研究认为Res能够提高SIRT1酶活性并提高乙酰化底物的亲和力[14,18],可有效清除羟基和过氧化物,抵御脂质过氧化物产生的自由基对细胞膜和DNA的损害[19]。本研究结果显示,在应用不同剂量Res治疗一段时间后,大鼠视网膜组织结构、细胞形态及数目均有改善,SIRT1 mRNA的转录和表达增多,p53 mRNA水平的表达相应减少,RL组、RH组与DC组差异均有统计学意义(均为P<0.05),RH组效果优于RL组(P<0.05)。因此说明,在本实验条件下,SIRT1可能是通过抑制下游底物p53信号通路从而影响视网膜细胞代谢,早期应用Res可提高SIRT1酶的活性,改善和延缓DR的发展,且100 mg·kg-1·d-1Res的治疗效果尤为明显。
综上所述,SIRT1有可能成为DR防治的新作用靶点,Res可以改善早期DR的发展,其治疗应考虑在DR早期就进行,以期在其初期抑制视网膜的组织病理改变,延缓甚至控制其进一步的发展。本研究结果为早期DR的药物治疗提供一条新的思路,但Res对DR防治的作用机制还有待于进一步探索。
1 谭静,殷闯,郭明好,张晓利.血清胱抑素C和C反应蛋白联合检测在评估糖尿病肾损害中的应用价值[J].新乡医学院学报,2013,30(4):290-291.
2 Chung HS,Harris A,Halter PJ,Kagemann L,Roff EJ,Garzozi HJ,etal.Regional differences in retinal vascular reactivity[J].InvestOphthalmolVisSci,1999,40(10):2448-2453.
3 刘学政,萧鸿,王中彬,李瑞祥.糖尿病早期大鼠视网膜毛细血管细胞凋亡研究[J].眼科研究,2001,19(1):35-38.
4 Moore P,El-sherbeny A,Roon P,Schoenlein PV,Ganapathy V,Smith SB.Apoptosis cell death in the mouse retinal ganglion cell layer is inducedinvivoby the excitatory amino acid homocysteine[J].ExpEyeRes,2001,73(1):45-57.
5 Gray SG,Ekstrom TJ.The human histone deacetylase family [J].ExpCellRes,2001,262(2):75-83.
6 Michishita E,Park JY,Burneskis JM,Barrett JC,Horikawa I.Evolutionarily conserved and nonconserved cellular localizations and functions of human SIRT proteins[J].MolBiolCell,2005,16(10):4623-4635.
7 Escande C,Chini CC,Nin V,Dykhouse KM,Novak CM,Levine J,etal.Deleted in breast cancer-1 regulates SIRT1 activity and contributes to high-fat diet-induced liver steatosis in mice[J].JClinInvest,2010,120(2):545-548.
8 Giannakou ME,Partridge L.The interaction between FOXO and SIRT1:tipping the balance towards survival[J].TrendsCellBiol,2004,14(8):408-412.
9 Picard F,Kurtev M,Chung N,Topark-Ngarm A,Senawong T,Machado De Oliveira,etal.Sirt1 promotes fat mobilization in white adipocytes by repressing PPAR-gamma[J].Nature,2004,429(6993):771-776.
10 Revollo JR,Grimm AA,Imai S.The NAD biosynthesis pathway mediated by nicotinamide phosphoribosyltransferase regulates Sir2 activity in mammalian cells [J].JBiolChem,2004,279(49):50754-50763.
11 Inoue Y,Iemura S,Natsume T,Miyazawa K,Imamura T.Suppression of p53 activity through the cooperative action of ski and histone deacetylase SIRT1[J].JBiolChem,2011,286(8): 6311-6320.
12 Luo J,Nikolaev AY,Imai S,Chen D,Su F,Shiloh A,etal.Negative control of p53 by Sir-alpha promotes cell survival under stress[J].Cell,2001,107(2):137-148.
13 Vaziri H,Dessain SK,Ng Eaton E,Imai SI,Frye RA,Pandita TK,etal.Hsir2(SIRT1)functions as an NAD-dependent p53 deacetylase[J].Cell,2001,107(2):149-159.
14 Borra MT,Smit BC,Denu JM.Mechanism SIRT1 activation by resveratrol[J].JBiolChem,2005,280(17):17187-17195.
15 Tyler VE.Grape expectations(compound in grapes may fight cancer)includes related article on grape-seed extract and on ehinacea[J].Prevention,1997,49(6):80-84.
16 Al-Regaiey KA,Masternak MM,Bonkowski M,Sun L,Bartke A.Long-lived growth hormone receptor knockout mice:interaction of reduced insulin-like growth factor i/insulin signaling and caloric restriction[J].Endocrinology,2005,146(2):851-860.
17 Wood JG,Rogina B,Lavu S,Howitz K,Helfand SL,Tatar M,etal.Sirtuin activators mimic caloric restriction and delay ageing in metazoans[J].Nature,2004,430(7000):686-689.
18 Howitz KT,Bitterman KJ,Cohen HY,Lamming DW,Lavu S,Wood JG,etal.Small molecule activators of sirtuins extend Saccharomy-ces cerevisiae lifespan[J].Nature,2003,425(6954):191-196.
19 Elmali N,Esenkaya I,Karadag N,Tas F,Elmali N.Effects of resveratrol on skeletal muscle in ischemia-reperfusion injury[J].UlusTravmaAcilCerrahiDerg,2007,13(4):274-280.
date:Sep 27,2013
Effects of resveratrol on SIRT1 gene expression in retina of diabetic rat
ZHANG Du-Zhen,ZHANG Di,SUN Peng,WANG Dong-Lan
resveratrol; diabetic retinopathy; SIRT1; P53
Objective To observe the effects of resveratrol (Res)on the silent mating type information ragulation 2 homolog 1 (SIRT1)expression in retina of diabetic rats induced by streptozotocin (STZ), and explore its possible effective mechanisms on diabetic retinopathy. Methods Fifteen normal rats were set as normal control group (group NC), 57 diabetic rats induced by STZ were random divided into diabetic model (DC)group, low Res dosage of medicine (RL)group, and high Res dosage of medicine (RH)group, 19 rats in each group. Each group was given different dose of Res by intragastric administration for 12 weeks, the rat retinal tissue pathological changes were observed by HE staining, immunohistochemical staining was used to observe P53 protein expression, and RT-PCR was used to assay SIRT1 and P53 mRNA expression in the rat retina.Results HE staining showed that the structures of the rat retinas of group NC were clear. The retinas of group DC became thin, structures were damaged, retinal ganglion cells reduced. Compared with group DC, the situations of group RL improved slightly. The structures of group RH were almost normal. Immunohistochemical staining showed that the number of yellow or brown granules in the nucleuses of rats retinas of group DC, group NC, group RL and group RH were 103.857 1±8.071 1, 9.142 9±2.035 4, 63.714 3±6.750 7 and 15.751 4±1.988 1, respectively, there were statistical differences between each group (allP<0.05).The expression of SIRT1 mRNA in the retina of group DC, group NC, group RL and group RH were 1.234 6±0.026 0, 1.499 3±0.098 8, 1.269 7±0.028 0 and 1.392 1±0.053 1, respectively, the group DC were lower than the group RL, group RH, group NC, there were statistical differences between each group (allP<0.05). The expressions of P53 mRNA in the retina of group DC, group NC, group RL and group RH were 1.503 4±0.081 3, 0.952 0±0.110 2, 1.429 3±0.110 0 and 1.027 1±0.088 7, respectively, the group DC were higher than the group RL, group RH, group NC, there were statistical differences between each group (allP<0.05).Conclusion Res has certain protective effects on the retinal damage of diabetic rats, its mechanism may be related with Res increasing SIRT1 expression in the retina and inhibiting retinal cell apoptosis.
张笃贞,女,1983年1月出生,山东人,在读硕士研究生。联系电话:15245459556;E-mail: 18188894@qq.com
AboutZHANGDu-Zhen:Female,born in January,1983.Postgraduate student.Tel:15245459556;E-mail: 18188894@qq.com
2013-09-27
154007 黑龙江省佳木斯市,佳木斯大学临床医学院(张笃贞);154002 黑龙江省佳木斯市,佳木斯大学附属第一医院眼科(张涤,孙鹏,王冬兰)
王冬兰, E-mail: wdloph@163.com
张笃贞,张涤,孙鹏,王冬兰.白藜芦醇对糖尿病大鼠视网膜中SIRT1基因表达的干预作用[J].眼科新进展,2014,34(4):322-325.
��
10.13389/j.cnki.rao.2014.0087
修回日期:2013-12-19
本文编辑:付中静
Accepteddate:Dec 19,2013
From theClinicalCollegeofJiamusiUniversity(ZHANG Du-Zhen),Jiamusi154007,HeilongjiangProvince,China;DepartmentofOphthalmology,theFirstAffiliatedHospitalofJiamusiUniversity(ZHANG Di,SUN Peng,WANG Dong-Lan),Jiamusi154002,HeilongjiangProvince,China
Responsibleauthor:WANG Dong-Lan,E-mail: wdloph@163.com
[RecAdvOphthalmol,2014,34(4):322-325]