bFGF与ERK1/2阻断剂对人晶状体上皮细胞α平滑肌肌动蛋白mRNA表达的影响
杨楠 康刚劲 董敏
bFGF与ERK1/2阻断剂对人晶状体上皮细胞α平滑肌肌动蛋白mRNA表达的影响
杨楠 康刚劲 董敏
后发性白内障;碱性成纤维细胞生长因子;人晶状体上皮细胞;α-平滑肌肌动蛋白; 胞外调节激酶ERK; ERK信号通路阻断剂
目的观察碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)及细胞外调节蛋白激酶1/2(extracellular signal regulated kinase 1/2,ERK1/2)阻断剂PD98059对人晶状体上皮细胞(human lens epithelial cells, HLEC)α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)mRNA表达的影响。方法体外传代及培养HLEC,加入10 μg·L-1bFGF及PD98059作用一定时间并根据作用时间进行分组。MTT法检测HLEC数量及存活率;逆转录聚合酶链反应(RT-PCR)测定HLEC中α-SMA mRNA 的表达。结果HLEC的存活率在bFGF作用组中随时间增长而增强,作用6 h时达126.34%,作用1 h组与作用6 h组比较差异有统计学意义(P<0.05);只加PD98059组细胞存活率仅30.03%,与正常对照组相比差异有统计学意义(P<0.05)。bFGF作用剂量不变的情况下,随着作用时间延长,α-SMA mRNA表达明显增加,作用1 h组与作用6 h组差异有统计学意义(P<0.05);bFGF作用6 h后,α-SMA mRNA值达最高;加阻断剂PD98059作用后,α-SMA mRNA表达减少且随阻断剂作用时间延长表达进一步减少,作用1 h组与作用6 h组差异无统计学意义(P>0.05)。结论bFGF对HLEC具有促增殖作用,在低浓度剂量不变的前提下,呈现时间相关性。bFGF可促进HLEC分泌α-SMA,促进HLEC分化,并呈现时间及剂量相关性。
[眼科新进展,2014,34(4):326-329]
后发性白内障(posterior capsule opacification,PCO)是白内障术后主要并发症之一,也是影响患者术后视力恢复的主要原因。多种细胞生长因子特别是早期碱性成纤维细胞生长因子(basic fibroblast factor,bFGF)的释放,术中残留的晶状体上皮细胞(lens epithelial cells,LEC)及皮质,细胞迁移、增殖及转分化,细胞凋亡,血-房水屏障的破坏及IOL植入等因素共同作用促进了PCO的形成[1-3]。PCO的组织病理学研究发现白内障术后人LEC(HLEC)转分化为肌纤维母细胞,在这些细胞中α-平滑肌肌动蛋白(alpha smooth muscle actin,α-SMA)表达增强[3-6]。本研究以LEC为研究对象,用bFGF以及细胞外调节蛋白激酶1/2(extracellular signal regulated kinase 1/2,ERK1/2)阻断剂PD98059作用不同时间,观察LEC细胞中有无α-SMA形成。
1 材料与方法
1.1实验仪器与试剂HLEC LSRA01/04(泸州医学院中心实验室提供);倒置显微镜及TS-2000A脱色摇床(江苏海门麒麟医用仪器厂);-80 ℃超低温冰箱(Thermo公司);Centrifuge5415R低温高速离心机(德国Eppendorf公司);Mastercycler gradient PCR仪(德国Eppendorf公司);ND-100核酸蛋白检测仪(德国Eppendorf公司);无血清细胞冻存培养液培养基及胎牛血清、2.5 g·L-1胰蛋白酶消化液(美国Gibco公司);bFGF液(美国R&D公司)及ERK1/2信号转导通路抑制剂PD98059(上海碧云天技术有限公司)均配制成10 μg·L-1浓度;总RNA提取试剂Trizol购自美国Invitrogen公司;噻唑(5-dimethy(thiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)、碘化乙啶、Cocktail片、二甲亚砜(DMSO)均购自美国Sigma公司。
1.2细胞培养及分组HLEC LSRA01/04细胞株按照文献中描述的方法[7]进行复苏、传代及培养。接种在96孔板、6孔板的细胞浓度为每孔50×103个细胞,在37 ℃、含体积分数5%CO2培养箱内孵育。培养48 h待细胞长满65%~80%可用于实验。3 d换液1次,达实验要求后进行分组:对照组(未加任何试剂);bFGF 1组:加入10 μg·L-1bFGF作用1 h;bFGF 2组:加入10 μg·L-1bFGF作用6 h;PD98059组:加入10 μg·L-1PD98059作用1 h;bFGF+PD98059 1组:加入10 μg·L-1bFGF作用1 h后加入10 μg·L-1PD98059作用1 h;bFGF+PD98059 2组:加入10 μg·L-1bFGF作用6 h后加入10 μg·L-1PD98059作用6 h。
1.3MTT法检测HLEC细胞数量和存活率情况收集对数生长期细胞,制成细胞悬液,按照每孔6000个细胞浓度接种于96孔板,和上述分组情况相同。每孔加入5 g·L-1MTT溶液,继续培养4 h。用酶标仪测定490 nm波长各孔吸光度,存活率=(1-实验孔吸光度/对照孔吸光度)×100%,分析结果。
1.4逆转录聚合酶链反应测定HLEC中α-SMAmRNA的表达2.5 g·L-1胰蛋白酶消化收集细胞,PBS缓冲液洗涤2次,细胞接种于6孔板,每孔均加入Trizol溶液10 μL,提取总RNA。检测RNA浓度,将样品稀释50倍,引物用Primer3.0软件设计:α-SMA上游;5’-GGGGGTGATGGTGGGAATG-3’,下游:5’-GCAGGGATGCTCTT-3’;β-actin基因引物上游:5’-GTGGACATCCGCAAAGA-3’,下游:5’-CTCGTCATACTCCTGCTTG-3’。95 ℃、预变性90 s,94 ℃、变性40 s,55 ℃退火40 s,72 ℃延伸40 s,总共28个循环。72 ℃,延伸5 min。之后进行琼脂糖凝胶电泳,放置于紫外线凝胶成像系统分析成像,并对结果进行照相。
2 结果
2.1倒置相差显微镜下观察各组HLEC的形态学特征对照组的细胞均匀贴壁生长,胞体无色透明(图1);bFGF 1组细胞数量多于对照组,可见较多的梭形细胞贴壁生长,胞浆丰富(图2);bFGF 2组梭形细胞数量更多,几乎满视野,细胞看起来更加透亮,胞间出现长的凸起相互连接生长呈拉网状(图3);PD98059组细胞状况最差,细胞数量明显降低,细胞生长停滞,细胞基本呈圆球形,个别出现核固缩,未见梭形细胞,未见贴壁生长,基本悬浮于培养液中(图4);bFGF+PD98059 1组,可见细胞数量较对照组减少,细胞基本贴壁生长,胞体扁平,细胞核也较扁平,细胞透明度下降,胞内可见大量致密颗粒,少量核固缩细胞悬浮于培养液中(图5);bFGF+PD98059 2组,细胞数量,明显少于对照组,细胞肿胀增大,漂浮的细胞增多(图6)。
2.2bFGF及PD98059对各组HLEC存活率的影响HLEC的数量在加了bFGF时均增多,细胞活性增强,bFGF 1组细胞存活率达104.54%,bFGF 2组细胞存活率126.34%,作用时间较长组,细胞数量多于作用短组,差异有统计学意义(P<0.05);只加bFGF组细胞数量明显多于只加阻断剂组,PD98059组细胞存活率仅30.03%,与对照组比较差异有统计学意义(P<0.05);bFGF+PD98059 1组细胞存活率为65.12%,bFGF+PD98059 2组细胞存活率为 62.33%,两组间差异无统计学意义(P>0.05)。
2.3bFGF通过ERK1/2信号通路对α-SMA表达的影响RT-PCR结果显示,在bFGF作用剂量不变的情况下,随着作用时间的延长,可见α-SMA mRNA表达明显增加(6 h的表达量明显多于1 h),呈时间相关性;在bFGF刺激1 h的情况下,加PD98059作用后α-SMA mRNA表达比未加组减少;在bFGF作用6 h后,α-SMA mRNA表达最高,加阻断剂PD98059作用后,α-SMA mRNA表达减少,PD98059表现出较强的抑制作用(图7)。
3 讨论
PCO的形成与LEC密切相关,该细胞是单层立方上皮细胞,主要分布于晶状体的前囊及赤道部,晶状体的透明性与LEC的自身状况和生长情况紧密关联。
3.1bFGF与PCO的关系目前公认PCO的特点:(1)发生与年龄相关:年龄越小,发生率越高,儿童的发病率基本可以达100%。随着年龄的增加,LEC表达bFGF基因以及合成bFGF的能力逐渐降低[7]。(2)细胞学基础是由白内障术后晶状体囊袋内残留的或新生的LEC在bFGF的作用下发生增殖、迁移和分化形成纤维膜引起。(3)PCO的组织病理学研究已发现HLEC转分化为肌纤维母细胞并且可以在这些细胞中用免疫组织化学染色的方法见到表达较多的α-SMA[8-10]。
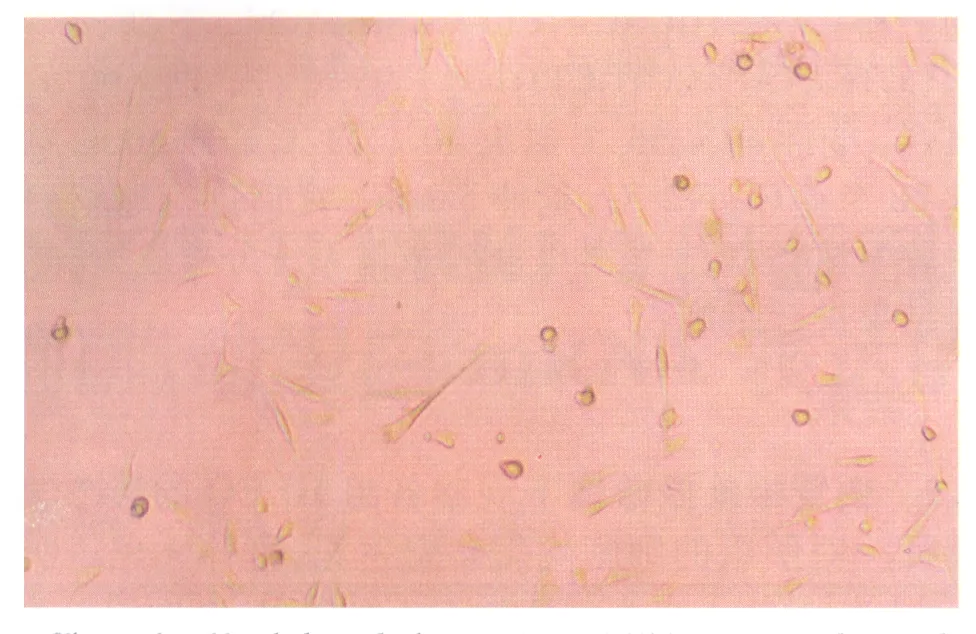
Figure 1 Morphological characteristic of HLEC in normal control group(×100) 正常对照组HLEC的形态学特征(×100)

Figure 2 Morphological characteristic of HLEC in bFGF 1 group(×100) bFGF 1组HLEC的形态学特征(×100)

Figure 3 Morphological characteristic of HLEC in bFGF 2 group(×100) bFGF 2组HLEC的形态学特征(×100)
本研究中,bFGF作用一段时间后HLEC有α-SMA分泌,并且在设定的6 h随作用时间的增加逐渐增多。在只加PD98059时,α-SMA的分泌量最少。

Figure 4 Morphological characteristic of HLEC in PD98059 group(×200) PD98059组HLEC的形态学特征(×200)
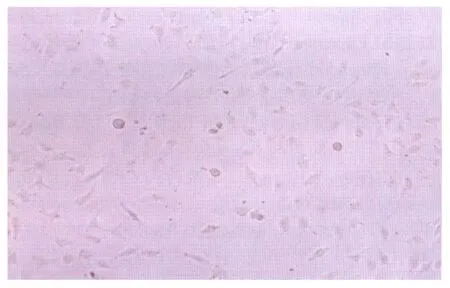
Figure 5 Morphological characteristic of HLEC in bFGF+PD98059 1 group(×200) bFGF+PD98059 1组HLEC的形态学特征(×200)
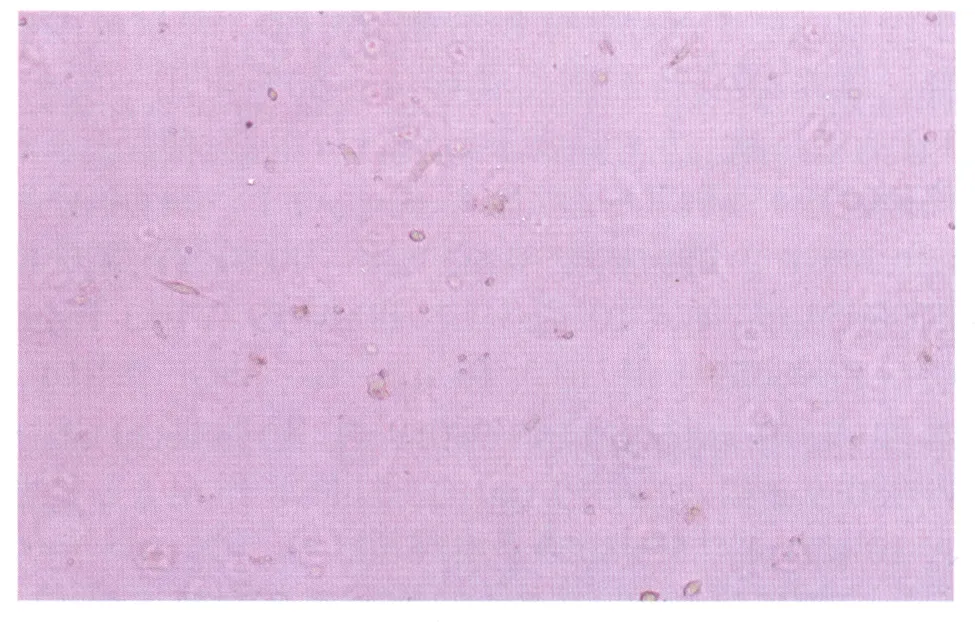
Figure 6 Morphological characteristic of HLEC in bFGF+PD98059 2 group(×200) bFGF+PD98059 2组HLEC的形态学特征(×200)
3.2bFGF对HLEC具有促增殖作用,在低浓度剂量不变的前提下,呈时间相关性后囊膜混浊、PCO的发生与生长因子的作用密切相关,bFGF对建立和维护正常晶状体生理状态极其重要,在正常人体环境中低剂量持续存在。FGF分为bFGF和aFGF,在LEC中发挥生物学效用的主要是bFGF,bFGF也称为纤维细胞生长因子2(FGF2), FGF型受体是酶偶联受体,对细胞产生胞外刺激,激活相关酶产生生物学效应。bFGF首先与胞膜上RTK结合可造成细胞膜上两个相邻的RTK的相互吸引从而形成二聚体,随后发生磷酸化,进一步激活Ras蛋白,开启MAPK信号通路,启动促分裂原活化蛋白激酶(MAPK)信号通路磷酸化级联反应,调控基因以及表达特定蛋白来影响细胞行为[11-13]。bFGF在正常眼内组织中大量存在,只是表达量较低。已有文献报道在不同浓度下,bFGF分别具有促增生、迁移和促分化作用。在bFGF维持在0.15 μg·L-1低浓度时,主要体现在促进LEC增殖作用,10 μg·L-1时可以观察到HLEC细胞增殖及有丝分裂等细胞活动明显;当bFGF在高浓度范围,达到了30 μg·L-1时,主要表现为促进细胞移行等功能;bFGF达到40 μg·L-1时,还能发挥向纤维细胞诱导分化等作用。研究表明,在刚完成白内障手术的动物眼中检测到bFGF的表达水平开始增高,可以诱导LEC增殖。

Figure 7 Gray analysis graph expression of α-SMA. 1: Normal control group; 2: bFGF 1 group; 3: bFGF 2 group; 4: PD98059 group; 5: bFGF+PD98059 1 group; 6: bFGF+PD98059 2 group α-SMA表达灰度分析图。1:正常对照组;2:bFGF1组;3:bFGF2组;4:PD98059组;5:bFGF+ PD98059 1组;6:bFGF+ PD98059 2组
3.3bFGF及PD98059对HLEC表达α-SMA的影响FGF的信号分子可以有效激活促分裂原活化蛋白激酶家族,其中含量最丰富的是细胞外信号调节激酶ERK。在正常胞内Ras-Raf-MEK-ERK信号途径活化后均能促进细胞由G0/G1期进入S期[14]。PD 98059在体内外实验中都能特异性抑制MAPK激酶的活化,进而抑制ERK1/2的磷酸化,进一步阻断该通路。作用机理主要是通过抑制活性酶的磷酸化来调控G0/G1期细胞[15],达到影响LEC的增殖及调控细胞周期的目的。
术后早期房水中的bFGF浓度明显增高,促进HLEC的增殖,同时对抗了TGF-β的促细胞凋亡作用。作用一段时间后,促进正常细胞的上皮-间质转化,产生正常HLEC不能表达的物质:大量α-SMA、纤维粘连蛋白以及I型及III型胶原等[3]。
PCO的预防一直是研究的热点,从信号通路途径及多种细胞因子入手研究其发生机制特别是术后早期的各种变化,对未来研究指出了一条新的思路。
1 Pei C,Xu Y,Jiang JX,Cui LJ,Li L,Qin L.Application of sustained delivery microsphere of cyclosporine A for preventing posterior capsular opacification in rabbits[J].IntJOphthalmol,2013,6(3):1-7.
2 De Jong-Hesse Y,Kampmeier J,Lang GK,Lang GE.Effect of extracelluar matrix on proliferation and differentiation of porcine lens epithelial cell[J].GraefesArchClinExpOpthalmol,2005,243(5):695-700.
3 Lyengar L,Wang Q,Rasko JE,McAvoy JW,Lovicu FJ.Duration of ERK1/2 phosphorylation induced by FGF orocular media determines lens cell fate[J].Differentition,2007,75(12):662-668.
4 De Iongh RU,Wederell E,Lovicu FJ,McAvoy JW.Transforming growth factor-beta-induced epithelial-mesenchymal transition in the lens:a model for cataract formation[J].CellsTissuesOrgans,2005,179(8):43-55.
5 Pandey SK,Apple DJ,Werner L,Maloof AJ,Milverton EJ.Posterior capsule opacification:a review of the aetiopathogenesis,experimental and clinical studies and factors for prevention[J].IndianJOphthalmol,2004,52(9):99-112.
6 Liu YF,Liu HW,Zhou Y.Differences of bFGF gene expression in lens epithelial cells between fetuses and cataract patients[J].IntJOphthalmol,2010,3(1):58-60.
7 Xiao Y,Zhao B,Gao Z,Pan Q.Overaccumulation of transforming growth factor-beta1 and basic fibroblast growth factor in lens epithelial cells of congenital cataract[J].CanJOphthalmol,2009,44(2):189-192.
8 Buehl W,Findl O,Neumayer T,Georgopoulos M,Sacu S.Short-term changes in the morphology of posterior capsule opacification[J].JCataractRefractSurg,2005,31(2):962-968.
9 Eldred JA,Dawes LJ,Wormstone IM.The lens as a model for fibrotic disease[J].PhilosTransRSocLondBBiolSci,2011,366(1568):1301-1319.
10 Liu H,Wu L,Fu S,Hou Y,Liu P,Cui H,etal.Polylactide-glycoli acid and rapamycin coating intraocular lens prevent posterior capsular opacification in rabbit eyes[J].GraefesArchClinExpOphthalmol,2009,247(6):801-807.
11 王军令,康刚劲,覃冬,牟琳,徐梅.3-氨基苯甲酰胺抑制糖尿病大鼠晶状体混浊的实验研究[J].国际眼科杂志,2013,13(2):240-245.
12 Dawes LJ,Eldred JA,Anderson IK,Coenen T,Lijnen PJ,Fagard RH,etal.TGF beta-induced contraction is not promoted by fibronectin-fibronectin receptor interaction,or alpha SMA expression[J].InvestOphthalmolVisSci,2008,49(2):650-661.
13 MCAoy JW,Chamberlain CG,De longh RU.The role of fibroblast growth factor in eye lens development[J].AnnNYAcadSci,1991,638(1):256-274.
14 Alessi DR,Cuenda A,Cohen P,Sohara E,Ohta A,Rai T,etal.PD098059 is a specific inhibitor of the activation of mitogen—activated protein kinase kinaseinvitroandinvivo[J].JBiolChem,1995,270(46):27489-27494.
15 Yadav UC,Ighani-Hosseinabad F,van Kuijk FJ,Srivastava SK,Ramana KV.Prevention of posterior capsular opacification through aldose reductase inhibition[J].InvestOphthalmolVisSci,2010,50(2):752-759.
date:Dec 26,2013
Effects of bFGF and ERK1/2 blocking agent on α-SMA mRNA expression in human lens epithelial cells
YANG Nan,KANG Gang-Jin,DONG Min
posterior capsule opacification; basic fibroblast growth factor; human lens epithelial cells; alpha smooth muscle actin; extracellular regulated kinase; ERK signal pathway blocker
Objective To observe the effects of basic fibroblast growth factor (bFGF)and extracellular regulated kinase 1/2 (ERK1/2)blocking agent PD98059 on alpha smooth muscle actin (α-SMA)mRNA expression in human lens epithelial cells (HLEC).Methods HLEC were primarily cultured and passagedinvitro. The bFGF (10 μg·L-1)and PD98059 were added and activated for a certain period of time, and then divided according to the activated time. The number and activity of HLEC were detected by MTT, and RT-PCR was used to detect the expression of α-SMA mRNA in HLEC.Results The survival rate of HLEC in bFGF group increased with the time prolong, up to 126.34% at 6 hours, the difference was statistically significant between 1 hour and 6 hours (P<0.05); The cell survival rate in PD98059 group was only 30.03%, there was statistically significant difference compared with the control group (P<0.05). When the dose of bFGF unchanged, as the prolong of time, α-SMA mRNA expression increased significantly, the difference was statistically significant between 1 hour and 6 hours (P<0.05); After bFGF activation for 6 hours, α-SMA mRNA value reached the highest level, after added PD98059, α-SMA mRNA expression reduced, and further decreased with the antagonist action time increased, there was no significant difference between 1 hour and 6 hours (P>0.05). Conclusion bFGF can promote the proliferation of HLEC with time dependence under the stable low dosage. bFGF can promote the α-SMA secretion in HLEC and HLEC differentiation with time and dose dependence.
杨楠,女,1983年4月出生,硕士。联系电话:13550909748;E-mail:54935193@qq.com
AboutYANGNan:Female,born in April,1983.Tel:13550909748;E-mail:54935193@qq.com
2013-12-26
646000 四川省泸州市,泸州医学院附属医院眼科
杨楠,康刚劲,董敏.bFGF与ERK1/2阻断剂对人晶状体上皮细胞α平滑肌肌动蛋白mRNA表达的影响[J].眼科新进展,2014,34(4):326-329.
��
10.13389/j.cnki.rao.2014.0088
修回日期:2014-01-12
本文编辑:董建军
Accepteddate:Jan 12,2014
From theDepartmentofOphthalmology,AffiliatedHospitalofLuzhouMedicalCollege,Luzhou646000,SichuanProvince,China
[RecAdvOphthalmol,2014,34(4):326-329]