骨髓间充质干细胞对视网膜缺血再灌注损伤中Fas和FasL表达的影响△
曲群 曹永亮 李娜娜 韩延燕 梁冰
骨髓间充质干细胞对视网膜缺血再灌注损伤中Fas和FasL表达的影响△
曲群 曹永亮 李娜娜 韩延燕 梁冰
视网膜缺血再灌注损伤;骨髓间充质干细胞移植;Fas; FasL
目的探讨骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSC)移植对大鼠视网膜缺血再灌注损伤(retinal ischemia reperfusion injury,RIRI)凋亡相关因子Fas和FasL表达的影响。方法体外贴壁筛选法培养大鼠BMSC。将39只健康成年SD大鼠随机分成正常组3只、模型组18只、BMSC移植组18只。各组大鼠均选择右眼作为实验眼建立大鼠RIRI模型,正常组不做任何处理。另2组大鼠于RIRI后1 h分别给予玻璃体腔注射PBS缓冲液(模型组)、BMSC(BMSC移植组),并于RIRI后2 h、6 h、12 h、24 h、48 h、72 h各随机处死3只SD大鼠,迅速摘取右眼。免疫组织化学法检测大鼠视网膜组织Fas和FasL的阳性细胞数情况。结果正常视网膜组织中Fas极少表达,FasL视网膜全层低表达。RIRI后2 h、6 h、12 h、24 h、48 h、72 h,模型组Fas阳性细胞数分别为(20.5±0.9)个·mm-2、(263.6±15.6)个·mm-2、(583.5±15.8)个·mm-2、(1184.6±45.5)个·mm-2、(684.5±3.5)个·mm-2、(80.6±4.5)个·mm-2,BMSC移植组分别为(19.8±0.8)个·mm-2、(238.5±14.7)个·mm-2、(473.6±13.6)个·mm-2、(964.5±23.7)个·mm-2、(632.6±5.8)个·mm-2、(72.5±6.3)个·mm-2;模型组FasL阳性细胞数分别为(42.2±0.9)个·mm-2、(57.3±0.9)个·mm-2、(365.8±7.5)个·mm-2、(1004.3±17.9)个·mm-2、(793.5±8.6)个·mm-2、(210.6±4.9)个·mm-2,BMSC移植组分别为(40.5±0.8)个·mm-2、(55.6±0.7)个·mm-2、(351.2±6.8)个·mm-2、(992.8±6.0)个·mm-2、(683.4±12.9)个·mm-2、(206.3±4.7)个·mm-2。与模型组比较,BMSC移植组各时间点Fas、FasL的阳性细胞数明显减少。Fas在6~48 h各组差异有统计学意义(P<0.05),FasL在12~48 h各组差异有统计学意义(P<0.05)。结论RIRI后Fas/FasL表达水平升高,而玻璃体腔内注射BMSC抑制Fas/FasL的表达,证明BMSC移植对RIRI有治疗作用。
[眼科新进展,2014,34(4):310-313]
视网膜缺血再灌注损伤(retinal ischemic reperfusion injury,RIRI)是眼科临床常见的病理过程,其发生机制十分复杂[1],可导致视网膜神经细胞凋亡,严重影响患者的视力。RIRI的防治研究已成为近年眼科研究的热点。骨髓间充质干细胞(bone marrow-mesenchymal stem cells,BMSC)是一类未分化的原始祖细胞,本实验通过制备大鼠RIRI模型,探索玻璃体腔注射BMSC对大鼠RIRI的治疗作用及对凋亡因子Fas、FasL表达的影响。
1 材料与方法
1.1实验动物与分组成年健康无眼疾SD大鼠39只(雌雄不限),体质量250~300 g,室温环境喂养,随机分为正常组3只、模型组18只、BMSC移植组18只,后两组根据缺血再灌注时间分别分为2 h、6 h、12 h、24 h、48 h、72 h 6个亚组。各组大鼠均选择右眼作为实验眼。
1.2BMSC分离、培养、鉴定
1.2.1BMSC分离、培养采用体外贴壁筛选法培养大鼠BMSC。5周龄健康雄性SD大鼠10 g·L-1戊巴比妥钠麻醉处死,无菌条件下分离双侧股骨并切开骨两端关节面,PBS缓冲液反复冲洗骨髓腔,冲洗液以1000 r·min-1离心5 min,弃上清液,重悬按(1.0~1.2)×109L-1的细胞浓度在培养基中培养。48~60 h后首次换液,弃未贴壁细胞,此后隔天换液,13~15 d后镜下观察细胞融合至80%~90%时按12进行传代培养,收集传4~5代BMSC备移植用。
1.2.2BMSC的鉴定
1.2.2.1BMSC形态学变化倒置相差显微镜观察BMSC生长情况。刚接种的细胞悬浮呈球形,24~36 h后细胞大部分贴壁生长,呈纺锤形,继而细胞增多,体积增大,向四周呈放射状扩展。传代后细胞生长旺盛,呈长梭形分布。
1.2.2.2BMSC抗原鉴定应用检测BMSC阳性和阴性表达的抗原鉴定。取生长良好的传4~5代细胞,采用链霉亲和素-生物素-过氧化物酶复合物法(SABC)检测细胞表面抗原CD44和CD45的表达。免疫细胞化学染色显示CD44表达呈阳性而CD45表达呈阴性,表明培养的细胞为BMSC。
1.3动物模型制备前房加压法制备大鼠RIRI模型[2],正常组不做任何处理。10 g·L-1戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉,固定。复方托吡卡胺滴眼液散瞳(右眼),盐酸奥布卡因滴眼液局部麻醉。将连接250 mL生理盐水的输液器针头从大鼠右眼的颞侧角巩膜缘刺入前房并固定,保持液平面与大鼠前房垂直距离约150 cm,此时可见球结膜苍白、角膜雾状水肿混浊、前房变深,间接眼底镜见视网膜色淡,血流中断,持续加压90 min,缓慢降低前房压力至拔出针头,可观察到球结膜充血、角膜恢复透明,视网膜血供恢复,RIRI模型成功建立。术后氯霉素滴眼液滴右眼(4次·d-1)预防感染。
1.4BMSC玻璃体腔注射RIRI模型建立后1 h,消毒手术区,抽取5 μL PBS悬液或5 μL含有BMSC的PBS悬液(45×103~50×103个活细胞),显微镜下自右眼颞侧角巩膜缘分别注入模型组或BMSC移植组大鼠玻璃体腔内[3-4],术后氯霉素滴眼液滴右眼(4次·d-1)。
1.5标本的采集、处理各组大鼠按时间点随机麻醉处死,立即摘除右眼,置于体积分数10%甲醛固定液中固定24 h,流水冲洗,酒精梯度脱水,二甲苯透明,浸蜡,包埋,切片。
1.6Fas/FasL免疫组织化学染色切片、展片、捞片、烤片,脱蜡入水,滴加体积分数0.3% H2O2孵育,抗原修复,山羊血清封闭,后依次滴加一抗、生物素化二抗,SABC、DAB显色,复染,脱水,透明,封片。

2 结果
2.1视网膜Fas的表达正常组Fas极少表达;RIRI后2 h模型组和BMSC移植组呈浅黄至棕黄色颗粒状染色的阳性表达仍极少,6 h后开始少量表达,主要位于神经节细胞层以及神经纤维层,12 h明显增多,同时出现在内核层,24 h达到高峰(图1-图2),48 h后开始减少,至72 h明显下降,但仍有低表达;BMSC移植组各时间点的阳性细胞数均低于模型组,阴性对照未见阳性细胞。其中6 h、12 h、24 h、48 h组2组差异均有统计学意义(均为P<0.05,见表1)。
2.2视网膜FasL的表达正常组FasL视网膜全层低表达;RIRI后2 h、6 h模型组和BMSC移植组呈棕黄至棕褐色颗粒状染色的阳性表达增加不明显,12 h开始升高,主要见于神经节细胞层以及神经纤维层,24 h达到高峰(图3-图4),48 h开始减少,72 h仍有较高表达但低于48 h;BMSC移植组各时间点阳性细胞数均低于模型组,阴性对照未见阳性细胞。其中12 h、24h、48 h组差异有统计学意义(均为P<0.05,见表2)。
表1 模型组与BMSC移植组不同时间点Fas的阳性细胞数Table 1 Number of Fas positive cells in model group and BMSC transplantation group at different time points(±s,cell·mm-2)
表2 模型组与BMSC移植组不同时间点FasL的阳性细胞数Table 2 Number of FasL positive cells in model group and BMSC transplantation group at different time points(±s,cell·mm-2)

Figure 1 Expression of Fas in retina of model group at 24 hours after RIRI(×400) 模型组RIRI后24 h视网膜Fas的表达情况(×400)

Figure 2 Expression of Fas in retina of BMSC transplantation group at 24 hours after RIRI(×400) BMSC移植组RIRI后24 h视网膜Fas的表达情况(×400)

Figure 3 Expression of FasL in retina of model group at 24 hours after RIRI (×400) 模型组RIRI后24 h视网膜FasL的表达情况(×400 )
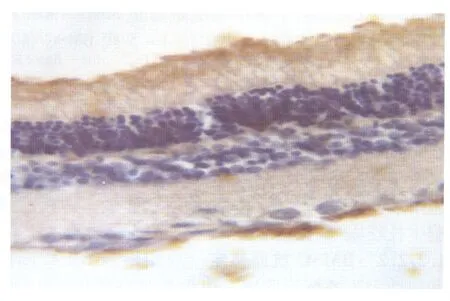
Figure 4 Expression of FasL in retina of BMSC transplantation group at 24 hours after RIRI(×400) BMSC移植组RIRI后24 h视网膜FasL的表达情况(×400 )
3 讨论
RIRI在眼科疾病中普遍存在,常见于青光眼、视网膜血管阻塞性疾病以及影响视网膜血流的手术操作。但在临床治疗过程中,RIRI的发生机制尚不明确,有研究发现氧自由基的连锁反应及钙超载是引起组织损伤的主要环节[5],而凋亡可能是RIRI中视网膜细胞死亡的主要形式[6]。许多因素参与了对细胞凋亡的调控,其中Fas/FasL的膜受体死亡通路是其调控的关键。Fas是一种启动细胞外源性死亡受体途径的细胞凋亡因子,是细胞表面的膜受体蛋白,属于神经生长因子受体及肿瘤坏死因子受体超家族的成员。FasL是其天然的配体,与Fas是三维对称结构,这种互补的结合形式既可以发生在相邻的细胞间,又可以在相同的细胞上,或是自携带的细胞表面游离再与Fas结合[7],向细胞内转导凋亡信号,然后通过Caspase家族引起一系列级联反应导致阳性表达Fas的靶细胞不可逆性凋亡。
BMSC是存在于骨髓组织中的非造血干细胞,具有多向分化的潜能[8]及良好的可塑性,视网膜移植后可存活[9],又有定向迁移能力[10],缺少免疫性且组织融合性好。此外由于取材充足、培养技术简单、可冷冻保存,不违背伦理道德等特点使其成为细胞基因治疗研究中的理想种子细胞,具有重要潜在的临床应用价值。同时Rosenbaum等[11]发现在大鼠脑RIRI中Fas/FasL的表达升高,同时神经元细胞的凋亡与Fas/FasL的表达位置相符。实验结果表明在正常视网膜组织中Fas极少表达但FasL低度表达,说明了Fas/FasL系统存在于正常视网膜组织中。RIRI后Fas和FasL的阳性细胞数较正常组明显升高,主要见于神经纤维层及神经节细胞层;同时发现Fas/FasL表达的高峰时间相同,而且高表达的部位也是细胞凋亡的主要位置,其表达规律与Rosenbaum等[11]的研究相一致,提示Fas/FasL的过度表达可能导致了视网膜靶细胞的凋亡。72 h后FasL持续维持在高表达状态说明其对靶细胞的损伤是持续存在的。此外向玻璃体腔内注射BMSC可明显降低Fas/FasL的阳性表达,Fas阳性细胞数在12~24 h BMSC移植组较模型组明显减少,而FasL在12~48 h明显减少。由此可推测:抑制Fas/FasL过度表达、进而抑制细胞凋亡可能是BMSC治疗RIRI的作用机理之一。
1 Osborne NN,Casson RJ,Wood JP,Chidlow G,Graham M,Melena J.Retinal ischemia:mechanisms of damage and potential therapeutic strategies[J].ProgRetinEyeRes,2004,23(1):91-147.
2 Gehlbach PL,Purple RL.A paired comparison of two models of experimental retinal ischemia[J].CurrEyeRes,1994,13(8):597-602.
3 Aoki H,Hara A,Niwa M,Motohashi T,Suzuki T,Kunisada T .Transplantation of cells from eye-like structures differentiated from embryonic stem cellsinvitroandinvivoregeneration of retinal ganglion-like cells[J].GraefesArchClinExpOphthalmol,2008,246(2):255-265.
4 Minamino K,Adachi Y,Yamada H,Hiquchi A,Suzuki Y,Iwasaki M,etal.Long-term survival of bone marrow-derived retinal nerve cells in the retina[J].Neuroreport,2005,16(12):1255-1259.
5 Yue TL,Ma XL,Wang X,Romanic AM,Liu GL,Louden C,etal.Possible involvement of stress-activated protein kinase signaling pathway and Fas receptor expression in prevention of ischemia/reperfusion-induced cardiomyocyte apoptosis by carvedilol[J].CircRes,1998,82(2):166-174.
6 Kaneda K,Kashii S,Kurosawa T,Kaneko S,Akaike A,Honda Y,etal.Apoptotic DNA fragmentation and upregulation of Bax induced by transient ischemia of the rat retina[J].BrainRes,1999,815(1):11-20.
7 牛膺筠,张瑞,周占宇,王红云,刘夫玲.碱性成纤维细胞生长因子对鼠视网膜缺血再灌注损伤的治疗作用[J].中华眼科杂志,2002,38(5):530-533.
8 Smith AG.Embryo-derived stem cells:of mice and men[J].AnnuRevCellDevBiol,2001,17(4):435-462.
9 Arnhold S,Absenger Y,Klein H,Addicks K,Schraermeyer U.Transplantation of bone marrow-derived mesenchymal stem cells rescue photoreceptor cells in the dystrophic retina of the rhodopsin knockout mouse[J].GraefesArchClinExpOphthalmol,2007,245(3):414-422.
10 鲁铃铃,刘玉军,孙晓红,刘华松,孙正,杨慧.骨髓间质干细胞在大鼠体内的迁移研究[J].中国生物工程杂志,2005,25(4):22-28.
11 Rosenbaum DM,Gupta G,D’Amore J,Singh M,Weidenheim K,Zhang H,etal.Fas (CD95/APO-1)plays a role in the pathophysiology of focal cerebral ischemia[J].JNeurosciRes,2000,61(6):686-692.
date:Nov 26,2013
Natural Science Foundation of Shandang Province(No:Y2007C084);Foundation of Education Department of Shandong Province(No:J07YE02)From theDepartmentofOphthalmology,WeifangMedicalCollege(QU Qun,HAN Yan-Yan),Weifang261042,ShandongProvince,China;DepartmentofOphthalmology,AffiliatedHospitalofWeifangMedicalCollege(CAO Yong-Liang,LIANG Bing),Weifang261031,ShandongProvince,China;ShangdongLunanEyeHospital(LI Na-Na),Linyi276000,ShandongProvince,China
Effects of bone marrow mesenchymal stem cells transplantation on expressions of Fas and FasL in retinal ischemia reperfusion injury
QU Qun,CAO Yong-Liang,LI Na-Na,HAN Yan-Yan,LIANG Bing
retinal ischemia reperfusion injury; bone marrow mesenchymal stem cells transplantation; Fas; FasL
Objective To probe into the effects of bone marrow mesenchymal stem cells (BMSC)transplantation on expressions of Fas and FasL in rat retinal ischemia reperfusion injury(RIRI). Methods Adherent screening method was used to culture rat BMSCinvitro.Thirty-nine healthy adult SD rats were random divided into three groups: normal group (3 cases), model group (18 cases)and BMSC transplantation group (18 cases).The rats of model group and BMSC transplantation group were selected the right eye as the experimental eye and the model of RIRI was established, the normal group without any treatment. At 1 hour after RIRI, the rats of model group and BMSC transplantation group were separately intravitreal injected PBS buffer solution and BMSC, and then each group respectively were sacrificed 3 rats randomly at 2 hours, 6 hours, 12 hours, 24 hours, 48 hours, 72 hours after RIRI, and eyeballs were extracted rapidly. The expressions of Fas and FasL were detected by immunohistochemistry assay.Results In normal retinal tissue, Fas was rarely expressed and FasL was in low expression. At 2 hours, 6 hours, 12 hours, 24 hours, 48 hours, 72 hours after RIRI, the levels of Fas in model group were (20.5±0.9)cell·mm-2, (263.6±15.6)cell·mm-2, (583.5±15.8)cell·mm-2, (1184.6±45.5)cell·mm-2, (684.5±3.5)cell·mm-2, (80.6±4.5)cell·mm-2, respectively, and in BMSC transplantation group were (19.8±0.8)cell·mm-2, (238.5±14.7)cell·mm-2, (473.6±13.6)cell·mm-2, (964.5±23.7)cell·mm-2, (632.6±5.8)cell·mm-2, (72.5±6.3)cell·mm-2, respectively; The levels of FasL in model group were (42.2±0.9)cell·mm-2, (57.3±0.9)cell·mm-2, (365.8±7.5)cell·mm-2, (1004.3±17.9)cell·mm-2, (793.5±8.6)cell·mm-2, (210.6±4.9)cell·mm-2, respectively, and in BMSC transplantation group were (40.5±0.8)cell·mm-2, (55.6±0.7)cell·mm-2, (351.2±6.8)cell·mm-2, (992.8±6.04)cell·mm-2, (683.4±12.9)cell·mm-2, (206.3±4.7)cell·mm-2, respectively. Compared with the model group, the number of Fas/FasL positive expression at each time point in BMSC transplantation group decreased significantly. Fas had a statistically significant difference between 2 hours, 6 hours, 12 hours, 24 hours, 48 hours groups (P<0.05), FasL had a statistically significant difference between 12 hours, 24 hours, 48 hours groups (P<0.05).Conclusion The expressions of Fas and FasL increase after RIRI, but the intravitreal injection of BMSC can inhibit the expressions of Fas and FasL, which prove that BMSC transplantation has a therapeutic effect on RIRI.
曲群,女,1986年出生,硕士。主要研究方向:玻璃体视网膜疾病。E-mail:qququn@163.com
AboutQUQun:Female,born in 1986.Master degree.E-mail:qququn@163.com
2013-11-26
山东省自然科学基金资助(编号:Y2007C084);山东省教育厅基金资助(编号:J07YE02)
261042 山东省潍坊市,潍坊医学院眼科教研室(曲群,韩延燕);261031 山东省潍坊市,潍坊医学院附属医院眼科中心(曹永亮,梁冰);276000 山东省临沂市,山东省鲁南眼科医院(李娜娜)
曹永亮,E-mail:caoyongliang1965@163.com
曲群,曹永亮,李娜娜,韩延燕,梁冰.骨髓间充质干细胞对视网膜缺血再灌注损伤中Fas和FasL表达的影响[J].眼科新进展,2014,34(4):310-313.
��
10.13389/j.cnki.rao.2014.0084
修回日期:2014-01-04
本文编辑:董建军
Accepteddate:Jan 4,2014
Responsibleauthor:CAO Yong-Liang,E-mail:caoyongliang1965@163.com
[RecAdvOphthalmol,2014,34(4):310-313]