COX-2抑制剂对NMDA损伤视网膜神经节细胞层神经元的保护机制研究△
徐露 田晗 李玉桑 姚光强 唐和斌 奉黎静 刘敏
COX-2抑制剂对NMDA损伤视网膜神经节细胞层神经元的保护机制研究△
徐露 田晗 李玉桑 姚光强 唐和斌 奉黎静 刘敏
视网膜;N-甲基-D天冬氨酸;COX-2抑制剂; 细胞凋亡;神经保护
目的探讨COX-2抑制剂NS398对N-甲基-D天冬氨酸(N-methyl-D-aspartate,NMDA)诱导的大鼠视网膜损伤模型的神经保护作用。方法25只大鼠随机分成5组:正常组、NMDA组、NMDA+不同剂量NS-398(1 ng·mL-1、10 ng·mL-1、100 ng·mL-1)组。NMDA组于大鼠双眼玻璃体内注射5 μL NMDA(40 nmol·L-1),NMDA+不同剂量NS-398组于大鼠双眼玻璃体内注射5 μL NMDA(40 nmol·L-1)及NS-398(1 ng·mL-1,10 ng·mL-1,100 ng·mL-1)。7 d后,取眼球组织,并对视网膜神经节细胞层(retinal ganglion cell layer,RGCL)神经元数目进行计数,采用TUNEL法和免疫组织化学染色分别测定RGCL神经元的凋亡以及视网膜组织中caspase-3、COX-2的表达。结果NMDA组大鼠RGCL神经元数目为正常大鼠的(47±3)%,与NMDA组比较,NMDA+NS-398组的RGCL神经元数目明显增多,低、中、高三种剂量组RGCL神经元数目依次为正常组的(63±5)%、(82±7)%、(73±3)%;NMDA组caspase-3的表达为正常组的(327±21)%, NMDA+NS-398组caspase-3的表达显著下调,低、中、高三种剂量组caspase-3的表达依次为正常组的(223±14)%、(197±18)%、(261 ±16)%;NMDA组COX-2的表达为正常组的(315±11)%,NMDA+NS-398组的表达显著下调,低、中、高三种剂量组COX-2的表达依次为正常组的(280±20)%、(233±16)%、(255±19)%。结论抑制COX-2表达能够抑制NMDA导致的RGCL细胞凋亡,对视网膜产生保护作用。
[眼科新进展,2014,34(4):301-305]
视网膜病变的临床症状主要为不同程度的视力障碍,包括青光眼、黄斑变性、糖尿病视网膜病变、早产儿视网膜病变等疾病。很多证据表明视网膜缺血可引起视网膜神经节细胞(retinal ganglion cell,RGC)凋亡,视网膜兴奋性氨基酸主要为谷氨酸和天冬氨酸[1]。在青光眼、黄斑变性等眼病中,视神经元的损伤主要是由于兴奋性氨基酸受体如N-甲基-D天冬氨酸(N-methyl-D-aspartate,NMDA)受体被过激活[2],NMDA受体引起细胞内的钙离子通道开放,使细胞内钙离子超载,过多的钙离子激活了许多钙离子相关的蛋白酶,如核酸内切酶、蛋白酶、一氧化氮合酶,钙蛋白酶通过介导的细胞膜骨架及机构蛋白的过度降解可引起细胞丢失[3],诱导视网膜神经节细胞层(retinal ganglion cell layer,RGCL)神经元凋亡。NS-398是环氧化酶-2(cyclooxygenase-2,COX-2)的一种选择性抑制剂[4],COX-2在炎症过程中起着重要作用,可促进血管扩张,同时发挥致热、致痛效应[5],导致视网膜损伤[6-7]。本实验通过建立NMDA诱导的大鼠视网膜损伤模型,观察视网膜组织中视神经元数目变化与COX-2、凋亡蛋白caspase-3等表达的相互关系,并阐明其相关的机制。
1 材料与方法
1.1实验仪器及试剂
1.1.1主要仪器切片机(德国,Leica Rm2265),石蜡包埋机(德国,Leica EG0050H),脱水机(德国,Leica TP1020),摊片机(德国,Leica HI1210),烘片机(德国,Leica 1220),显微镜系统(日本,Nikon Eclipse Ti),高速台式离心机(上海,安亭TGL-20B),NuanceTM多光谱显微成像系统(凯隆国际实业有限公司)。
1.1.2主要试剂NMDA(Sigma 公司,美国),NS-398(Beyotime 公司,中国),戊巴比妥钠(Merk,德国),硫酸阿托品(安阳九州药业),盐酸利多卡因注射液(山东华鲁制药有限公司),氧氟沙星滴眼液(郑州卓峰制药有限公司),诺氟沙星滴眼液(武汉五景药业有限公司),TUNEL试剂盒(武汉博士德生物工程有限公司),caspase-3抗体(武汉博士德生物工程有限公司),COX-2抗体(武汉博士德生物工程有限公司),福尔马林(Sigma公司,美国),实验用水为超纯水。
1.2方法
1.2.1动物及分组雄性SD健康大鼠25只,体质量150~200 g,由华中科技大学实验动物中心提供。随机分为5组:正常组、NMDA组、NMDA+不同剂量NS-398(1 ng·mL-1、10 ng·mL-1、100 ng·mL-1)组,每组5只。所有的动物实验和处理均遵照《实验动物使用指南》[8]。
1.2.2动物造模及给药方法动物适应环境1周后,制备大鼠视网膜神经元损伤模型。除正常组外,各组大鼠腹腔注射3 g·L-1戊巴比妥钠麻醉,双眼滴入10 g·L-1硫酸阿托品扩瞳以及盐酸利多卡因局部麻醉。具体方法为:采用尖头微量注射器于NMDA组的大鼠双眼玻璃体内注射5 μL NMDA(40 nmol·L-1);NMDA+NS-398低、中、高剂量组的大鼠双眼玻璃体内混合注射5 μL NMDA(40 nmol·L-1)及NS-398(1 ng·mL-1、10 ng·mL-1、100 ng·mL-1)。随后,继续饲养并每天采用氧氟沙星滴眼液和诺氟沙星滴眼液处理(每天1次),以预防感染。
1.2.3取材NMDA处理后第7天处死各组大鼠。摘取双眼眼球组织,福尔马林固定,24 h后用流水冲洗2 h,然后梯度乙醇脱水、常规石蜡包埋、切片。
1.2.4免疫组织化学染色测定COX-2、caspase-3的表达各组每只大鼠任意选取3张石蜡切片,常规二甲苯脱蜡;滴加新制体积分数3%双氧水,置于湿盒中,室温静置15 min,蒸馏水冲洗。10 g·L-1胰酶覆盖,湿盒37 ℃保持1 h,PBS冲洗。血清封闭40 min后甩干,各组每片分别滴加100 μL COX-2抗体(抗鼠)和 caspase-3抗体(抗鼠),4 ℃保存过夜。PBS冲洗,每片滴加二抗,室温保持30 min,PBS冲洗。DAB发色。蒸馏水冲洗,苏木精复染,梯度甲醇脱水,二甲苯透明,中性树脂封片,光学显微镜下观察,并用NuanceTM多光谱进行定量分析处理。
1.2.5HE染色测定RGCL神经元数目各组每只大鼠任意选取3张石蜡切片,常规二甲苯脱蜡,梯度乙醇脱水,蒸馏水清洗。苏木精染色,流水冲洗。伊红染色,蒸馏水清洗,梯度甲醇脱水,二甲苯透明,中性树脂封片。随机选取三个视野,于显微镜下观察视网膜厚度并对RGCL神经元进行计数。计数方法:同一倍率下,记录RGCL长为200 μm(长度以标尺为准,平行于RGCL方向)的任意区域内神经元数目,取平均值。
1.2.6TUNEL法测定RGCL神经元的凋亡各组每只大鼠任意选取3张石蜡切片,常规二甲苯脱蜡;滴加新制体积分数3%双氧水,室温保持10 min;0.01 mol·L-1TBS冲洗,蛋白酶K湿盒37 ℃消化15 min;每片标本加20 μL标记缓冲液,以保持切片湿润,甩去切片上多余的液体后,每片加20 μL TUNEL反应液,置于湿盒中37 ℃保持2 h。TBS冲洗。每片加封闭液50 μL,室温保持30 min后甩去。用抗体稀释液稀释生物素化抗地高辛抗体,每片滴加50 μL,置于37 ℃湿盒中30 min,TBS冲洗。甩去其他水分,将用抗体稀释液稀释后的SABC滴加至标本片上,每片50 μL,置于37 ℃湿盒中30 min,TBS冲洗。DAB显色,苏木精轻度复染,梯度甲醇脱水,二甲苯透明,中性树脂封片,光学显微镜下观察,并用NuanceTM多光谱进行定量分析处理。

2 结果
2.1各组大鼠COX-2的表达测定与正常组相比,NMDA组大鼠RGCL细胞有明显棕黄色,即COX-2有表达;与NMDA组相比,NMDA+NS-398(10 ng·mL-1)组COX-2的表达显著下调,而NMDA+NS-398(1 ng·mL-1)组和NMDA+NS-398(100 ng·mL-1)组COX-2的表达略有降低(图1)。NMDA造模后COX-2的表达上调,其表达率为正常组的(315±11)%,差异有显著统计学意义(P<0.001),而给予NS-398(1 ng·mL-1、10 ng·mL-1和100 ng·mL-1)能够抑制COX-2的表达,其低、中、高三种剂量组依次表达率分别为正常组的(280±20)%、(233±16)%、(255±19 )%(图2)。

Figure 1 Expression of COX-2 in rat retinas of each group detected by immunohistochemical staining (×40). A: Control group; B: NMDA group; C: NMDA+1 ng·mL-1 NS-398 group; D: NMDA+10 ng·mL-1 NS-398 group; E: NMDA+100 ng·mL-1 NS-398 group 免疫组织化学检测各组大鼠视网膜COX-2的表达(×40)。A:对照组;B:NMDA组;C:NMDA+1 ng·mL-1 NS-398组;D:NMDA+10 ng·mL-1 NS-398组;E:NMDA+100 ng·mL-1 NS-398组

Figure 2 Quantitative analysis of COX-2 expression in each group 各组大鼠视网膜COX-2的表达量
2.2各组大鼠caspase-3的表达测定与正常组相比,NMDA组大鼠RGCL细胞有明显棕黄色,即caspase-3表达;与NMDA组相比,NMDA+NS-398(10 ng·mL-1)组RGCL细胞caspase-3阳性表达显著降低,NMDA+NS-398(1 ng·mL-1)组RGCL细胞阳性表达也显著降低,NMDA+NS-398(100 ng·mL-1)组RGCL细胞阳性表达略有降低(图3)。多光谱定量结果表明: NMDA造模后caspase-3的表达上调,其表达率为正常组的(327±21)%,差异有统计学意义(P<0.001),而给予NS-398(1 ng·mL-1,10 ng·mL-1和100 ng·mL-1)能够抑制caspase-3的表达,其低、中、高三种剂量组caspase-3表达率分别为正常组的(223±14)%、(197±18)%、(261±16)%(图4)。
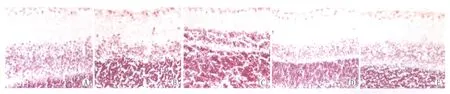
Figure 3 Expression of caspase-3 in rat retinas of each group detected by immunohistochemical staining (×40). A: Control group; B: NMDA group; C: NMDA+1 ng·mL-1 NS-398 group; D: NMDA+10 ng·mL-1 NS-398 group; E: NMDA+100 ng·mL-1 NS-398 group 免疫组织化学检测各组大鼠视网膜caspase-3的表达(×40)。A:对照组;B:NMDA组;C:NMDA+1 ng·mL-1 NS-398组;D:NMDA+10 ng·mL-1 NS-398组;E:NMDA+100 ng·mL-1 NS-398组
2.3各组大鼠HE染色切片RGCL神经元计数与正常组相比,NMDA组大鼠RGCL神经元数目显著减少;与NMDA组相比,NMDA+NS-398(10 ng·mL-1)组大鼠视网膜RGCL层神经元数目显著增加,且NMDA+NS-398(1 ng·mL-1)和NMDA+NS-398(100 ng·mL-1)组RGCL层神经元数目也均有所增加(图5)。同一倍率单位区域内,NMDA组RGCL神经元数目为正常组的(47±3)%,差异有显著统计学意义(P<0.001),而给予NS-398(1 ng·mL-1、10 ng·mL-1和100 ng·mL-1)能够明显改善RGCL神经元丢失,其低、中、高三种剂量组RGCL神经元的数目分别为正常组的(63±5)%、(82±7)%、(73±3)% (图6)。

Figure 4 Quantitative analysis of caspase-3 expression in each group 各组大鼠视网膜caspase-3表达的定量分析图
2.4TUNEL法测定各组大鼠RGCL神经元的凋亡与正常组相比,NMDA组的大鼠RGCL神经元凋亡数量显著增多;与NMDA组相比,NMDA+NS-398(10 ng·mL-1、100 ng·mL-1)组RGCL神经元细胞凋亡数量显著降低,NMDA+NS-398(1 ng·mL-1)组神经元凋亡数量略有降低(图7)。NMDA组RGCL神经元凋亡率为正常组的(200±8)%,差异有显著统计学意义(P<0.001)。而给予NS-398(1 ng·mL-1、10 ng·mL-1和100 ng·mL-1)能够明显抑制NMDA引起的RGCL神经元凋亡,其低、中、高三种剂量组的RGCL细胞凋亡率分别为正常组的(142±20)%、(128±11)%、(149±15)% (图8)。
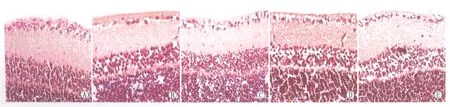
Figure 5 HE staining of rat RGCL of each group (40×). A: Control group; B: NMDA group; C: NMDA+1 ng·mL-1 NS-398 group; D: NMDA+10 ng·mL-1 NS-398 group; E: NMDA+100 ng·mL-1 NS-398 group 各组大鼠RGCL HE染色(×40)。A:对照组;B:NMDA组;C:NMDA+1 ng·mL-1 NS-398组;D:NMDA+10 ng·mL-1 NS-398组;E:NMDA+100 ng·mL-1 NS-398组
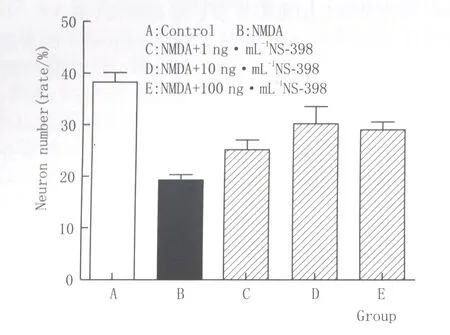
Figure 6 Neuron numbers of RGCL in each group 各组大鼠RGCL神经元计数
3 讨论
视神经是由RGC的轴突汇集组成,随着神经细胞的中毒、代谢障碍或血液循环障碍,可导致其轴突发生顺行性溃变,RGC胞体的死亡必然造成其轴突的溃变,RGC与轴突数目间存在对应关系[9]。通过对单位长度RGCL神经元计数的分析,可以判断NMDA所致损伤的严重程度及可能的通路[10]。光学显微镜下,HE染色后视网膜及视神经清晰可见3个核层,由内向外依次为RGC层、内核层(INL)及外核层(ONL)。NMDA诱发的大鼠视网膜损伤,主要体现为RGCL神经元数量减少[2]。RGCL层细胞一般为单层排列[11],NMDA造模后,与正常对照组相比,NMDA组RGCL密度减小,细胞出现了丢失、无核现象,但3个核层及2个丛状层仍然清晰可辩。

Figure 7 Apoptosis of rat RGCL of each group detected by TUNEL assay (×40). A: Control group; B: NMDA group; C: NMDA+1 ng·mL-1 NS-398 group; D: NMDA+10 ng·mL-1 NS-398 group; E: NMDA+100 ng·mL-1 NS-398 group TUNEL 法测定各组大鼠RGCL神经元的凋亡(×40)。A:对照组;B:NMDA组;C:NMDA+1 ng·mL-1 NS-398组;D:NMDA+10 ng·mL-1 NS-398组;E:NMDA+100 ng·mL-1 NS-398组

Figure 8 Apoptotic rate of RGCL cell in each group 各组大鼠RGCL神经元凋亡率
NS-398是COX-2的选择性抑制剂,同时其具有一定的抗氧化作用,提示COX-2可能通过催化生成氧自由基从而导致视网膜组织损伤[12]。氧自由基可与生物大分子,特别是细胞膜上的不饱和脂肪酸结合,形成脂质过氧化物,破坏生物膜[13]。COX-2是诱导酶,在机体受到内、外源性伤害性刺激后产生,其诱导产生的前列腺素(prostaglandins,PG)导致炎症介质的释放,诱发疼痛、炎症和免疫细胞激活等。在伤害性刺激传入引起痛及痛过敏时,COX-2表达上调;有资料显示,COX-2表达的上调可能与 NMDA 受体的激活密切相关[14-15]。因而测定COX-2的表达可间接反映NMDA受体的激活程度,在一定程度上可反映组织细胞损伤的程度。正常情况下,caspase-3以休眠状态的酶原形式存在于正常细胞中,凋亡信号启动后,caspase-9激活并切割caspase-3,使之转化为具有酶催化作用的活性形式。活化后的caspase-3可以切割蛋白质底物,包括细胞骨架蛋白,参与调节细胞骨架的蛋白,参与DNA修复的酶如PARP、DNA-PKCS以及抗凋亡蛋白bcl-2等,最终引起细胞死亡[16-17]。因而测定caspase-3的表达可间接反映RGCL神经元的凋亡情况。凋亡是细胞死亡的一种形式,发生凋亡的细胞其DNA迅速被核酸酶降解,产生若干大小不一的寡核苷酸碎片。这种死亡过程没有溶酶体及细胞膜破裂,细胞内含物不外泄,故不引起炎症反应及明显的组织学改变,在光学显微镜下很难进行鉴别,然而TUNEL技术的问世使这一问题得到了解决[18-19]。因此本研究运用TUNEL法进一步直接检测RGCL神经元的凋亡情况,并运用NuanceTM多光谱显微成像系统对caspase-3和TUNEL的结果进行定量分析。
本研究通过对COX-2和caspase-3的表达分析发现,给予NS-398有效地阻止了NMDA诱导的视网膜细胞组织的损伤。同时染色结果表明:NMDA诱导损伤后,大鼠RGCL神经元数目严重减少。同NMDA诱导视网膜损伤模型大鼠相比,给予COX-2
抑制剂NS-398能有效阻止NMDA诱导的大鼠RGCL神经元数目减少,其可能是通过抑制大鼠RGCL神经元凋亡途径完成的;同时其caspase-3的表达明显下调,表明大鼠RGCL神经元的凋亡与凋亡蛋白caspase-3有关。本研究中,COX-2抑制剂NS-398对NMDA诱导的视网膜损伤的改善与COX-2的表达相关,但也很可能发挥了多靶点的整体协同效应,其具体的机制尚不明确,有待后续进一步研究。
1 张雪菲,崔浩,单飞雪.NO在缺血性视网膜病变机制的研究[J].中国实用眼科杂志,2003,21(6):474-477.
2 刘敏,王俊贤,李玉桑,宋一倩,蓝丽萍,唐和斌.复方三芪提取物对NMDA致大鼠视网膜损伤的保护作用[J].中南民族大学学报,2011,30(1):54-58.
3 韩太真,李延海.NMDA受体的结构与药理学特性[J].心理科学进展,2008,16 (3):464-474.
4 温恩懿,赵聪敏.选择性COX-2抑制剂NS398干预后对HIBD新生大鼠海马CA1区存活椎体细胞计数的变化[J].中国医药指南,2008,6(12):19-22.
5 任永欣,沈映君,曾南.紫苏叶挥发油的抗炎机理研究—对花生四烯酸环氧酶代谢途径的影响[C].第六次全国中西医结合实验医学学术研讨会会议论文集,2002:185-190.
6 Yanni SE,McCollum GW,Penn JS.Genetic deletion of COX-2 diminishes VEGF production in mouse retinal Müller cells[J].ExpEyeRes,2010,91:34-41.
7 Takahashi H,Yanagi Y,Tamaki Y,Uchida S,Muranaka K.COX-2-selective inhibitor,etodolac,suppresses choroidal neovascularization in a mice model[J].BioBiophysicResCommuni,2004,325:461-466.
8 Janet C,Wayne R,Joseph T,Leigh Ann Claytonet,John C,Coenraad F,etal.Guide for the care and use of laboratory animals[M].8th ed.Washington(DC):National Academics Press,2011:1-220.
9 黄志坚.光动力疗法与光动力疗法联合玻璃体腔注射贝伐珠单抗治疗中心性渗出性脉络视网膜病变的比较研究[J].中国激光医学杂志,2011,20(2):77-81.
10 Shi JM,Jiang YQ,Liu XY.Neur oprotective effects of erigeron breviscapus(vent)hand—mazz on NMDA-induced retinal neuron injury in the rats [J].InterJOphthalmol,2005,5(5):859-863.
11 宋剑涛,杨薇,廖品正.糖尿病黄斑病变研究进展[J].中国中医眼科杂志,2004,14(1):55-58.
12 常丽.新生大鼠缺氧缺血脑损伤ICEmRNA,COX-2蛋白的表达变化及COX-2抑制剂NS398的抗氧化作用[D].天津:天津医科大学,2003.
13 汪云春,付铁娟,赵智宇,夏阳,林淑香.亚低温对大鼠局灶性脑缺血氧自由基和一氧化氮的影响[J].中国老年学杂志,2007,5(27):991-993.
14 Li SQ,Xing YL,Chen WN,Yue SL,Li L,Li WB,etal.Activation of NMDA receptor is associated with Up-regulation of COX-2 expression in the spinal dorsal horn during nociceptive inputs in rats [J].NeurochemRes,2009,34(8):1451-1463.
15 邢艳丽.NMDA受体阻断剂MK-801抑制大鼠甲醛炎性痛及痛过敏时脊髓后角COX-2蛋白及mRNA的表达 [D].河北:河北医科大学,2008.
16 王宇卉,邵福源,夏春林,卞杰勇.大鼠大脑中动脉缺血/再灌注模型中caspase-3的表达[J].临床神经病学杂志,2003,16(4):214-217.
17 Budihardjo I,OIiver H,Lutter M,Xu Luo,Wang XD.BiochemicaI pathways of caspase activation during apoptosis[J].AnnuRevCellDevBioi,1999,15(4):269.
18 Harrison DC,Davis RP,Bond BC,Campbell CA,James MF,Parsons AA,etal.Caspase mRNA expression in a rat model of focal cerebral ischemia[J].MolBrainRes,2001,89(6):133.
19 李爱军,房军,朱秀安,宫玉波,周瑾,彭小娟.白细胞介素-1受体拮抗剂对遗传性视网膜变性视细胞凋亡的影响[J].中华实验眼科杂志,2013,31(1):23-27.
date:Sep 2,2013
National Natural Science Foundation of China (No:81202942); Research Fund of South-central University for Nationalities (No:XTZ10001,GCX12073)From theCollegeofPharmacy,South-centralUniversityforNationalities,Wuhan430074,HubeiProvince,China
Neuroprotective mechanism of cyclooxygenase-2 inhibitor on rat retinal ganglion cell layer neurons damage induced by N-methyl-D-aspartate
XU Lu,TIAN Han,LI Yu-Sang,YAO Guang-Qiang,TANG He-Bin,FENG Li-Jing,LIU Min
retina; n-methyl-D-aspartate; COX-2 inhibitor; apoptosis; neuroprotection
Objective To investigate the protection mechanisms of COX-2 inhibitor (NS398)on the rat retinal damage induced by n-methyl-D-aspartate (NMDA).Methods Twenty-five Sprague-Dawley rats were divided into five groups: control group, NMDA group and NMDA+NS-398 with different concentrations (1 ng·mL-1, 10 ng·mL-1, 100 ng·mL-1)group. Rats in the NMDA group were given 5 μL NMDA (40 nmol·L-1). Rats in NMDA+NS-398 with different concentration groups were given with an intravitreal injection (5 μL)of NMDA (40 nmol·L-1)and NS-398(1 ng·mL-1, 10 ng·mL-1, 100 ng·mL-1). Seven days after NMDA treatment, the eye tissues were taken from those rats. The neuron numbers of retinal ganglion cell layer (RGCL)were counted, the apoptosis of RGCL cell was determined by TUNEL assay, and the expressions of caspase-3 and COX-2 in the rats’ retinas were measured by immunohistochemical staining.Results Neuron numbers in RGCL of NMDA group+ low-, middle-, high- concentration NS-398 groups were greater (63%±5%, 82%±7%, 73%±3%of control, respectively)than that in NMDA group (47%±3% of control). The protein expressions of caspase-3 in the NMDA+ low-, middle-, high-concentration NS-398 groups were significantly lower (223%±14%, 197%±18%, 261%±16% of control, respectively)as compared with those in NMDA group (327%±21% of control). Also the expressions of COX-2 in the NMDA+low-, middle-, high-concentration NS-398 groups were significantly lower (280%±20%, 233%±16%, 255%±19%of control, respectively)as compared with NMDA group (315%±11% of control).Conclusion Inhibition of COX-2 can inhibit the NMDA-induced apoptosis of RGCL cells in the rats’ retina, which may have a protective effect on the retina.
徐露,女,1990年6月出生,湖北武汉人,硕士。联系电话:13476851513;E-mail:hbtang2006@mail.scuec.edu.cn
AboutXULu:Female,born in June,1990.Master degree.Tel:13476851513; E-mail:hbtang2006 @mail.scuec.edu.cn
2013-09-02
国家自然科学基金资助(编号:81202942);中南民族大学科研基金资助(编号:XTZ10001,GCX12073)
430074 湖北省武汉市,中南民族大学药学院
刘敏,E-mail:liumin831016 @tom.com
徐露,田晗,李玉桑,姚光强,唐和斌,奉黎静,等.COX-2抑制剂对NMDA损伤视网膜神经节细胞层神经元的保护机制研究[J].眼科新进展,2014,34(4):301-305.
��
10.13389/j.cnki.rao.2014.0082
修回日期:2013-12-12
本文编辑:周志新
Accepteddate:Dec 12,2013
Responsibleauthor:LIU Min,E-mail:liumin831016@tom.com
[RecAdvOphthalmol,2014,34(4):301-305]