PDR患者血浆、眼内组织纤溶酶原激活物及其抑制剂与VEGF的表达及相关性△
武淑玲 杨默迟 袁进萍
PDR患者血浆、眼内组织纤溶酶原激活物及其抑制剂与VEGF的表达及相关性△
武淑玲 杨默迟 袁进萍
糖尿病视网膜病变;血管内皮生长因子;组织纤溶酶原激活物;纤溶酶原激活物抑制剂
目的探讨增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)患者血浆、房水、玻璃体中血管内皮生长因子(vascular endothelial growth factor,VEGF)与组织纤溶酶原激活物(tissue type plasminogen activator,t-PA)及t-PA抑制剂(plasminogen activator inhibitor,PAI)的表达,并评价VEGF表达与t-PA、PAI的相关性。方法采用双抗体夹心酶联免疫吸附试验(ELISA)法定量检测来自宁夏医科大学总医院眼科的PDR组及对照组患者血浆、房水、玻璃体中VEGF、t-PA、PAI的含量。结果PDR组血浆中VEGF(63.12±16.25)pg·mL-1、PAI(10.27±7.62)ng·mL-1的表达均高于对照组(14.39±10.48)pg·mL-1、(0.28±0.11)ng·mL-1,差异均有统计学意义(均为P<0.051;PDR组血浆中t-PA(19.91±9.90)ng·mL-1与对照组(12.00±2.61)ng·mL-1比较差异无统计学意义(P>0.01)。PDR组房水中VEGF(291.21±45.04)pg·mL-1、t-PA(5.38±2.40)ng·mL-1、PAI(0.53±0.31)ng·mL-1均高于对照组(30.60±11.70)pg·mL-1、(3.87±1.32)ng·mL-1、(0.16±0.09)ng·mL-1,差异均有统计学意义(均为P<0.05);PDR组玻璃体中VEGF(527.62±79.00)pg·mL-1、t-PA(10.41±6.33)ng·mL-1、PAI(7.72±2.32)ng·mL-1的表达浓度均高于对照组(37.58±8.31)pg·mL-1、(3.68±2.48)ng·mL-1、(0.27±0.13)ng·mL-1,差异均有统计学意义(均匀P<0.05)。PDR组自身血浆、房水、玻璃体三者比较,VEGF表达:玻璃体>房水>血浆;t-PA表达:血浆>玻璃体>房水;PAI表达:血浆、玻璃体均高于房水,但血浆和玻璃体比较差异无统计学意义(P>0.05)。PDR组血浆、房水、玻璃体中VEGF 的表达与t-PA及PAI的表达均存在显著相关性(均为P<0.05)。结论VEGF、t-PA、PAI可能参与了PDR视网膜新生血管的发生过程;VEGF与t-PA、PAI在PDR 的发展中可能具有相互促进的作用。
[眼科新进展,2014,34(7):647-651]
增殖性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)是糖尿病晚期最为常见和严重的微血管并发症之一,其病理特征是新生血管及纤维组织增生,在引起视网膜新生血管的众多因素中,血管内皮生长因子(vascular endothelial growth factor,VEGF)是目前被认为与PDR关系最密切的一个因子[1-2],在血管增生的过程中,除VEGF外亦有许多生物活性物质参与,如组织纤溶酶原激活物(tissue-type plasminogen activator,t-PA)和纤溶酶原激活物的抑制剂(plasminogen activator inhibitor,PAI)也通过降解血管内皮细胞基质等机制诱导新生血管生成[3]。同时,糖尿病视网膜病变(diabetic retinopathy,DR)患者纤溶功能低下,t-PA及PAI是纤溶系统活性的重要调节成分,它们之间的动态失衡可加重视网膜的缺血缺氧,从而加速DR的发展[4]。本研究检测PDR患者血浆、房水、玻璃体中 VEGF、t-PA、PAI浓度的变化,分析并探讨t-PA、PAI与VEGF之间是否存在相关性及其在PDR发病机制中的作用。
1 资料与方法
1.1资料与分组PDR组:随机选择2012年6月至2013年4月就诊于宁夏医科大学附属总医院眼科符合PDR组纳入标准的患者40例(40眼),其中男18例,女22例,年龄38~89(61±12)岁,糖尿病病程3~28 a,共收集血浆标本40例,房水标本20眼(右眼11例,左眼9例),玻璃体标本20眼(右眼11例,左眼9例),血浆、房水、玻璃体标本均来自同一个PDR患者的共20例。PDR组患者纳入标准:(1)根据1999年WHO诊断标准确诊为2型糖尿病者;(2)对所有诊断为2型糖尿病的患者进行充分散瞳后详细检查眼底并做眼底荧光血管造影检查;(3)按照2002年国际眼科学术会议制定的DR临床分级标准由同一眼科医师作出PDR的诊断。排除标准:(1)伴有糖尿病肾病、糖尿病酮症酸中毒、糖尿病高渗昏迷等糖尿病急性并发症;(2)合并其他内分泌代谢疾病和肿瘤疾病者;(3)有影响血浆t-PA、PAI活性的血液性疾病;(4)行眼内手术、视网膜激光光凝术者,青光眼,虹膜红变,严重玻璃体积血,玻璃体切割术后;(5)眼内注射过抗VEGF制剂。对照组:血浆及房水标本选择同期于宁夏医科大学附属总医院眼科就诊的除老年性白内障外无全身其他疾病的患者共40例(40眼),男18例,女22例,年龄46~85(61±13)岁,收集到血浆标本40例,房水标本19眼(右眼10眼,左眼9眼),玻璃体标本取自40例患者中需行手术治疗的孔源性视网膜脱离患者,均除外全身及眼部其他疾病,共10例(右眼6例,左眼4例),男6例,女4例,年龄19~72(57±16)岁。PDR组及对照组所有患者均知情同意,两组入选对象的年龄、性别及眼别分布差异均无统计学意义(均为P>0.05)。
1.2方法
1.2.1取材(1)血浆标本:抽取晨空腹静脉血4 mL,乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)抗凝,3000 r·min-1离心10 min,提取血浆分装移入已消毒Eppendorf管中,-80 ℃密封保存待测。(2)房水标本:术中作眼球切口前用1.0 mL注射器直接抽取前房房水0.15~0.20 mL,移入已消毒Eppendorf管中,-80 ℃密封保存待测。(3)玻璃体标本:行玻璃体切割手术时,以玻璃体切割头进入眼内至玻璃体中央,于切割器开口处用无菌1 mL注射器吸引玻璃体0.5~0.8 mL,分装移入已消毒Eppendorf 管中,-80 ℃密封保存待测。
1.2.2VEGF、t-PA、PAI测定采用ELISA法定量检测,从冰箱中取出标本,置于室温下10 min后待测。人VEGF酶联免疫试剂盒购自北京欣博盛公司,其灵敏度为8 pg·mL-1,根据试剂盒操作说明书进行操作。37 ℃温箱孵育90 min,再用稀释好的洗涤液清洗5次,充分甩干;在各孔中加入生物素化抗体工作液100 μL,用封板胶纸封住反应孔,37 ℃温箱孵育60 min;清洗5次后每孔再加入酶结合物工作液100 μL,用封板胶纸封住反应孔,37 ℃孵箱孵育30 min;然后清洗5次,在每孔中加入显色剂100 μL,37 ℃避光孵育10~15 min后在每孔中加入终止液100 μL,混匀,酶标仪450 nm处读数,在5 min内测定各孔吸光度(OD)值,根据定比稀释标准品的OD值绘制标准曲线,根据样品OD值和标准曲线,计算VEGF含量。人t-PA及PAI酶联免疫试剂盒购自武汉优尔生公司,其灵敏度分别为0.2 ng·mL-1和4.9 ng·mL-1,t-PA及PAI的检测步骤与VEGF相同。实验操作均严格按其说明书操作程序进行测定,且每份标本均设置复孔。
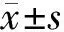
2 结果
2.1两组血浆、房水、玻璃体中VEGF、t-PA和PAI的表达PDR组血浆中VEGF、PAI的表达均高于对照组,差异均有统计学意义(均为P<0.05,见表1),PDR组血浆中t-PA的表达与对照组比较差异无统计学意义(P>0.05,见表1)。PDR组房水、玻璃体中VEGF、t-PA、PAI的表达均高于对照组,差异均有统计学意义(均为P<0.05)。

表1 两组血浆、房水、玻璃体中VEGF、t-PA 和PAI的表达Table 1 Expression of VEGF,t-PA and PAI in plasma,aqueous humor and vitreous of two groups(±s)
PDR组自身血浆、房水、玻璃体三者比较:VEGF表达:玻璃体>房水>血浆(均为P<0.05);t-PA表达:血浆>玻璃体>房水(均为P<0.05);血浆及玻璃体中PAI表达均高于房水(均为P<0.05),但血浆和玻璃体比较差异无统计学意义(P>0.05)。对照组血浆、房水、玻璃体中VEGF、t-PA、PAI表达差异均无统计学意义(均为P>0.05)。
2.2PDR组血浆、房水、玻璃体中VEGF表达与t-PA及PAI表达的相关性PDR组血浆中VEGF与t-PA的表达显著相关(r=0.659,P<0.01,见图1);VEGF与PAI的表达显著相关(r=0.705,P<0.01,见图2)。PDR组房水中VEGF与t-PA的表达显著相关(r=0.527,P<0.05,见图3);VEGF与PAI的表达显著相关(r=0.648,P<0.01,见图4)。PDR组玻璃体中VEGF与t-PA的表达显著相关(r=0.798,P<0.01,见图5);VEGF与PAI的表达显著相关(r=0.694,P<0.01,见图6)。对照组血浆、房水、玻璃体中VEGF表达与t-PA及PAI的表达均无明显相关性(均为P>0.05)。
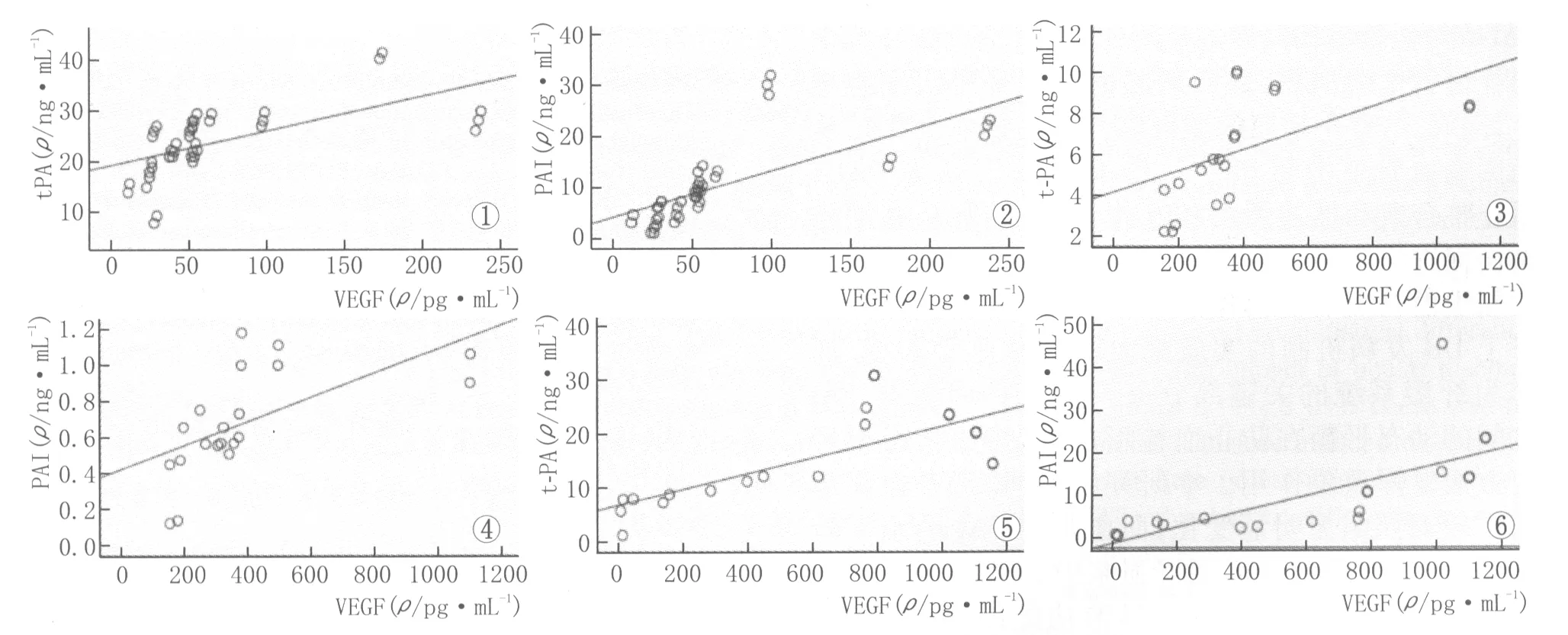
Figure 1 Correlation of VEGF and t-PA in plasma of PDR.Figure 2 Correlation of VEGF and PAI in plasma of PDR.Figure 3 Correlation of VEGF and t-PA in aqueous humor of PDR.Figure 4 Correlation of VEGF and PAI in aqueous humor of PDR.Figure 5 Correlation of VEGF and t-PA in vitreous of PDR.Figure 6 Correlation of VEGF and PAI in vitreous of PDR 图1 PDR组血浆中VEGF与t-PA表达的相关性。图2 PDR组血浆中VEGF与PAI表达的相关性。图3 PDR组房水中VEGF与t-PA表达的相关性。图4 PDR组房水中VEGF与PAI表达的相关性。图5 PDR组玻璃体中VEGF与t-PA表达的相关性。图6 PDR组玻璃体中VEGF与PAI表达的相关性
3 讨论
PDR是糖尿病患者最常见的致盲眼病,其基本病理过程是视网膜微血管病变。新生血管形成是PDR的主要标志,在引起视网膜新生血管的众多因素中,VEGF是目前所知最强的内皮细胞选择性促有丝分裂因子和血管生成因子,由于视网膜血管内皮存在VEGF高亲和力受体,其可以通过直接或间接诱导VEGF及其受体的表达来发挥刺激血管生成的作用[5-6],并且通过增加血管的通透性[7]、促进内皮细胞增殖[8]、增加内皮细胞对葡萄糖的转运[9]、改变细胞外基质[10]、上调细胞间黏附分子-1[11]的基因表达等途径破坏血-视网膜屏障,使视网膜血管通透性增高、视网膜水肿,加重视网膜局部缺血、缺氧,促使新生血管形成。本研究中,PDR患者血浆、房水、玻璃体中VEGF显著高于对照组,且PDR患者自身血浆、房水、玻璃体中VEGF水平呈明显增高趋势,这与国外研究结果一致[12-13]。VEGF是PDR发展过程中一个强有力的刺激因子,而且其发挥刺激新生血管生长的作用主要在眼局部,PDR患者玻璃体中高水平的VEGF并非来自于血浆,而是主要来自缺血缺氧的视网膜,由于缺氧刺激视网膜色素上皮细胞等分泌大量的VEGF,并释放到玻璃体中,通过玻璃体的支架作用使新生血管逐渐长入玻璃体,引起玻璃体反复出血、牵拉性视网膜脱离等一系列并发症发生,玻璃体中VEGF继续向前扩散,引起房水中VEGF含量增加。血浆中VEGF升高可能是由于在糖尿病长期高血糖及代谢紊乱状态下,导致广泛组织缺氧,刺激VEGF分泌增多,这提示我们检测血浆VEGF含量并不能真正反映玻璃体中VEGF的含量变化,因此,不能作为监测眼内新生血管生长的指标。
然而,视网膜新生血管的发生是一个十分复杂的病理过程,血管内皮细胞需首先借助于某些酶的激活,并通过这些酶类降解其基底膜后才能发生有丝分裂并游走,而细胞基质的降解是血管内皮细胞增生和游走的一个重要前提条件[14]。有学者对肿瘤血管组织的研究结果显示,t-PA在血管内皮细胞基质的降解过程中发挥了主要的作用[15-17]。本研究结果显示,PDR患者血浆中t-PA与对照组无明显差异,但房水、玻璃体中t-PA高于对照组,这表明t-PA参与了PDR的发生发展。PAI也主要是由血管内皮细胞合成和分泌,本研究中PAI在PDR患者血浆、房水、玻璃体中亦有明显表达,这表明PAI与PDR的发生发展也存在着必然的联系,也有研究发现PAI-1对血管重构同样起重要作用,它可导致纤维蛋白在血管壁内沉积,从而刺激血管壁平滑肌细胞增生,同时,这些平滑肌细胞可以合成大量的PAI-1,从而影响血管壁的重塑[18]。Czekay等[19]认为PAI-1阻止整合素和玻连蛋白相互作用,使细胞从基层松解而促进细胞迁移。因此,可设想PAI-1有诱导肿瘤新生血管生成的作用[3]。除此之外,在微循环水平上DR发病机制的实质是血栓性微血管病变,而作为纤溶系统的关键部分——血浆中t-PA与PAI之间的动态平衡在防止血栓形成、维持正常微循环等方面发挥重要作用。本研究中,PDR患者血浆中t-PA较对照组无明显变化,而血浆中PAI的水平较对照组升高,表明PDR患者血浆中t-PA和PAI合成和分泌失衡,破坏了正常的纤溶功能,一方面使血-视网膜屏障破坏;另一方面降低排除血管内纤维蛋白的功能,使大片毛细血管闭塞和无灌注,导致继发性血栓形成,加重血管内皮损伤,从而促进DR的发展[4]。本研究结果显示,t-PA及PAI在PDR患者自身血浆、房水、玻璃体的比较中,均为血浆中最高,由此我们可以猜测,t-PA和PAI参与PDR发展更多的是体现在对PDR患者血液纤溶功能的影响上。
本研究中,PDR组血浆、房水、玻璃体中VEGF与t-PA、PAI的表达均存在显著的相关性,我们可以推测在PDR患者视网膜新生血管的发生过程中不仅有VEGF,同时还有多种生物活性物质的参与。首先,这可能与VEGF是一个多功能的细胞因子有关,它在使血管内皮细胞分裂、游走、视网膜毛细血管通透性增加、血管内纤维蛋白成分外渗的同时,也刺激了血管内皮细胞对t-PA和PAI分泌的增加,t-PA承担了降解细胞外基质和血管内皮细胞基底膜的任务,PAI也发挥了促进血管平滑肌细胞增生、细胞迁移和血管重构的作用。其次,PDR患者存在血管内皮细胞损伤、凝血功能障碍、纤溶活性变化[20],导致血浆中t-PA与PAI的动态失衡,造成血管腔变窄、闭塞,使血流灌注不足,血管壁出现小的缺血区域,导致继发性血栓形成,从而引起视网膜缺血缺氧。Bainbridge等[21]报道,因视网膜耗氧量大,因此对缺氧特别敏感,而缺氧又是刺激VEGF mRNA表达的关键信号[22],使VEGF生成进一步增加,从而促进视网膜新生血管的生成,加速DR的发展,如此便形成了恶性循环。以上三者共同参与到血管增生的过程中,起到了加速视网膜新生血管形成的作用。至于三者之间确切的激活和作用机制尚有待进一步的研究证实。
本研究结果发现,t-PA、PAI在新生血管及PDR的病理过程中同样具有重要地位,且与VEGF之间存在交互作用,共同导致了PDR的发生,相信今后对VEGF、t-PA、PAI等生物因子研究的不断深入,可为DR的早期诊断和防治提供新思路和新途径。
1 Morarski CJ,Skinner SL,Stubbs AJ,Sarlos S,Kelly DJ,Cooper ME,etal.The rennill-angiotensin system influences ocular endothelial cell proliferation in diabetes:transgenic and interventional studies[J].AmJPathol,2003,162(1):151-160.
2 Ray D,Mishra M,Ralph S,Read L,Davies R,Brenchley P,etal.Association of the VEGF gene with proliferative diabetic retinopathy but not proteinuria in diabetes[J].Diabetes,2004,53(3):861-864.
3 Horrevoets AJ.Plasminogen activat or inhibitor1(PAI-1):invitroactivities and clinical relevance [J].BrJHaematol,2004,125(1):12-23.
4 王少波,施秉银,王养维,吴贵福.糖尿病视网膜病变时t-PA和PAI-1活性变化的临床意义[J].国际医药卫生导报,2006,12(8):46-47.
5 徐萍.糖尿病视网膜病变的相关因素分析[J].国际眼科杂志,2009,9(3):501.
6 Shams N,Ianchulev T.Role of vascular endothelial growth factor inocular angiogenesis[J].OphthalmolClinNorthAm,2006,19(3):335-344.
7 Banai S,Shweiki D,Pinson A,Chandra M,Lazarovici G,Keshet E.Upregulation of vascular endothelial growth factor expression induced by myocardial ischaemia:implications for coronary angiogenesis[J].CardiovascRes,1994,28(8):1176-1179.
8 卢海,张惠荣.生长因子诱导的血管内皮细胞增殖作用的研究[J].眼科研究,2001,19(4):297-300.
9 Sone H,Deo BK,Kumagai AK.Enhancement of glucose transport by vascular endothelial growth factor in retinalendothelial cells[J].InvestOphthalmolVisSci,2000,41(7):1876-1884.
10 Spirin KS,Saghizadeh M,Lewin SL,Zardi L,Kenney M,Cristina,etal.Basement membrane and growth factor gene expression in normal and diabetic human retinas[J].CurrEyeRes,1999,18(6):490-499.
11 Lu M,Perez VL,Ma N,Miyamoto K,Peng HB,Liao JK,etal.VEGF increases retinal vascular ICAM-l expressioninvivo[J].InvestOphthalmolVisSci,1999,40(8):1808-1812.
12 Izuta H,Matsunaga N,Shimazawa M,Sugiyama T,Lkeda T,Hara H.Proliferative diabetic retinopathy and relations among antioxidant activity,oxidative stress,and VEGF in the vitreous body[J].MolVis,2010,16(16):130-136.
13 Izuta H,Chikaraishi Y,Adachi T,Shimazawa M,Sugiyama T,Lkeda T,etal.Extracellular SOD and VEGF are increased in vitreous bodies from proliferative diabetic retinopathy patients[J].MolVis,2009,10(15):2663-2672.
14 Folkman J,Shing Y.Angiogenesis[J].JBiolChem,1992,267(16):10931-10934.
15 Dvorak HF,Brown LF,Detmar M,Dvorak AM.Vascular permeability factor/vascular endothelial growth factor,microvascular hyperpermeability,and angiogenesis[J].AmJPathol,1995,146(5):1029-1039.
16 Dvorak HF.Tumors:wounds that do not heal.Similarities between tumor stroma generation and wound healing[J].NEnglJMed,1986,315(26):1650-1659.
17 Li CR,Sun SG,Jiang DY,Hong W.The role of ginkgo biloba extract in treating diabetic retinopathy[J].IntJOphthalmol,2006,6(1):78-81.
18 Hagiwara H,Kaizu K,Uriu K,Noguchi T,Takagi L,Qie YL,etal.Expression of type-1 plasminogen activator inhibitor in the kidney of diabetic rat models[J].ThrombRes,2003,111(4-5):301-309.
19 Czekay RP,Aertgeerts K,Curriden SA,Loskutoff DJ.Plasminogen activator inhibitor-1 detaches cells from extracellular matrices by inactivating integrins[J].JCellBiol,2003,160(5):781-791.
20 宁静,郑剑波.糖尿病视网膜病变患者血浆脂联素与血管内皮细胞损伤、血小板活化的关系[J].中华实用诊断与治疗杂志,2009,23(8):762-764.
21 Bainbridge JW,Mistry A,Binley K,De Alwis M,Thrasher AJ,Naylor S,etal.Hypoxia-regulated transgene expression in experimental retinal and choroidal neovascularisation[J].GeneTher,2003,10(12):1049-1054.
22 Goodsell DS.The molecular perspective:VEGF and angiogenesis[J].Oncologist,2002,7(6):569-570.
date:Sep 22,2013
Correlation study of t-PA,PAI and VEGF expression in plasma and intraocular tissue in proliferative diabetic retinopathy
WU Shu-Ling,YANG Mo-Chi,YUAN Jin-Ping
diabetic retinopathy;vascular endothelial growth factor;tissue-type plasminogen activator;plasminogen activator inhibitor
ObjectiveTo evaluate the correlation between tissue-type plasminogen activator (t-PA),plasminogen activator inhibitor (PAI) and vascular endothelial growth factor (VEGF) expression in plasma aqueous humor and vitreous of proliferative diabetic retinopathy(PDR).MethodsThe concentrations of VEGF,t-PA and PAI in plasma,aqueous humor and vitreous body in PDR and normal group were detected by ELISA.ResultsThe levels of VEGF(63.12±16.25)pg·mL-1and PAI (10.27±7.62)ng·mL-1in the plasma of PDR patients were higher than control group (14.39±10.48)pg·mL-1and PAI (0.28±0.11)ng·mL-1,and there were significant statistically differences (allP<0.01).The levels of t-PA in plasma of PDR patients (19.91±9.90)ng·mL-1and control group (12.00±2.61)ng·mL-1was no statistically different (P>0.05).The levels of VEGF (291.21±45.04)pg·mL-1,t-PA (5.38±2.40)ng·mL-1and PAI (0.53±0.31)ng·mL-1in the aqueous humor of PDR patients were higher than control group (30.60±11.70)pg·mL-1,(3.87±1.32)ng·mL-1and (0.16±0.09)ng·mL-1,and there were statistical differences (allP<0.05).The levels of VEGF(527.62±79.00)pg·mL-1,t-PA (10.41±6.33)ng·mL-1and PAI (7.72±2.32)ng·mL-1in the vitreous of PDR patients were higher than control group (37.58±8.31)pg·mL-1,(3.68±2.48)ng·mL-1and (0.27±0.13)ng·mL-1,and there were statistical differences (allP<0.05).Compared among plasma,aqueous humor and vitreous of PDR patients,the levels of VEGF in vitreous was more than that in aqueous humor,and aqueous humor was more than plasma;The levels of t-PA in plasma was more than that in vitreous,and vitreous was more than aqueous humor;The levels of PAI in plasma and vitreous were more than that in aqueous humor,and there was no statistical difference between plasma and vitreous (P>0.05).The expression of VEGF was highly correlated with t-PA and PAI in plasma,aqueous humor and vitreous of PDR (allP<0.05).ConclusionVEGF,t-PA and PAI may be involved in the pathogenesis of angiogenesis in PDR,VEGF and t-PA PAI play interdependant roles in the development of PDR.
武淑玲,女,1966年1月出生,主任医师。联系电话:0951-6743251;E-mail:shulingwtt@sina.com
AboutWUShu-Ling:Female,born in January,1966.Tel:+86-951-6743251;E-mail:shulingwtt@sina.com
2013-09-22
宁夏自然科学基金资助(编号:NZ10129)
750004 宁夏回族自治区银川市,宁夏医科大学附属总医院眼科
Accepteddate:Dec 26,2013Foundationitem:Supported by Natural Science Foundation of Ningxia(No:NZ10129)From theDepartmentofOphthalmology,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan750004,NingxiaHuiAutunomousRegion,China
武淑玲,杨默迟,袁进萍.PDR患者血浆、眼内组织纤溶酶原激活物及其抑制剂与VEGF的表达及相关性[J].眼科新进展,2014,34(7):647⁃651.
10.13389/j.cnki.rao.2014.0177
【应用研究】
修回日期:2013-12-26
本文编辑:付中静
[RecAdvOphthalmol,2014,34(7):647-651]

