糖基化终末产物对体外培养牛眼小梁细胞氧化应激及凋亡的影响
张敏 王强 王康
糖基化终末产物对体外培养牛眼小梁细胞氧化应激及凋亡的影响
张敏 王强 王康
小梁细胞;糖基化终末产物;活性氧;原发性开角型青光眼;细胞凋亡
目的通过观察糖基化终末产物(advanced glycation end products,AGE)对体外培养牛眼小梁细胞凋亡的影响,研究AGE与原发性开角型青光眼(primary open angle glaucoma,POAG)之间的关系,进一步探讨其发病机制。方法体外培养牛眼小梁细胞,通过形态学观察和神经元特异性烯醇化酶染色对培养的细胞进行鉴定。将第3代小梁细胞接种于6孔培养板,在培养基中加入不同浓度(0 μg·mL-1、50 μg·mL-1、100 μg·mL-1、200 μg·mL-1)的AGE-BSA培养96 h。终浓度(200 μg·mL-1)的AGE-BSA培养液处理细胞不同时间(48 h、72 h、96h)。应用流式细胞仪检测小梁细胞凋亡率;活性氧荧光探针2’,7’-二氯荧光黄双乙酸盐检测细胞内活性氧(ROS)水平。结果50 μg·mL-1、100 μg·mL-1、200 μg·mL-1AGE-BSA作用96 h后细胞凋亡率分别为(5.60±0.25)%、(9.57±0.08)%、(17.68±0.21)%,与对照组(0 μg·mL-1AGE-BSA)细胞凋亡率(4.45±0.12)%相比均明显增高,且差异均有统计学意义(均为P<0.05);200 μg·mL-1AGE-BSA作用细胞48 h、72 h、96 h后凋亡率分别为(10.51±0.28)%、(13.47±0.42)%、(17.68±0.21)%,与对照组相比也均明显增高,差异均有统计学意义(均为P<0.05)。与对照组比较,AGE-BSA 处理后细胞内ROS 水平显著提高,差异有统计学意义(P<0.05),BSA 组差异无统计学意义(P>0.05)。结论在体外培养的条件下,AGE可能通过刺激牛眼小梁细胞产生大量ROS介导小梁细胞凋亡。
[眼科新进展,2014,34(7):640-642,646]
原发性开角型青光眼(primary open angle glaucoma,POAG)是一种常见致盲性眼病,大型流行病学研究显示糖尿病为POAG最常见的病因,与POAG发病率呈正相关[1]。糖尿病患者中POAG的发病率为4%~11%[2],比一般人群(2%)高。糖尿病与POAG间的关系密切,但糖尿病患者并发POAG的发病机制尚不明确。研究表明糖基化终末产物(advanced glycation end products,AGE)是糖尿病眼部并发症发生发展的重要影响因素[3-4]。本研究通过研究不同浓度AGE对体外培养牛眼小梁细胞凋亡的影响,进一步探讨糖尿病患者中青光眼发病率较正常人高的可能机制。
1 材料与方法
1.1材料
1.1.1眼球1岁左右公牛新鲜眼球8只,取自本地屠宰场,4 ℃冰桶运回实验室。
1.1.2主要试剂DMEM培养基、胎牛血清、Hepes及胰蛋白酶均购自Hyclone生物化学制品有限公司,兔抗人神经元特异性烯醇化酶(neuron specific enolase,NSE)单克隆抗体一抗、羊抗兔FITC-IgG二抗均购自博士德公司,AGE-牛血清白蛋白(bovine serum albumin,BSA)(10 mg·mL-1)购自Calbiochem公司,BSA购自Biovision公司,2’,7’-二氯荧光黄双乙酸盐(2’,7’ -dichlorofluorescein diacetate,DCFH-DA)购自Sigma公司,Annexin V-FITC细胞凋亡检测试剂盒购自南京凯基生物技术有限公司。
1.2方法
1.2.1牛眼小梁细胞培养及细胞鉴定采用本实验室既往方法[5-6],取新鲜牛眼球,常规消毒后,截取距角巩膜缘后5 mm的组织,剔除晶状体及其后组织,暴露虹膜。解剖显微镜下,小心去除虹膜组织,用显微镊轻轻撕取巩膜突和Schawlbe线中间的白色疏松小梁网组织,移入10 cm培养皿中,37 ℃培养箱静置0.5 h。组织块贴壁后,加入12 mL DMEM高糖培养基(含150 g·L-1胎牛血清,青霉素、链霉素各100×103U·L-1),于37 ℃、体积分数5%CO2、饱和湿度的恒温培养箱中培养。每4 d更换一次培养液,倒置显微镜下观察细胞生长和形态特征。用2.5 g·L-1胰蛋白酶含0.2 g·L-1EDTA消化传代。取传二代小梁细胞接种于预置盖玻片的培养皿中。待细胞接近融合期时,用0.01 mol·L-1PBS(pH=7.2)缓冲液冲洗,40 g·L-1多聚甲醛溶液固定,室温干燥。免疫荧光法行NSE染色(兔抗人NSE单克隆抗体一抗,羊抗兔FITC-IgG二抗),共聚焦显微镜下观察鉴定小梁细胞的组织来源。
1.2.2AnnexinV-FITC/PI双标流式细胞术检测细胞凋亡率将第3代小梁细胞以每孔100×103个的密度接种于6孔板。经无血清培养基培养24 h达细胞同步化后,将其分为6组,每组设6个复孔。任意取其中4组,培养基中加入不同浓度(0 μg·mL-1、50 μg·mL-1、100 μg·mL-1、200 μg·mL-1)的AGE-BSA培养细胞96 h,剩余2组培养基中加入200 μg·mL-1的AGE-BSA分别培养细胞48 h、72 h。不含EDTA的胰酶消化各组细胞后收集于流式管中,制成单细胞悬液。4 ℃下离心(2000 r·min-1,5 min)2次。500 μL缓冲液重悬细胞。加入Annexin V-FIT C、PI各5 μL,混匀后避光孵育15 min,1 h内流式细胞仪检测。
1.2.3细胞内活性氧检测采用活性氧(ROS)特异荧光探针DCFH-DA检测细胞内ROS的水平。将传3代小梁细胞以每孔100×103个的密度接种于6个孔板,细胞贴壁后将其分为4组,每组设6复孔。在培养基中加入不同浓度(0、50 μg·mL-1、100 μg·mL-1、200 μg·mL-1)的AGE-BSA培养细胞96 h后弃去细胞培养液,加入适量稀释好的10 μmol·L-1DCFH-DA溶液,37℃避光孵育20 min。用无血清培养基充分洗去未进入细胞内的DCFH-DA。2.5 g·L-1胰蛋白酶消化后制成单细胞悬液,收集于流式管中。30 min内流式细胞术检测各组DCF荧光强度。
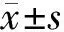
2 结果
2.1体外培养的小梁细胞形态观察、鉴定倒置显微镜下观察,原代培养5~10 d小梁细胞开始围绕组织块贴壁向外生长。细胞形态多样化,呈梭形、不规则多边形等,有突起和分支(图1A)。13 d左右组织块周围可形成单细胞层。取3代细胞进行免疫荧光鉴定,荧光倒置显微镜下观察细胞NSE染色阳性(图1B)证明小梁细胞为神经外胚层神经嵴间充质来源,确认所培养细胞为小梁细胞。
2.2流式细胞术检测AGE-BSA对小梁细胞凋亡的影响50 μg·mL-1、100 μg·mL-1、200 μg·mL-1AGE-BSA作用96 h后细胞凋亡率分别为(5.60±0.25)%、(9.57±0.08)%、(17.68±0.21)%,与对照组(0 μg·mL-1AGE-BSA)细胞凋亡率(4.45±0.12)%相比均明显增高,且差异均有统计学意义(均为P<0.05),提示AGE-BSA可诱导小梁细胞凋亡,且凋亡率在一定范围内呈浓度依赖性增加。200 μg·mL-1AGE-BSA作用细胞48 h、72 h、96 h后凋亡率分别为(10.51±0.28)%、(13.47±0.42)%、(17.68±0.21)%,与对照组相比也均明显增高,差异均有统计学意义(均为P<0.05),提示AGE-BSA诱导小梁细胞凋亡在一定范围内呈时间依赖性增加。BSA 对照组与正常对照组比较差异无统计学意义(P>0.05,见图2)。
Figure 1 Identification of cultured bovine trabecular meshwork cells.A:Primary cultured bovine trabecular meshwork cells for 8 days with rhomboid or polygonal appearence(×400);B:Positive staining of neuron-specific enolase under inverted fluorescent microscope(×400) 培养的牛眼小梁细胞的鉴定。A:原代培养8 d的小梁细胞呈梭形、多边形(×400);B:荧光倒置显微镜观察传代的细胞NSE染色阳性(×400)

Figure 2 Effects of different concentrations,treatment time and pre-treatment of AGE-BSA on apoptosis of cultured bovine trabecular meshwork cells.A:Normal control group;B:50 μg·mL-1 AGE-BSA group;C:100 μg·mL-1 AGE-BSA group;D:200 μg·mL-1 AGE-BSA for 48 hours group;E:200 μg·mL-1 AGE-BSA for 72 hours group;F:200 μg·mL-1 AGE-BSA for 96 hours group;G:BSA control group 不同浓度AGE-BSA作用不同时间和不同预处理对细胞凋亡率的影响。A:正常对照组;B:50 μg·mL-1 AGE-BSA 组;C:100 μg·mL-1 AGE-BSA 组;D:200 μg·mL-1 AGE-BSA 48 h组;E:200 μg·mL-1 AGE-BSA 72 h 组;F:200 μg·mL-1 AGE-BSA 96 h组;G:BSA 对照组
2.3流式细胞术检测AGE-BSA对小梁细胞内ROS水平的影响ROS特异荧光探针DCFH-DA本身没有荧光,但可以自由穿过细胞膜进入细胞内,被酯酶水解生成DCFH。无荧光的DCFH可以被ROS氧化生成有荧光的DCF,检测DCF 的荧光强度可反映细胞内ROS的水平。与对照组比较,AGE-BSA 处理后细胞内ROS 水平显著提高,差异有统计学意义(P<0.05),BSA 组差异无统计学意义(P>0.05,见图3)。
3 讨论
POAG是一种常见的致盲性眼病,眼压升高是其主要病理特征。房水排出通道的病理改变可以引起眼压升高。作为房水流出的主要通道小梁网在调节房水外流及控制眼压方面发挥重要作用。氧化应激可通过损伤小梁网而导致眼压升高[7-8]。
循环血中沉积在眼部的AGE以及眼组织中的长寿蛋白糖化形成的AGE与其受体相互作用,导致了糖尿病和年龄相关性眼病[3]。在培养的肾间质成纤维细胞中,AGE呈时间和剂量依赖性促进ROS 的产生,ROS被证实是AGE 致病的重要中间介导因子[9],其引起的氧化应激是细胞凋亡的一个重要触发因素[10]。本实验中发现,AGE-BSA可以明显提高小梁细胞内ROS水平,同时小梁细胞的凋亡率随AGE-BSA浓度的增大以及作用时间的延长而增加。我们推测AGE-BSA可能是通过诱导小梁细胞产生大量ROS引起氧化应激并通过某些途径导致小梁细胞凋亡。小梁网主要由小梁柱以及内衬的小梁细胞组成,小梁细胞具有吞噬、收缩、合成和分泌等功能,其数量的异常减少是POAG最重要的病理改变之一,与它的发病密切相关[11]。在小梁细胞,氧化应激还可以激活NF-κB通路,促进MMPs/TIMPs的表达,调节小梁细胞外基质(extracellular matrix,ECM)的重塑,持续的氧化应激可以引起小梁细胞功能失代偿,导致小梁网处ECM 沉积[12]。据此我们推测,AGE引起的持续氧化应激一方面可能通过诱导小梁细胞凋亡,使小梁细胞数目随AGE浓度的增高而减少,导致小梁网的正常功能难以维持,另一方面激活小梁
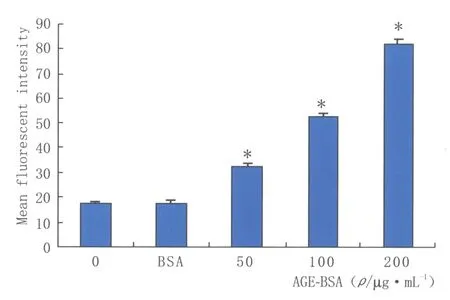
Figure 3 Effects of AGE-BSA on ROS level in trabecular meshwork cells AGE-BSA对细胞内ROS 水平的影响
网细胞NF-κB通路,破坏MMPs/TIMPs的表达平衡,进而促进小梁网处ECM沉积。这两方面最终导致房水流出受阻,引发POAG。本研究从一个侧面解释了糖尿病患者易并发POAG的机制并对指导糖尿病并发POAG患者的临床用药提供了一定理论依据。
1 Lin HY,Hsu WM,Chou P,Liu CJ,Chou JC,Tsai SY,etal.Intraocular pressure measured with a noncontact tonometer in an elderly Chinese population:the Shihpai Eye Study[J].ArchOphthalmol,2005,123(3):381-386.
2 李美玉.青光眼学[M].北京:人民卫生出版社,2004:501.
3 Yan SF,Ramasamy R,Schmidt AM.Receptor for AGE(RAGE) and its ligands-cast into leading roles in diabetes and the inflammatory response[J].JMolMed(Berl),2009,87(3):235-247.
4 Péterszegi G,Robert AM,Robert L,Renard G.The importance of the Maillard reaction in ophthalmology[J].JSocBiol,2007,201(2):209- 214.
5 张强,王强.肿瘤坏死因子α对体外培养牛眼小梁细胞纤维连接蛋白的影响[J].眼科新进展,2009,29(11):811-814.
6 王强,魏厚仁.体外培养人眼小梁细胞吞噬乳胶微粒的研究[J].中华眼科杂志,1999,35(5):389-390.
7 Zanon-Moreno V,Marco-Ventura P,Lleo-Perez A,Pons-Vazquez S,Garcia-Medina JJ,Vinuesa-Silva I,etal.Oxidative stress in primary open-angle glaucoma[J].JGlaucoma,2008,17(4):263-268.
8 Ferreira SM,Lerner SF,Brunzini R,Reides CG,Evelson PA,Llesuy SF.Time course changes of oxidative stress markers in a rat experimental glaucoma model[J].InvestOphthalmolVisSci,2010,51(9):4635-4640.
9 Yan HD,Li XZ,Xie JM,Li M.Effects of advanced glycation end products on renal fibrosis and oxidative stress in cultured NRK49F cells[J].ChinMedJ,2007,120(9):787-793.
10 Tu BP,Weissman JS.Oxidative protein folding in eukaryotes:mechanisms and consequences[J].JCellBiol,2004,164(3):341-346.
11 Alvarado J,Murphy C,Juster R.Trabecular meshwork cellularity in primary open angle glaucoma and nonglaucomatous normals[J].Ophthalmology,1984,91(6):564-579.
12 朱玉广,王杰,朱艳,钟莹莹,杜孝楠,张荣.氧化应激介导的NF-κB信号通路对猪小梁细胞MMPs/TIMPs表达的作用研究[J].山东大学学报(医学版),2012,50(5):51-54.
date:Jul 28,2013
Effects of advanced glycation end products on oxidative stress and apoptosis of bovine trabecular meshwork cells cultured in vitro
ZHANG Min,WANG Qiang,WANG Kang
trabecular meshwork cell;advanced glycation end products;reactive oxygen species;primary open angle glaucoma;apoptosis
ObjectiveTo investigate the effects of advanced glycation end products (AGE) on apoptosis of bovine trabecular meshwork cells (TM cells) culturedinvitro,and further explore the relationship between AGE and primary open angle glaucoma (POAG),probe its pathogenesis.MethodsThe bovine TM cells were culturedinvitroand identified by morphological evaluation and neuronspecific enolase staining.The third generation of cells were inoculated to 6-well plate,and different concentrations(0 μg·mL-1,50 μg·mL-1,100 μg·mL-1and 200 μg·mL-1)AGE-BSA was added into the medium for 96 hours,or treated with AGE-BSA (200 μg·mL-1) for different time (48 hours,72 hours and 96 hours).Flow cytometry was performed to detect the cells apoptosis,and the level of reactive oxygen species (ROS) was evaluated by 2’,7’-dichlorofluorescein diacetate (DCFH-DA) method.ResultsThe apoptotic rates after treating with different concentrations (50 μg·mL-1,100 μg·mL-1and 200 μg·mL-1) AGE-BSA for 96 hours were (5.60±0.25)%,(9.57±0.08)% and (17.68±0.21)%,respectively,which were obviously higher than the control group(4.45±0.12)% (allP<0.05).The apoptotic rates after treating with 200 μg·mL-1AGEs-BSA for 48 hours,72 hours and 96 hours were (10.51±0.28)%,(13.47±0.42)% and (17.68±0.21)%,respectively,which were also obviously higher than the control group (allP<0.05).Compared with control group,the ROS level in bovine TM cells after treating with AGE-BSA was increased (P<0.05),but there was no statistical difference after treating with BSA (P>0.05).ConclusionAGE can increase the ROS level in bovine TM cells culturedinvitroto mediate their apoptosis.
张敏,女,1986年9月出生,山东潍坊人,在读硕士研究生。研究方向:青光眼。联系电话:15684203717;E-mail:bzyxyzm2008@126.com
AboutZHANGMin:Female,born in September,1986.Postgraduate students.Tel:15684203717;E-mail:bzyxyzm2008@126.com
2013-07-28
264003 山东省烟台市,滨州医学院(张敏);256603 山东省滨州市,滨州医学院附属医院(王强,王康)
王强,E-mail:bywq001@126.com
张敏,王强,王康.糖基化终末产物对体外培养牛眼小梁细胞氧化应激及凋亡的影响[J].眼科新进展,2014,34(7):640⁃642,646.
10.13389/j.cnki.rao.2014.0175
【实验研究】
修回日期:2013-11-12
本文编辑:周志新
Accepteddate:Nov 12,2013
From theBinzhouMedicalUniversity(ZHANG Min),Yantai264003,ShandongProvince,China;AffiliatedHospitalofBinzhouMedicalUniversity(WANG Qiang,WANG Kang),Binzhou256603,ShandongProvince,China
Responsibleauthor:WANG Qiang,E-mail:bywq001@126.com
[RecAdvOphthalmol,2014,34(7):640-642,646]

