miR-29a抑制胃癌细胞内靶基因VEGF-A的表达及意义
王国威,王宗华,王仙园,范亚川,邹利全,李学成,陈 陵
miR-29a抑制胃癌细胞内靶基因VEGF-A的表达及意义
王国威,王宗华,王仙园,范亚川,邹利全,李学成,陈 陵
目的 验证胃癌细胞株SGC-7901内miR-29a对靶基因VEGF-A的直接调控作用。方法 采用负载miR-29a的腺病毒载体(Ad-miR29a)感染人胃癌细胞株SGC-7901,上调SGC-7901细胞内miR-29a的表达丰度后,采用RT-qPCR及Western blot法分别检测SGC-7901细胞内VEGF-A在mRNA及蛋白水平的表达;进一步采用双荧光素酶实验及突变实验,验证miR-29a是否通过结合在VEGF-A 3'UTR而直接抑制靶基因表达。结果 与感染阴性对照Ad-LacZ的SGC-7901细胞相比,感染Ad-miR29a的SGC-7901细胞内VEGF-A蛋白表达下降(0.42±0.02 vs.0.91±0.03,P<0.01),且VEGF-A mRNA水平亦下调(0.75±0.21 vs.1.15±0.25,P<0.05);荧光素酶实验显示,与阴性对照相比,转染miR-29a mimic后,HEK293细胞萤火虫荧光素酶活性明显下降(0.56±0.13 vs.0.93±0.06,P<0.05);而在VEGF-A 3'UTR与miR-29a的结合位点被突变之后,HEK293细胞萤火虫荧光素酶活性得以恢复。结论 miR-29a通过结合于VEGF-A 3'UTR相应位点,直接抑制VEGF-A在mRNA及蛋白水平的表达。miR-29a可能成为胃癌基因治疗的有效靶标。
微RNAs;血管内皮生长因子;miR-29a;胃癌
胃癌是一种最常见的恶性肿瘤,难以预测的复发性导致高死亡率。由于早期胃癌无明显症状,大多数患者就诊时已到中晚期,致使治疗效果不理想。因此,了解及掌握胃癌的发病机制,寻找新的诊断用生物标记,对于胃癌的早期发现、诊断及治疗至关重要。miRNAs作为一类内源性非编码的小RNAs,通过与靶基因特异性作用,从而参与调节肿瘤发生、发展与转移等关键环节而成为近年来的研究热点。其中miR-29a是新近发现可能与肿瘤密切相关的miRNA分子之一,其在众多实体肿瘤如神经胶质瘤、肝细胞癌、肉瘤、脑肿瘤等中均呈现低表达状态,通过抑制靶基因的表达而作为肿瘤抑制基因存在,在肿瘤发生、发展及侵袭转移中发挥着至关重要的作用[1-2]。本课题前期研究发现,miR-29a可抑制胃癌细胞株SGC-7901的增殖与侵袭能力[3-4];且胃癌组织内miR-29a与血管内皮细胞生长因子A(VEGF-A)呈负相关[5],因此推测miR-29a可能通过抑制VEGF-A从而抑制胃癌增殖与转移。本研究拟采用表达调控实验及双荧光素酶实验,验证miR-29a对其靶基因VEGF-A的直接调控作用。
1 材料与方法
1.1 材料 人胃腺癌细胞株SGC-7901、人胚肾细胞株HEK-293(中科院上海生科院细胞资源中心);标准胎牛血清、高糖DMEM培养液、RPMI 1640培养液(HyClone);RNAiso RNA抽提试剂、逆转录试剂盒及SYBR Premix Ex Taq试剂盒(TaKaRa);miR-29a mimic、阴性对照Scrambled RNA、miR-29a引物套装(广州锐博);Lipofectamin2000转染试剂(Invitrogen);VEGF-A mRNA的RT-qPCR引物由上海生工合成纯化,其上游序列[6]:5'-CCTTGCTGCTCTACCTCCAC-3';下游序列:5'- ATGATTCTGCCCTCCTCCTT-3',扩增片段长度74 bp;Western blot ECL检测试剂盒(上海碧云天);双荧光素酶试剂盒(Promega);小鼠抗人VEGF-A单克隆抗体(Santa Cruz);小鼠抗人GAPDH单克隆抗体(上海康成);负载有miR-29a表达序列的复制缺陷型腺病毒(Ad-miR29a),由本室包装保存[7];负载有β-半乳糖苷酶(β-gal)基因LacZ 的复制缺陷型腺病毒,由本室保存[8];负载VEGF-A 3'UTR的萤火虫荧光素酶报告质粒和突变质粒,由重庆金麦构建;7500实时荧光定量PCR仪(ABI);多功能酶标仪(Thermo)。
1.2 细胞培养 SGC-7901细胞培养于含有10%标准胎牛血清的RPMI 1640培养液中,置于37 ℃、5% CO2的培养箱中培养。HEK293细胞培养于含有10%标准胎牛血清的DMEM高糖培养液中,置于37 ℃、5% CO2的培养箱中培养。
1.3 腺病毒感染SGC-7901细胞 将腺病毒液以20∶1的感染复数(MOI)感染SGC-7901细胞,继续培养96 h后收集细胞,分别检测miR-29a、VEGF-A mRNA以及VEGF-A蛋白表达水平。以感染Ad-LacZ 的SGC-7901细胞作为阴性对照,未感染腺病毒的SGC-7901细胞作为空白对照。
1.4 RT-qPCR检测VEGF-A mRNA的表达 以U6管家基因为内参,按照RNAiso试剂说明书提取总RNA,并测定mRNA浓度;按照TaKaRa RT逆转录试剂盒说明书合成cDNA;以U6为内参,按照SYBR Premix Ex Taq试剂盒说明书进行RT-qPCR检测目的基因。20 μl体系配置如下:SYBR Green PCR Master Mix 10 μl,10 mol/L上下游引物各0.5 μl,cDNA 1 μl,ddH2O 8 μl,混匀;预变性95 ℃ 30 s,反应40个循环,条件为95 ℃ 5 s,60 ℃ 34 s,72 ℃延伸3 min。采用2-△△Ct法进行结果分析[9],比较各组RQ值(RQ=2-△△Ct)。
1.5 Western blot法检测VEGF-A的表达 各组细胞样本经SDS裂解液裂解后,提取总蛋白,经BCA法定量后,12%SDS-PAGE电泳后,转膜至碳酸纤维膜上,5%脱脂奶粉封闭2 h,经TBST洗涤液洗涤后,分别加入鼠抗人VEGF-A多克隆抗体(1∶1000稀释)或GAPDH单克隆抗体(1∶2000稀释),4 ℃孵育过夜,羊抗鼠二抗孵育1 h,化学发光试剂盒显色。采用Image J软件对条带的灰度值进行分析。
1.6 荧光素报告实验 细胞转染前24 h,将处于对数生长期的HEK293细胞接种于24孔板,继续培养至80%~90%融合度时进行转染。参照Lipofectamin2000说明书操作,共转染荧光素酶报告质粒(pMIR-Report-VEGF-A 3'UTR)和内参质粒pRL-TK,以及相应miRNA或Inhibitor。孵育48 h后,采用双荧光素酶试剂盒检测荧光素酶强度。
1.7 统计学方法 所有实验均重复3次,采用SPSS 17.0统计软件进行分析,计量资料采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 SGC-7901细胞内VEGF-A 蛋白表达 Western blot 结果显示,miR-29a过表达后的SGC-7901细胞内,VEGF-A表达显著低于Ad-LacZ腺病毒对照组(0.42±0.02 vs.0.91±0.03,P<0.01,图1)。
2.2 miR-29a对VEGF-A mRNA表达的影响 在感染Ad-miR29a后,SGC-7901细胞内VEGF-A mRNA表达受到明显下调(0.75±0.21 vs.1.15±0.25,P<0.05),而未感染的空白对照组及LacZ腺病毒对照组的组间差异并无统计学意义(图2)。
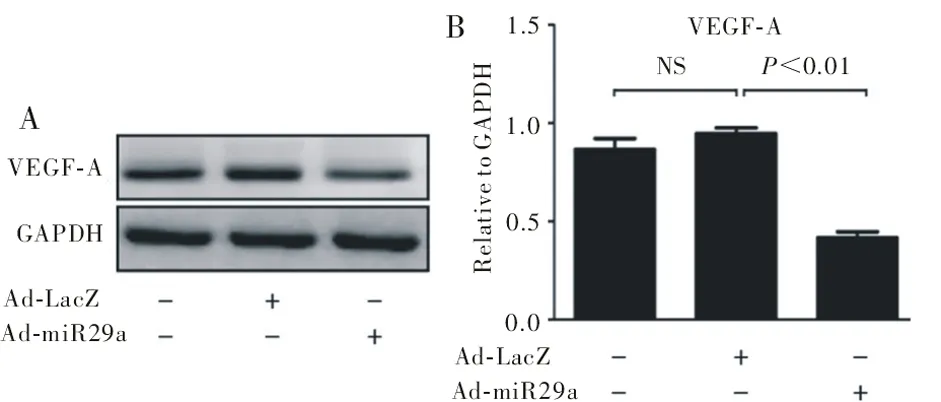
图1 Western blot检测SGC-7901细胞内VEGF-A表达情况
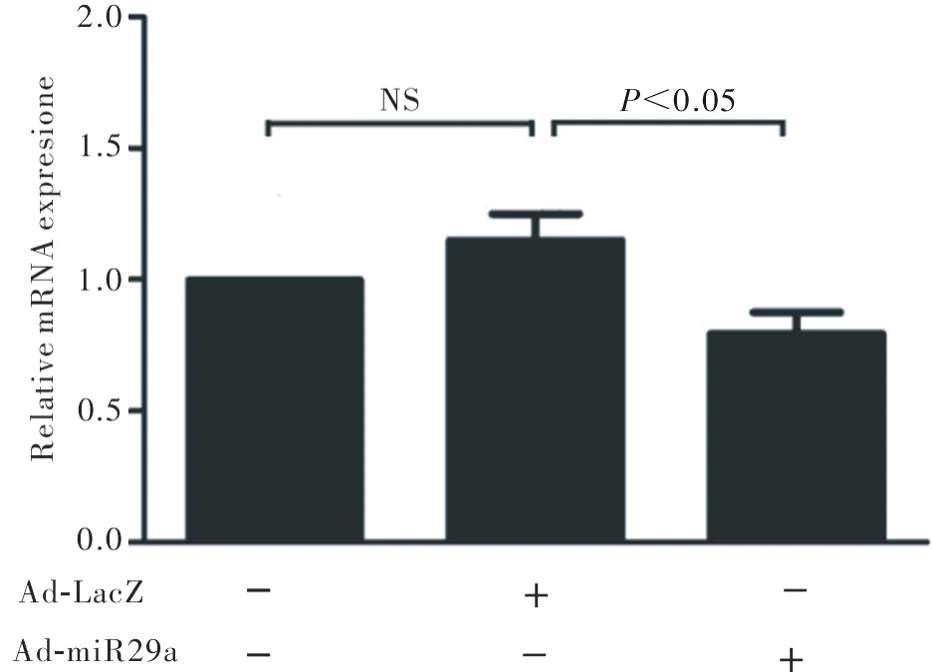
图2 RT-qPCR检测Ad-miR29a感染后VEGF-A mRNA的表达情况
2.3 双荧光素酶实验 与阴性对照相比,转染miR-29a mimic并共转染双荧光素酶质粒后,HEK293细胞内VEGF-A 3'UTR野生型荧光素酶活性显著下降(0.56±0.13 vs.0.93±0.06,P<0.05);而在VEGF-A 3'UTR相应结合位点突变之后(图3A),HEK293细胞内萤火虫荧光素酶活性恢复(图3B)。
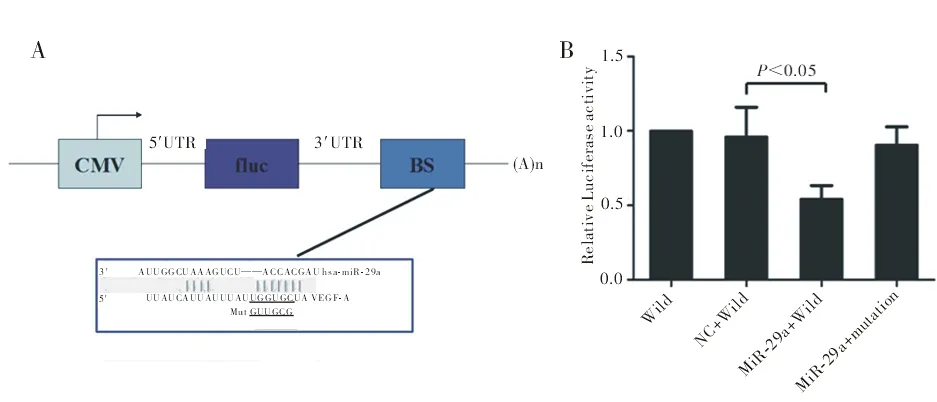
图3 双荧光素酶实验结果
A:miR-29a与VEGF-A 3'UTR结合位点及突变位点设计;B:各组HEK293细胞内相对荧光素酶活性检测
3 讨论
miRNAs发现10余年来,由于其广泛的基因调控及在众多生物学行为中发挥重要作用而备受关注。越来越多研究发现,miRNAs在肿瘤发生、发展过程中发挥着巨大的作用。已有研究显示,胃癌中存在许多miRNA分子表达异常,其生物学行为和一些miRNA分子有着密切关系。其中miR-29a被认为是一种肿瘤抑制性miRNA,通过调节多种靶基因(Mcl-1[10-11]、DNMT[12-13]、CDK6[1]及CCND2等[14])参与肿瘤的发生发展及凋亡过程。miRNA对靶基因的调控较为复杂,一条miRNA可能调控多个靶基因,而一个靶基因亦可能受到多条miRNA的调控。因此,miR-29a可能还可通过抑制其他靶基因而发挥抑癌作用。本课题前期研究发现,miR-29a在胃癌组织[15]及胃癌患者血清中低表达[16],临床病理分析进一步提示,miR-29在胃癌组织中高表达能抑制肿瘤淋巴结转移进而改善预后[15]。体外实验发现,miR-29a可抑制胃癌细胞株SGC-7901的增殖与侵袭能力[3-4];且胃癌组织中miR-29a表达水平与瘤内微血管密度(MVD)呈负相关[17]。瘤内MVD与VEGF-A密切相关。VEGF-A是血管生成过程中的关键因子,参与肿瘤血管生成和淋巴管形成,阻断VEGF-A信号途径可抑制肿瘤的生长和转移[7-8]。且前期结果还发现胃癌组织内miR-29a与VEGF-A呈负相关[5],因此miR-29a可能通过抑制VEGF-A从而抑制胃癌转移。进一步采用表达调控实验发现,以Ad-miR29a病毒载体上调人胃腺癌SGC-7901细胞株miR-29a表达水平后,细胞内VEGF-A表达水平无论在mRNA水平还是蛋白水平均显著下调。这表明miR-29a可抑制VEGF-A蛋白的表达水平。
为进一步明确miR-29a抑制VEGF-A表达的机制,本研究采用生物信息学技术(http://www.targetscan.org/)预测发现,VEGF-A 3'UTR存在与miR-29a稳定结合的位点,提示VEGF-A很可能是miR-29a的直接靶基因,miR-29a通过结合于VEGF-A 3'UTR相关位点,抑制VEGF-A的表达。因此,本研究进一步采用双荧光素酶实验及突变实验进行验证。结果发现,miR-29a可通过结合于VEGF-A 3'UTR相应位点,阻碍萤火虫荧光素酶表达,而突变该位点后,萤火虫荧光素酶表达得以恢复。这一结果表明,与此前其他研究者发现的miR-29a靶基因Mcl-1[10,18]、DNMT[12-13]、CDK6[1]及CCND2等[14]一样,VEGF-A亦是miR-29a发挥抑癌作用的一个关键靶基因。抑制VEGF-A表达是miR-29a抑制胃癌增殖与转移的重要机制之一。
[1] Zhao JJ,Lin J,Lwin T,et al.microRNA expression profile and identification of miR-29 as a prognostic marker and pathogenetic factor by targeting CDK6 in mantle cell lymphoma[J].Blood,2010,115(13):2630-2639.
[2] Wang XS,Gong JN,Yu J,et al.MicroRNA-29a and microRNA-142-3p are regulators of myeloid differentiation and acute myeloid leukemia[J].Blood,2012,119(21):4992-5004.
[3] 覃志伟,王宗华,邹利全,等.负载人miR-29慢病毒的包装鉴定及对人胃癌细胞株增殖的影响[J].中国肿瘤,2011,20(6):453-456.
[4] 刘志鹏,王宗华,卢斌,等.腺病毒介导miR-29a过表达抑制人胃癌细胞的增殖[J].中国肿瘤生物治疗杂志,2013,20(3):1-5.
[5] 李学成,卢斌,王宗华,等.胃癌组织内miR-29a与VEGF-A表达的相关性研究[J].肿瘤学杂志,2013,19(1):38-41.
[6] Ghosh R,Lipson KL,Sargent KE,et al.Transcriptional regulation of VEGF-A by the unfolded protein response pathway[J].PLOS ONE,2010,5(3):e9575.
[7] 高军,范亚川,王军,等.负载人miR-29a复制缺陷型腺病毒的包装及鉴定[J].西南国防医药,2011,21(10):1045-1048.
[8] Chen L,Tang XD,Yu ST,et al.Induction of anti-tumour immunity by dendritic cells transduced with hTERT recombinant adenovirus in mice[J].J Pathol,2009,217(5):685-692.
[9] Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[10] Mott JL,Kobayashi S,Bronk SF,et al.mir-29 regulates Mcl-1 protein expression and apoptosis[J].Oncogene,2007,26(42):6133-6140.
[11] Desjobert C,Renalier MH,Bergalet J,et al.MiR-29a down-regulation in ALK-positive anaplastic large cell lymphomas contributes to apoptosis blockade through MCL-1 overexpression[J].Blood,2011,117(24):6627-6637.
[12] Fabbri M,Garzon R,Cimmino A,et al.MicroRNA-29 family reverts aberrant methylation in lung cancer by targeting DNA methyltransferases 3A and 3B[J].Proc Natl Acad Sci U S A,2007,104(40):15805-15810.
[13] Braconi C,Kogure T,Valeri N,et al.microRNA-29 can regulate expression of the long non-coding RNA gene MEG3 in hepatocellular cancer[J].Oncogene,2011,30(47):4750-4756.
[14] Li L,Sarver AL,Alamgir S,et al.Downregulation of microRNAs miR-1,-206 and -29 stabilizes PAX3 and CCND2 expression in rhabdomyosarcoma[J].Lab Invest,2012,92(4):571-583.
[15] 陈陵,李学成,李向红,等.miR-29在胃癌中的表达及其临床意义[J].临床肿瘤学杂志,2011,16(4):315-317.
[16] 陈陵,陈先华,李学成,等.miR-29在胃癌患者血清中的表达及对预后的影响[J].分子诊断与治疗杂志,2011,3(2):17-20.
[17] 陈陵,李学成,王军,等.miR-29在胃癌中的表达及其与微血管密度的相关性[J].肿瘤学杂志,2011,17(4):241-244.
[18] Desjobert C,Renalier MH,Bergalet J,et al.MiR-29a downregulation in ALK-positive anaplastic large-cell lymphomas contributes to apoptosis blockade through MCL-1 overexpression[J].Blood,2011,117(24):6627-6637.
Suppression of target gene VEGF-A expression in gastric cancer cells by miR-29a and its significance
Wang Guowei1,Wang Zonghua2,Wang Xianyuan2,Fan Yachuan1,Zou Liquan1,Li Xucheng3,Chen Ling1
1.Department of Digestion,Hospital 324 of PLA,Chongqing,400020,China;2.Nursing School,the Third Military Medical University,Chongqing,400037,China;3.Emei Sanatorium of Chengdu Military Command,Emeishan City,Sichuan,614200,China
Objective To identify the direct control effect of miR-29a in gastric cancer cell strain SGC-7901 on target gene VEGF-A.Methods Adenovirus vector Ad-miR29a which was loaded with miR-29a was used to infect the human gastric cancer cell strain SGC-7901.After the up-regulation of the miR-29a expression abundance in SGC-7901 cell,RT-qPCR and Western blot assay were used to examine the expression of VEGF-A in SGC-7901 cells.Furthermore,dual luciferase experiment and mutation experiment were carried out to identify whether miR-29a inhibited directly the expression of target gene through the combination with VEGF-A 3'UTR.Results The protein expression level of VEGF-A decreased in the SGC-7901 cells infected with Ad-miR29a compared with the level in those with negative infection with Ad-LacZ(0.42±0.02 vs.0.91±0.03,P<0.01),and the mRNA level of VEGF-A also down-regulated(0.75±0.21 vs.1.15±0.25,P<0.05).The luciferase experiment indicated that compared with the negative control group,the activity of firefly luciferase in HEK293 cells decreased significantly after the transfection of miR-29a mimic(0.56±0.13 vs.0.93±0.06,P<0.05).After the binding site of VEGF-A 3'UTR and miR-29a was mutated,the activity of firefly luciferase in HEK293 cell was recovered.Conclusion Through the combination to the relative sites of VEGF-A 3'UTR,miR-29a can directly inhibit the expression of VEGF-A in mRNA and the protein level.MiR-29a may become an effective target in the gene therapy for gastric cancer.
microRNAs;vascular endothelial growth factor A;miR-29a;gastric cancer
重庆市自然科学基金资助项目(cstc2011jjA10111;cstc2011jjA10114)
400020 重庆,解放军324医院消化内科(王国威,范亚川,邹利全,陈 陵);第三军医大学护理学院(王宗华,王仙园);成都军区峨眉疗养院(李学成)
陈 陵,E-mail:lingcong_008@126.com
R 739
A
1004-0188(2014)01-0006-04
10.3969/j.issn.1004-0188.2014.01.003
2013-07-22)

