IRF-4结合蛋白对口腔鳞癌细胞生长作用的机制研究
IRF-4结合蛋白对口腔鳞癌细胞生长作用的机制研究
潘 磊,简从相,李 卓,黄晓山
目的 观察IRF-4结合蛋白(IBP)促进口腔鳞癌(OSCC)细胞Tca8113生长的机制。方法 利用实验室保存的口腔鳞癌细胞株Tca8113和先前建立的高表达IBP的口腔鳞癌细胞株Tca8113/IBP以及对照空质粒细胞株Tca8113/C1,通过流式细胞术,观察IBP过表达对Tca8113细胞周期的影响,并通过免疫印迹实验检测相关细胞周期蛋白的表达变化。结果 流式细胞术显示IBP能缩短OSCC细胞的G1期,促进其进入S期,从而加快OSCC的增殖;并且Tca8113/IBP组细胞cyclin D1的表达高于Tca8113及Tca8113/C1组;而cyclin E和 P27Kip1在各组细胞中的表达未见明显变化。结论 IBP可能通过调节cyclin D1的表达从而缩短OSCC细胞的G1期,促进其进入S期,并加速OSCC细胞的增殖。
IRF-4结合蛋白;口腔鳞癌;增殖;cyclin D1
口腔鳞状细胞癌(OSCC)位居人类十大恶性肿瘤第6位,是全世界常见肿瘤之一,约占全身恶性肿瘤的2%~3%,全世界每年有约50万新增病例,并呈逐年升高的趋势,严重危害人类的健康[1-2]。由于对OSCC的病因及发病机制不甚清楚,在过去的几十年中,OSCC患者的5年生存率仍无明显改善。因此,深入研究OSCC的分子机制,寻找新的OSCC的治疗靶标具有十分重要的意义。本课题前期的研究发现IRF-4结合蛋白(IBP)高表达于OSCC,其表达与OSCC的肿瘤大小、临床TNM分期、远处转移呈正相关,与OSCC的分化呈负相关[3]。并且通过MTT实验及克隆形成试验法证实,上调IBP表达能促进OSCC细胞增殖[4]。但IBP促进OSCC增殖的机制还不清楚,因此,本研究拟探寻其中的具体机制。
1 材料与方法
1.1 细胞株和主要试剂 Tca8113口腔鳞癌细胞株购自重庆医科大学;IBP过表达的口腔鳞癌细胞株 Tca8113/IBP及空质粒对照组细胞Tca8113/C1由本课题前期实验建立并保存[4]。胎牛血清,1640(高糖)培养基购自GIBCO/BRL公司;胰酶消化液购自碧云天;鼠抗人cyclin D1单克隆抗体购自Santa Cruz公司;兔抗人cyclin E 多克隆抗体购自Biosynthesis公司;兔抗人p27kip1多克隆抗体及鼠抗人β-actin单克隆抗体购自Biosynthesis公司;羊抗鼠IgG或羊抗兔二抗购自碧云天。
1.2 细胞培养 Tca8113、Tca8113/IBP、Tca8113/C1培养于含10%FBS的RPMI 1640培养液中。
1.3 流式细胞术检测各组细胞的周期分布 将培养5代后的Tca8113/IBP、Tca8113、Tca8113/C1细胞接种于6孔板中,接种密度为1×106/孔,37 ℃、5%CO2孵箱中培养24 h。用0.25%胰酶消化,采集细胞吹打制备成单细胞悬液,4 ℃、12 000 r/min离心5 min,弃上清。加入1 ml 4 ℃预冷的PBS重新悬浮细胞,4 ℃、12 000 r/min离心5 min,弃上清。加入300 μl预冷的PBS重新悬浮细胞,一边振荡一边逐滴加入1 ml 70%的预冷乙醇,4 ℃避光过夜。检测时加入终浓度为50 μg/ml的RNA酶,37 ℃反应1 h。然后再加入100 μg/ml碘化丙啶溶液,染色20~30 min后,在流式细胞仪(美国BD公司)上进行检测。增殖指数(PI)的计算参考文献[5],PI=(S+G2)/(S+G2+G1)。实验重复3次,实验结果取3次的均数。
1.4 Western blotting测蛋白cyclin D1、cyclin E和P27kip1的表达 将Tca8113/IBP、Tca8113、Tca8113/C1细胞接种于6孔板中,接种密度为1×106/孔,37 ℃、5%CO2孵箱中培养24 h。换无血清培养基培养24 h后,再加入完全培养基继续培养24 h。分别提取3组细胞蛋白,蛋白提取方法:细胞生长至对数期、铺满培养瓶底约70%~90%后,以冰冷的PBS洗涤细胞2次,以吸管及滤纸吸尽液体后置冰上保存,取RIPA(强)裂解液(碧云天),按照每1 ml裂解液中加入10 μl以异丙醇溶解的100 mM 的PMSF(碧云天),混匀后以300 μl/100 ml培养瓶的比例加入裂解细胞,轻轻晃动培养瓶使裂解液充分接触细胞,置冰上放置约15 min后,以细胞刮收集细胞至1.5 ml EP管,以1 ml一次性注射器反复吹打裂解液约20次,使DNA断裂,4 ℃ 14 000 r/min离心15 min后收集上清,取10 μl样品用于蛋白浓度测定(BCA法),其余蛋白加入适量上样缓冲液,于水浴中煮沸5 min后分装,置-80 ℃保存备用。将上述提取的蛋白加热煮沸变性,经SDS-PAGE电泳分离,转膜后分别与cyclin D1、cyclin E和P27kip1一抗(1∶200)结合,再与HRP标记的羊抗鼠IgG或羊抗兔二抗结合,显影。实验重复3次。
2 结果
2.1 IBP表达对口腔鳞癌细胞周期的影响 流式细胞术检测结果显示:36.40%的Tca8113/IBP细胞被阻滞在G1期,而52.00% 的Tca8113细胞和51.35%的Tca8113/C1细胞被阻滞在G1期,Tca8113/IBP被阻滞在G1期的细胞较Tca8113和Tca8113/C1少(P<0.05,图1)。提示IBP能缩短OSCC细胞的G1期,促进其进入S期,从而加快OSCC的增殖。通过计算各组增殖指数显示,Tca8113/IBP增殖指数为0.636,而Tca8113和Tca8113/C1的增殖指数分别为0.480和0.487,提示上调IBP表达能促进OSCC细胞的增殖能力。
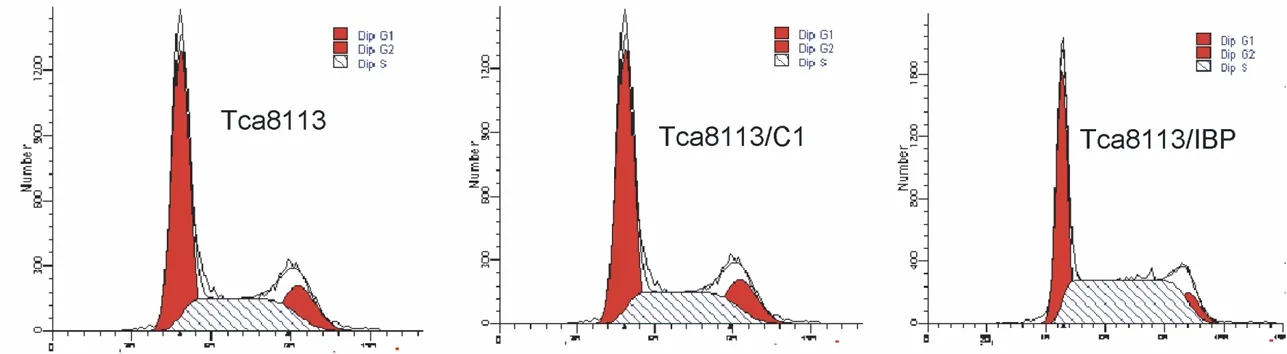
图1 IBP表达对口腔鳞癌细胞周期的影响
2.2 IBP表达对口腔鳞癌细胞周期相关蛋白表达的影响 为进一步探寻IBP缩短OSCC细胞周期G1期促进其进入S期的机制,本研究检测了部分在细胞周期中调控细胞从G1期到S期中起关键作用的蛋白,其中包括cyclin D1、cyclin E和P27Kip1。结果显示:Tca8113/IBP组细胞cyclin D1的表达高于其他两组,而cyclin E和P27Kip1在各组细胞中的表达未见明显变化(图2)。由于cyclin D1在细胞从G1期到S期的过程中起着关键的调控作用,所以结果提示,IBP可能通过调节cyclin D1的表达从而缩短OSCC细胞的G1期,促进其进入S期,并加速OSCC细胞的增殖。
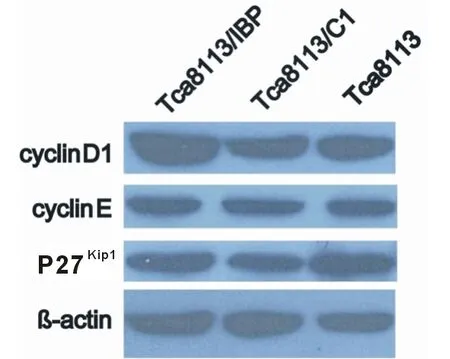
图2 IBP表达对口腔鳞癌细胞周期相关蛋白表达的影响
3 讨论
细胞周期调控对细胞的生长、分化及增殖至关重要,虽然OSCC的发病机制十分复杂,但细胞周期的失控导致异常增殖是最常见的分子机制。为探讨IBP促进OSCC增殖的机制,本实验结果显示:上调IBP表达组细胞较空质粒对照组细胞和未转染组细胞的G1期细胞含量少,提示IBP能缩短OSCC细胞的G1期促进其进入S期,从而加快OSCC的增殖。在细胞周期中,G1/S、G2/M和M期3个检查点功能的正常发挥,对维持基因组的稳定性非常关键,其功能丧失或降低则会导致细胞周期不能及时停止,从而可能导致肿瘤形成[6]。而在这3个检查点之中,G1/S期的失调最为常见,也尤为重要。细胞在该检测点对DNA损伤以及各类生长分裂原等复杂的细胞内外信号进行整合与传递,最终决定细胞分裂与否,决定其发生凋亡或退出细胞周期而进入G0期,确保遗传信息的准确无误[7-8]。
在G1向S期转换的过程中,受到多种蛋白和机制的调控,本研究采用Western blotting检测cyclin D1、cyclinE和P27Kip1在各组细胞中表达的变化,结果显示:Tca8113/IBP组细胞cyclin D1的表达高于Tca8113和Tca8113/C1组,而cyclin E和 P27Kip1在各组细胞中的表达未见明显变化。提示IBP可能通过调节cyclin D1的表达从而缩短OSCC细胞的G1期,促进其进入S期,并加快OSCC细胞的增殖。虽然既往报道表明,Rac1可以通过提高cyclin D1的表达调节细胞周期促进肿瘤的增殖,并且促进细胞的恶变[9-10];RhoA可以调节cyclin D1和P27Kip1的表达从而调控肿瘤的增殖[11];Cdc42同样也可以通过调节有丝分裂过程中染色体分离,进而影响细胞周期[12];但IBP具体是如何调控cyclin D1表达的还需进一步研究。
[1] Petersen PE.The World Oral Health Report 2003:continuous imp-rovement of oral health in the 21st century—the approach of the WHO Global Oral Health Programme[J].Community Dent Oral Epidemiol,2003,31(Suppl 1):3-23.
[2] Petersen PE.Global policy for improvement of oral health in the 21st century—implications to oral health research of World Health Assembly 2007,World Health Organization[J].Community Dent Oral Epidemiol,2009,37(1):1-8.
[3] 简从相,黄晓山,李晨军.Irf-4结合蛋白在口腔鳞癌中的表达及临床意义[J].实用口腔医学杂志,2012,4:478-481.
[4] 简从相,李晨军,黄晓山.Irf-4结合蛋白对人口腔鳞癌细胞生长作用的研究[J].西南国防医药,2012,22(5):470-472.
[5] He L,Wang H,Jin H,et al.CIAPIN1 inhibits the growth and proliferation of clear cell renal cell carcinoma[J].Cancer Lett,2009,276(1):88-94.
[6] Johnson DG,Walker CL.Cyclins and cell cycle checkpoints[J].Annu Rev Pharmacol Toxicol,1999,39:295-312.
[7] Resnitzky D,Reed SI.Different roles for cyclins D1 and E in regulation of the G1-to-S transition[J].Mol Cell Biol,1995,15(7):3463-3469.
[8] Brewer JW,Hendershot LM,Sherr CJ,et al.Mammalian unfolded protein response inhibits cyclin D1 translation and cell-cycle progression[J].Proc Natl Acad Sci U S A,1999,96(15):8505-8510.
[9] Westwick JK,Lambert QT,Clark GJ,et al.Rac regulation of trans-formation,gene expression,and actin organization by multiple,PAK-independent pathways[J].Mol Cell Biol,1997,17(3):1324-1335.
[10] Klein EA,Yang C,Kazanietz MG,et al.NF kappaB-independent sig-naling to the cyclin D1 gene by Rac[J].Cell Cycle,2007,6(9):1115-1121.
[11] Villalonga P,Ridley AJ.Rho GTPases and cell cycle control[J].Growth Factors,2006,24(3):159-164.
[12] Yasuda S,Taniguchi H,Oceguera-Yanez F,et al.An essential role of Cdc42-like GTPases in mitosis of HeLa cells[J].FEBS Lett,2006,580(14):3375-3380.
Effects of IRF-4 binding protein(IBP)on proliferation of OSCC cells
Pan Lei1,Jian Congxiang2,Li Zhuo2,Huang Xiaoshan3
1.Department of Stomatology,Hospital 85 of PLA,Shanghai,200050,China;2.Department of Stomatology,General Hospital of Chengdu Military Command,Chengdu,Sichuan,610083,China;3.The First Affiliated Hospital to Chengdu Medical College,Chengdu,Sichuan,610500,China
Objective To observe the potential effects of IRF-4 binding protein(IBP)on the proliferation of OSCC cells.Methods FACS analysis assay was applied to investigate the effects of over-expressed IBP on the cell cycling of Tca8113,Tca8113/C1 and Tca8113/IBP,while Western blotting assay was applied to detect the protein expression in related cell cycles.Results FACS analysis assay showed that IBP shortened the G1/S phase of OSCC and fastened its proliferation;the expression of cyclin D1 in Tca8113/IBP was stronger than those in Tca8113 and Tca8113/C1,while no significant differences were observed in the expression of cyclin E and P27kip1.Conclusions IBP may shorten the G1/S phase of OSCC and fasten its proliferation by regulating the expression of cyclin D1.
IRF-4 binding protein(IBP);oral squamous cell carcinoma;cell proliferation;cyclin D1
四川省教育厅科研资助项目(11ZB204)
200050 上海,解放军85医院口腔科(潘 磊);成都军区总医院附属口腔医院(简从相,李 卓);成都医学院第一附属医院口腔科(黄晓山)
黄晓山,电话:028-83016726;E-mail:hss1224@126.com
R 739.8
A
1004-0188(2014)05-0468-03
10.3969/j.issn.1004-0188.2014.05.002
2013-08-26)

