菊叶总黄酮抗肿瘤作用初步研究
卫 强, 徐 飞, 邱 镇, 纪小影
(安徽新华学院 药学院,安徽 合肥 230088)
菊叶总黄酮抗肿瘤作用初步研究
卫 强, 徐 飞, 邱 镇, 纪小影
(安徽新华学院 药学院,安徽 合肥 230088)
本文以MTT法考察菊叶中总黄酮的体外抗肿瘤活性;以小鼠移植瘤模型测定总黄酮对荷瘤小鼠抑瘤率和腹腔巨噬细胞吞噬能力,研究其体内抗肿瘤活性和免疫调节作用.结果表明,总黄酮对S180细胞生长有显著抑制作用.体内试验表明,与生理盐水组相比,总黄酮对小鼠S180实体瘤有显著抑制作用(P<0.01),抑瘤同时可促进体重增长;总黄酮高剂量组可提高荷瘤小鼠的脾指数和胸腺指数.与环磷酰胺组和生理盐水组比较,总黄酮可使荷S180实体瘤小鼠腹腔巨噬细胞吞噬能力升高,表明其对小鼠没有免疫抑制作用.
菊叶;总黄酮;抗肿瘤
安徽菊花道地药材有“亳菊”、“滁菊”、“贡菊”三种,具有清热明目之效[1].菊叶为植物菊花的茎上叶,有治疗疮、痈疽、头风、目眩的功效[2],菊叶提取物有抗菌、保护心肌缺血、抗氧化的作用.菊叶中主要含有黄酮类、挥发油、绿原酸三种成分[3].
国内研究表明,黄酮类化合物已成为新的抗肿瘤研究热点,目前已发现多种植物提取物中黄酮类成分有抗肿瘤活性,如鸡血藤黄酮类成分可抑制乳腺癌细胞生长[4],木瓜总黄酮对死亡因子(PD)-1与其配体(PD-L1)的结合有抑制作用,使肿瘤细胞表面PD-L1的表达降低而促进机体对肿瘤的免疫应答,达到抑制肿瘤细胞生长的作用[5].万寿菊茎叶中两种黄酮类化合物4'-甲氧基-泽兰素3-O-β-D-葡萄糖苷和山柰酚-3,7-O-α-L-双鼠李糖苷均可抑制人胃癌细胞SGC7901和人肝癌细胞SMMC7721的增殖,且呈现浓度与时间依赖性[6].黄明玉等[7]研究山茶花总黄酮抑制小鼠H22肝癌移植瘤生长,结果显示,总黄酮高、中剂量组可明显降低瘤体重量,显著增加小鼠脾和胸腺指数,显著提高巨噬细胞吞噬功能和淋巴细胞转化能力.本论文拟对菊叶中总黄酮的抗肿瘤作用进行初步研究,以期为其开发应用奠定一定的理论基础.
1 材料与方法
1.1 材料
1.1.1 试剂与药品
菊叶,来自安徽滁州地区;瘤株S180,由中国医学科学院肿瘤细胞库提供;MTT(噻唑蓝)、环磷酰胺,购于美国Sigma公司;其它试剂均为分析纯.
1.1.2 实验动物
清洁级雄性小鼠,体质量18-22g,由安徽医科大学动物实验中心提供,合格证号:皖医实动准字01号.
1.1.3 仪器与设备
SAFEDA MB-601型全自动酶标仪,北京赛必达科技有限公司;UV-4802S型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;CHP型CO2培养箱,常州普天仪器制造有限公司;Leica XDS-200倒置显微镜,上海蔡康光学仪器有限公司.
1.2 方法
1.2.1 菊叶总黄酮的提取[8]
称取菊叶粗粉20g,加入50%乙醇600ml回流提取时间3次(2h,1h,0.5h),抽滤,提取液浓缩至小体积,加水和石油醚萃取3次,将水液浓缩,备用.
1.2.2 菊叶总黄酮的纯化[9]
称取8g经预处理的X-5型大孔树脂,用水溶液装柱(2.5cm×30cm).量取供试液3mL加入相同量的聚酰胺,水浴蒸干后置于前面树脂柱中,水洗至无色.再以70%乙醇洗脱至125mL.提取液量(mL)与聚酰胺量(g)比例为1.5:1,树脂(g)-提取液(mL)为4:3,色谱柱径高比1:20,洗脱液收集量为2BV,得总黄酮(纯度80.1%).
1.2.3 瘤细胞悬液制备
选择接种后8d健康的S180种鼠,颈椎脱臼,固定于蜡板上,腹部皮肤消毒后,剪开并剥去腹部皮肤,用空针穿过腹部肌肉,无菌获取的腹水,以生理盐水稀释成肿瘤细胞悬液(浓度106个/mL).
1.2.4 抗肿瘤试验(MTT法)
将1.2.1项下S180细胞悬液接种于96孔板,保持每孔100μL.设菊叶总黄酮组、空白组、阴性对照组三个组别,每组6个复孔.接种后,在5%CO2饱和湿度孵箱内和37℃下培养,过夜,贴壁或离心后,对照组换液、药物组加入20、40、100、200、500mg/L的总黄酮培养液各60μL,培养48h后以MTT法检测细胞活力[10-11].每孔加入MTT液(3g/L)8μL,3h后,吸取培养液,加入120μL二甲基亚砜,在波长490nm处以酶标仪测定吸光度(A),计算细胞生长的抑制率.
1.2.5 对小鼠S180实体瘤生长和免疫器官的影响
选取60只ICR小鼠作为试验动物,将含106个/mL的S180细胞悬液接种到小鼠右前肢腋窝下,0.3mL/只.24h后,将小鼠随机分成生理盐水组、环磷酰胺组(22mg/kg)、菊叶总黄酮高、中、低三个剂量组(500、300、100mg/kg),共5组,每组12只.次日开始接种,隔日腹腔注射环磷酰胺,每日连续灌胃给予总黄酮.每日记录小鼠体重,观察并记录小鼠死亡时间.14d后脱颈椎处死小鼠,根据瘤块计算抑瘤率,根据胸腺和脾脏计算脏器指数[12].
1.2.6 对小鼠腹腔巨噬细胞吞噬能力的影响
动物分组及给药方法同“1.2.3”.小鼠处死后腹腔注射RPMI 1640培养液约3mL,收集腹腔液,离心2min(2500r/min),弃去上清液,以培养液调到每升含2×109个细胞.将巨噬细胞悬液接种于96孔板,保持每孔100μL,置5%CO2培养箱和37℃下培养4h,除去上清液,每孔加入50μL 0.2%中性红溶液,培养30min.取出培养板,以磷酸盐缓冲液数次冲洗,每孔加入100μL细胞裂解液,于570nm处进行可见-紫外分光光度计测定吸收度值[13-14].
1.2.7统计和分析
采用Cochran&Cox近似t检验.
2 结果与分析
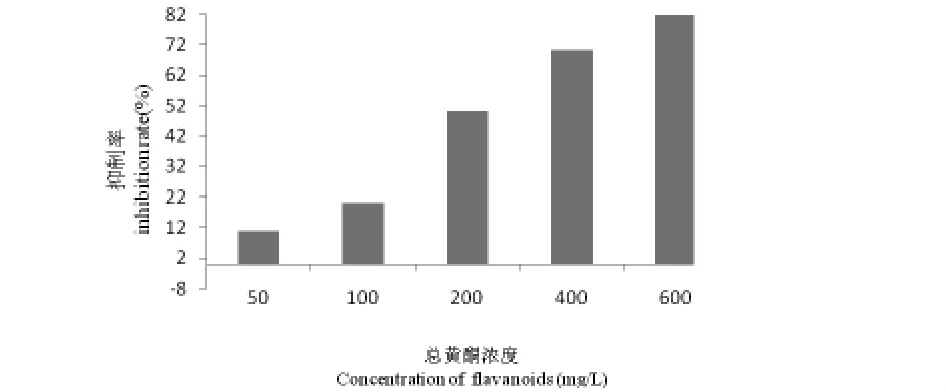
图1 菊叶总黄酮对S180细胞的抑制作用
2.1 体外对肿瘤细胞存活的抑制作用
如图1所示,菊叶总黄酮质量浓度与S180细胞存活的抑制有相关性,在浓度高于200mg/L时,对S180细胞抑制作用明显;在600mg/L时最高,抑制率为82.2%.
2.2 对S180荷瘤小鼠的影响
结果见表1和表2.
表1 菊叶总黄酮对S180荷瘤小鼠体重和抑瘤率的影响(n=12,±SD)

表1 菊叶总黄酮对S180荷瘤小鼠体重和抑瘤率的影响(n=12,±SD)
注:与生理盐水组相比,aP<0.05,bP<0.01;与环磷酰胺组比较,△P<0.05,△△P<0.01
组别 剂量(mg/kg) 体重增加量(g) 瘤重(g) 抑瘤率生理盐水组 15.71±2.09 1.99±0.21△△环磷酰胺组 20 15.01±3.08 0.92±0.26b 53.77总黄酮低剂量组 100 16.92±2.76 1.34±0.25b△△ 32.66总黄酮中剂量组 300 18.22±3.03a△ 1.21±0.36b△ 39.20总黄酮高剂量组 500 18.65±2.71a△ 1.05±0.37b 47.23
表2 菊叶总黄酮对S180荷瘤小鼠免疫器官的影响(n=12,±SD)

表2 菊叶总黄酮对S180荷瘤小鼠免疫器官的影响(n=12,±SD)
注:与生理盐水组相比,aP<0.05,bP<0.01;与环磷酰胺组比较,△P<0.05,△△P<0.01
胸腺指数(mg/g)生理盐水组 4.26±0.56 1.32±0.36环磷酰胺组 20 4.31±0.72 1.44±0.38总黄酮低剂量组 100 5.12±0.83a△ 1.52±0.29总黄酮中剂量组 300 5.46±0.91b△△ 1.61±0.37总黄酮高剂量组 500 5.71±0.68b△△ 1.70±0.42a组别 剂量(mg/kg)脾指数(mg/g)
由表1可知,与生理盐水组相比,不同剂量的菊叶总黄酮均可显著抑制S180实体瘤的生长(P<0.01),有剂量相关性;菊叶总黄酮高剂量组抑瘤率达到47.23%,略低于环磷酰胺对照组.总黄酮低剂量组与环磷酰胺组抑瘤率比较有显著性差异(P<0.01).总黄酮高、中、低剂量组在促进小鼠体重增长上与生理盐水组、环磷酰胺组相比均显示较显著性差异(P<0.05).由表2可知,环磷酰胺可明显抑制S180实体瘤的生长,但对提高小鼠免疫器官的免疫功能能力不显著.与环磷酰胺组比较,菊叶总黄酮高剂量组可使小鼠的脾指数和胸腺指数较显著的增加(P<0.05),表明其在抑瘤与增强荷瘤小鼠免疫功能方面有一定相关性.
2.3 对小鼠腹腔巨噬细胞吞噬能力的影响结果见表3.
表3 菊叶总黄酮对小鼠巨噬细胞吞噬能力的影响(n=12,±SD)
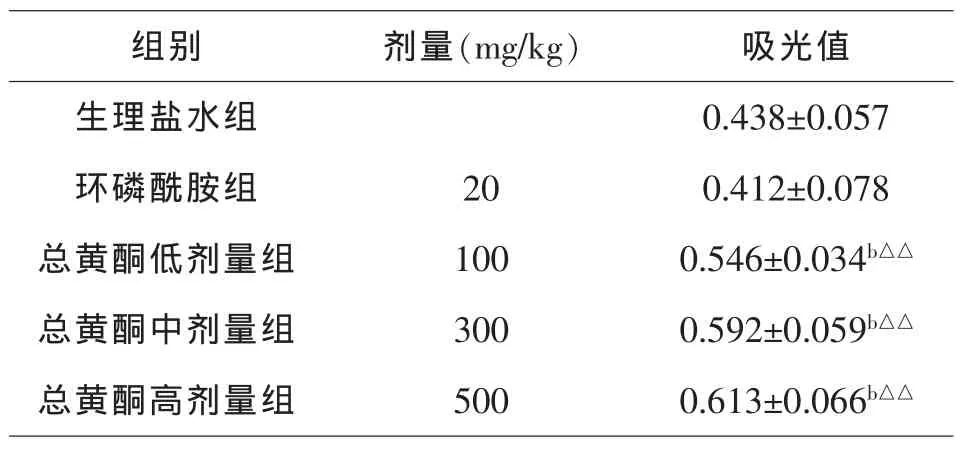
表3 菊叶总黄酮对小鼠巨噬细胞吞噬能力的影响(n=12,±SD)
注:与生理盐水组相比,bP<0.01;与环磷酰胺组相比,△△P<0.01
组别 剂量(mg/kg) 吸光值生理盐水组 0.438±0.057环磷酰胺组 20 0.412±0.078总黄酮低剂量组 100 0.546±0.034b△△总黄酮中剂量组 300 0.592±0.059b△△总黄酮高剂量组 500 0.613±0.066b△△
由表3可知,与生理盐水组相比,环磷酰胺组可使小鼠腹腔巨噬细胞吞噬能力降低5.94%,表明其对S180实体瘤小鼠免疫功能有明显抑制作用.与生理盐水组相比,菊叶总黄酮高、中、低剂量组可使腹腔巨噬细胞吞噬能力显著升高(P<0.01),分别增加39.95%、35.16%和24.66%.
3 结论与讨论
菊叶资源蕴藏量丰富,据统计,贡菊和杭菊每年有5000吨左右[15]的产量.从产量上来说,菊叶比菊花大得多.由于菊叶不能直接作为药用,菊花被采集时,菊叶被大量废弃.根据对滁菊花提取工艺研究结果,滁菊花中总黄酮的平均含量为6.70%[16],滁菊叶中总黄酮的平均含量为10.06%[8].可见,菊叶中黄酮成分相对菊花有明显的含量优势,有较高的开发利用价值.
本实验以MTT法证明菊叶总黄酮对S180细胞生长有显著抑制作用,在质量浓度达到600mg/L时最高,抑制率为82.2%.实验建立了小鼠移植瘤模型,通过测定菊叶总黄酮对荷瘤小鼠抑瘤率和腹腔巨噬细胞吞噬能力,证明了总黄酮对小鼠S180实体瘤有显著抑制作用,抑制肿瘤生长同时,可明显提高小鼠体重.菊叶总黄酮高剂量组可提高荷瘤小鼠的脾指数和胸腺指数;通过与环磷酰胺组和生理盐水组比较,证实菊叶总黄酮可使荷S180实体瘤小鼠腹腔巨噬细胞吞噬能力显著升高,表明其没有免疫抑制作用.
〔1〕国家药典委员会.中华人民共和国药典(一部) [M].北京:化学工业出版社,2010.292.
〔2〕江苏新医学院.中药大辞典[M].上海:上海科技出版社,1997.2008-2011.
〔3〕钱大玮,朱玲英,彭蕴如,等.菊花、茎、叶中总黄酮及绿原酸含量动态分析评价[J].现代中药研究与实践,2005,6(19):14-16.
〔4〕南楠,张甘霖,于明薇,等.鸡血藤黄酮类提取物SSCE安全性及抗肿瘤作用的研究[J].辽宁中医杂志,2014,41(3):580-582.
〔5〕刘爱华,田慧群,覃晓琳,等.木瓜总黄酮抗肿瘤活性研究[J].中国药房,2014,25(7):599-601.
〔6〕张宇,曲佐寅,刘立新,等.万寿菊茎叶中2种黄酮类化合物的体外抗肿瘤活性[J].中国实验方剂学杂志,2013,19(13):233-237.
〔7〕黄明玉,罗胜勇.山茶花总黄酮抗肿瘤作用的实验研究[J].中国医药指南,2012,10(1):3.
〔8〕卫强.汪庆健.滁菊茎、叶中总黄酮的提取工艺研究[J].中兽医医药杂志,2009(1):39-40.
〔9〕卫强,戴一,吴燕,等.聚酰胺-大孔树脂联用纯化菊叶总黄酮初步研究[J].中药材,2011,34(8):1585-1288.
〔10〕Borchers A.T.,Keen C.L.,Gershw in M.E.,et al.Mushrooms,tumors,and immunity:an update[J].Experimental Biology and Medicine, 2004,229(5):393-406.
〔11〕李庆勇,王春成.独角莲超临界萃取物的GCMS分析及体外抑瘤活性[J].植物研究,2011,31 (1):113-116.
〔12〕Cai Z.B.,Li.W.,Wang H.T.,et al.Antitumor effects of a purified polysaccharide from Rhodiola rosea and its action mechanism[J]. Carbohydrate Polymers,2012,90(1):296-300.
〔13〕田维毅,王文佳,李海峰,等.中性红法检测巨噬细胞吞噬功能的实验条件的优化[J].贵阳中医学院学报,2009,31(2):23-26.
〔14〕Fan L.P.,Ding S.D.,Ai L.Z.,et al.Antitumor and immunomodulatory activity of water-soluble polysaccharide from inonotus obliquus[J].Carbohydrate Polymers,2012,90(2): 870-874.
〔15〕王德群,刘守金,梁益敏.中国药用菊花的产地考察[J].中国中药杂志,1999,24(9):522.
〔16〕卫强,彭如玉,钱纪伟.均匀设计法提取滁菊花总黄酮的工艺研究 [J].中兽医医药杂志,2007,26(6):36-37.
R285;R979.1
A
1673-260X(2014)10-0072-03
安徽省高等学校省级自然科学研究项目(KJ2013B103);国家大学生创新创业训练项目(201312216028,201312216029);安徽省大学生创新创业训练项目 (AH 201312216001);安徽省质量工程项目 (2013gxk105);安徽新华学院质量工程项目(2013gxkcx01)

